ОНХимияПлакидкин. Теоретические основы химии
 Скачать 25.3 Mb. Скачать 25.3 Mb.
|
|
Простые вещества По составу соединения подразделяются на: простые (состоящие из одного типа химических элементов), бинарные (состоящие из двух элементов) и сложные. По функциональным признакам простые вещества делятся на металлы и неметаллы, их названия приведены в периодической системе элементов Менделеева. Неметаллов мало, всего 22. К неметаллам относят все элементы VIIIА-группы (благородные газы) и VIIА-группы (галогены), элементы VIА-группы (кроме полония), элементы азот, фосфор, мышьяк (VА-группа); углерод, кремний (IVА-группа); бор (IIIА-группа), а также водород. Остальные элементы относят к металлам. Бинарные соединения В бинарных соединениях – справа располагается более электроотрицательный элемент: например NaCl - хлорид натрия. В названии бинарных соединений к корню более электроотрицательного элемента добавляется суффикс -ид (силицид, нитрид, фторид, карбид, гидрид, оксид и т.д.). Некоторые псевдобинарные соединения называются также как бинарные. Например, NaCN – цианид натрия, NaSCN – роданид натрия. Интерметаллиды (соединения металлов между собой) называются отлично от остальных бинарных соединений, например, Cu3Au – три медь золото. Сложные соединения Основность кислоты – число Н+ групп в молекуле. Кислотность основания – число ОН групп в молекуле. Номенклатура оснований Основания называются как бинарные соединения. Если металл переменной валентности, то обязательно указывается его степень окисления (римскими цифрами в круглых скобках). Например Fe(OH)3 – гидроксид железа(III); Fe(OH)2 – гидроксид железа(II). Номенклатура кислот В бескислородных кислотах используется суффикс «о» – НСl (хлор0водород); HF (фтор0водород) и т.д. Кислородные кислоты. Если элемент образует несколько кислот в разной степени окисления кислотообразующего элемента, то в случае высшей валентности добавляется суффикс –ная (H2SO4 – серная) или –овая (H2CrO4 – хромовая). S и Cr имеют степень окисления +6 и находятся в VI группе (значит это высшая степень окисления. Для не высшей степени окисления суффикс –истая (H2SO3 – сернистая) или –овистая (HAsO2 – мышьяковистая) Степень окисления серы +4, находится в VI группе (не высшая степень окисления). Степень окисления мышьяка +3, находится в V группе (не высшая степень окисления). Для элементов, образующих кислоты в более чем две степени окисления, например, для кислородных кислот хлора (HClO, HClO2, HClO3, HClO4) используются следующие суффиксы в названии кислот. HClO – хлорноватистая, степень окисления хлора +1; HClO2 хлористая, степень окисления хлора +3; HClO3 хлорноватая, степень окисления хлора +5; HClO4 хлорная, степень окисления хлора +7; Если кислоты отличаются только количеством воды в кислоте, то в названии кислоты богатой водой используется приставка «орто», например ортофосфорная Н3РО4. Если в кислоте мало воды, то используется приставка «мета», например метафосфорная НРО3. Если в кислоте имеется два и более кислотообразующих элемента, то используются греческие приставки (ди-, три-, тетра- и т.д.). H2Cr2O7 – дихромовая; H2B4O7 – тетраборная. Номенклатура солей Средние соли Если кислотообразующий элемент находится в высшей степени окисления, то к корню элемента добавляется суффикс ат, если не в высшей, то – ит. Например Na2SO4 – сульфат натрия, Na2SO3 – сульфит натрия. К солям орто- или метакислот добавляются их приставки. Например, Na3РO4 – ортофосфат натрия, NaРO3 – метафосфат натрия. Для солей кислот, имеющих два и более кислотообразующих элемента, используются греческие приставки (ди-, три-, тетра- и т.д.). К2Cr2O7 – дихромат калия; Na2B4O7 – тетраборат натрия. Для солей галогенокислородных кислот используются следующие суффиксы и приставки: КClO гипохлорит КClO2 хлорит КClO3 хлорат КClO4 – перхлорат. Кислые соли могут образовывать только многоосновные кислоты. При этом добавляется приставка гидро-. NaHSO4 – гидросульфат натрия. NaH2PO4 – дигидрофосфат натрия. Основные соли могут образовывать только многокислотные основания. При этом добавляется приставка гидроксо-. (СаОН)2SO4 – сульфат гидроксокальция. MgOHCl – хлорид гидроксомагния. Al(OH)2Cl – хлорид дигидроксоалюминия. Обращаю Ваше внимание, что в Al(OH)2Cl – хлориде дигидроксоалюминия на 1 моль алюминия приходится 2 моль ОН-, поэтому приставка ди-. Для (СаОН)2SO4 – сульфата гидроксокальция на 1 моль кальция приходится 1 моль ОН-, поэтому просто гидроксо-. Пример. Напишите названия следующих соединений: Ca(NO2)2, Cr2O3, CrO3, H3PO4, HPO3, HPO2. Напишите формулы соединений по их названиям: сульфат гидроксокальция, гидросульфит железа(II), оксид азота(I), метасиликат натрия, ортосиликат калия. Решение. Ca(NO2)2 – нитрит кальция. Азот (+3) находится не в высшей степени окисления, значит суффикс ит . Кальций – металл постоянной валентности, степень окисления не ставится. Cr2O3 – оксид хрома( III ). Бинарное соединение, значит суффикс ид . Хром – металл переменной валентности, ставим степень окисления. CrO3 - оксид хрома(VI). H3PO4 – ортофосфорная кислота. Фосфор в высшей степени окисления – окончание –ная , воды много – приставка орто- . HPO3 - метафосфорная кислота. Фосфор в высшей степени окисления – окончание –ная , воды мало – приставка мета- . HPO2 метафосфористая кислота. Фосфор (+3) не в высшей степени окисления – окончание –истая , воды мало – приставка мета- . Сульфат гидроксокальция – (СаОН)2SO4 сульфат, значит соль серной кислоты (сера в высшей степени окисления (+6)), приставка гидроксо-, значит к катиону (Са) добавляется ОН-. Заряд СаОН+ стал +2-1=+1, а заряд сульфат иона SO42-; гидросульфит железа (II) – Fe(HSO3)2 сульфит, значит соль сернистой кислоты H2SO3 (сера не в высшей степени окисления (+4)),приставка гидро-, значит к аниону добавляется Н+. Заряд HSO3- стал -2+1= -1, а Fe2+; оксид азота(I) – N2O - суффикс - ид значит бинарное соединение, азот – элемент переменной валентности, степень окисления +1; метасиликат натрия – Na2SiO3 – суффикс –ат значит кремний в высшей степени окисления (+4). приставка мета-, значит то соль метакремниевой кислоты (мало воды) Н2SiO3 ; ортосиликат калия – К4SiO4 – кремний (+4) в высшей степени окисления, значит суффикс –ат. Это соль ортокремниевой кислоты (много воды) Н4SiO4 2.2. Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, алюминия; переходных металлов (меди, цинка, хрома, железа) Щелочные металлы Щелочными элементами начинаются периоды периодической системы, поэтому их атомы имеют только по одному валентному электрону, у них наименьшие ионизационные потенциалы и наиболее отрицательные значения электродных потенциалов:
Поэтому все щелочные металлы являются типичными металлами без признаков амфотерности. Среди всех металлов они являются наиболее сильными восстановителями. Отдавая единственный валентный электрон, их атомы легко превращаются в однозарядные катионы и образуют многочисленные ионные соединения только в одной степени окисления +1. Очень бурно протекают реакции щелочных металлов с водой: 2Na + 2H2O = 2NaOH + H2 В кристаллизатор налили воды и добавили фенолфталеин (для определения NaOH) . Опустили горошину натрия. За счет выделения водорода она активно перемещается по воде, раствор окрашивается в малиновый цвет (образуется NaOH), выделяется много тепла и при большем количестве натрия может произойти взрыв водорода. 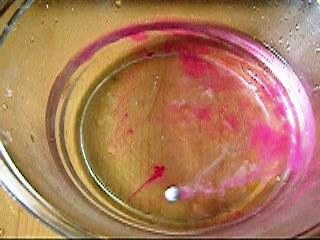  Из кислот-неокислителей щелочные металлы вытесняют водород: 2К + 2НСl = 2KCl + H2, а кислоты-окислители восстанавливаются ими максимально: 8Na + 10HNO3 = 8NaNO3 + NH4NO3 + 3H2O 8K + 5H2SO4(конц) = 4K2SO4 + H2S + 4H2O При взаимодействии с избытком кислорода литий образует оксид лития Li2O, натрий - пероксид натрия Na2O2, а остальные щелочные металлы (К, Rb, Cs -- надпероксиды ЭО2. Щелочноземельные металлы Основные характеристики щелочноземельных металлов
Строение валентных оболочек атомов этих элементов ns2, заряды ядер атомов на единицу больше, чем у щелочных элементов тех же периодов. Это приводит к уменьшению радиуса атомов и увеличению ионизационных потенциалов и, следовательно, к уменьшению их химической активности. Щелочноземельные металлы химически очень активны. При комнатной температуре они медленно окисляются кислородом воздуха, а при нагревании сгорают с образованием оксидов. Магний сгорает, излучая ослепительно-белый свет со значительной долей ультрафиолетовых лучей. Это раньше использовалось при фотографировании.  Магний нельзя гасить водой, так как может взорваться, выделяющийся при реакции магния с водой, водород. На заводе по переработке вторичного сырья в Уолтон Хиллс, штат Огайо возник пожар. В здании было большое количество металлов, среди них - титан, сталь и магний. Пожарные, опасаясь, что огонь перекинется на соседнюю бензозаправку, решили залить горящее здание водой. Результат не заставил себя ждать - произошел сильный взрыв, во все стороны разлетелись куски раскаленного добела магния. Ослепительное огненное облако поднялось на высоту 50 м. Однако пожарных это не остановило - они продолжили заливать здание, что вызвало новые взрывы магния. От жара огня начали плавиться стены здания. Таким образом, незнание пожарными химии магния привело к катастрофическим результатам.  Щелочноземельные металлы взаимодействуют с водой, вытесняя из нее водород и образуя щелочи Са(ОН)2, Sr(OH)2 и Ва(ОН)2. При опускании кусочка кальция в воду начинает выделятся водород, который облепляет металл и он всплывает. Со временем происходит помутнение раствора образуется малорастворимый Са(ОН)2, что доказывает малиновое окрашивание, если добавить фенолфталеин.     С водородом, азотом и другими неметаллами они взаимодействуют с образованием соответствующих ионных гидридов, нитридов и т.д. Щелочноземельные металлы образуют множество обычных солей, но комплексных соединений эти элементы не образуют. Алюминий – активный (= -1,66 В), легкий металл с температурой плавления 660С. На воздухе он покрывается тончайшей пленкой оксида, которая защищает его от дальнейшего окисления и действия воды. Однако, при удалении защитной пленки и при нагревании алюминий энергично взаимодействует с кислородом, галогенами, серой, соединяется с азотом и углеродом. Взаимодействие алюминия с серой при нагревании. Смешать один объем алюминиевой пудры и 2 серы. Смесь нагреть. Идет бурная реакция, похожая не бенгальский огонь.  Алюминий восстанавливает многие металлы из оксидов, этот метод получения металлов называется алюмотермией. 1. Поджигание смеси алюминия и оксида железа. 2. Горение термита – алюмотермия. 3. Застывшее железо.    Алюминий взаимодействует с выделением водорода со всеми галогеноводородными кислотами и разбавленной серной кислотой: 2Al + 6HCl = 2AlCl3 + 3H2 2Al + 6H2SO4 = Al2(SO4)3 + 3H2, а с разбавленной азотной кислотой (концентрация 2-3М) - с образованием преимущественно нитрата аммония: 8Al + 30HNO3 = 8Al(NO3)3 + 3NH4NO3 + 9H2O В концентрированных HNO3 и H2SO4 алюминий пассивируется, что позволяет хранить и транспортировать эти кислоты в емкостях из алюминия. Алюминий легко взаимодействует со щелочами, т.к. они растворяют оксидную пленку. Во всех соединениях алюминий находится в степени окисления +3. Все d-элементы являются металлами, т.к. внешние s-электроны слабо удерживаются атомами. Однако энергия межатомных связей в кристаллических решетках этих металлов обусловлена не только делокализованными s-электронами, но и дополнительными ковалентными связями между неспаренными электронами d-орбиталей. Поэтому d-металлы (кроме цинка, кадмия и ртути) прочны и тугоплавки, особенно находящиеся в средней части декад (Cr, Mo, W, Mn, Tc, Re). При образовании соединений в химических связях используются s-электроны и все или часть d-электронов. Поэтому для d-элементов свойственны переменная валентность, разнообразие и широкие пределы изменения основно-кислотных и окислительно-восстановительных свойств соединений. С увеличением степени окисления элемента в его однотипных соединениях изменяется характер связи от ионной ко все более ковалентной. Поэтому, например, низшие оксиды и гидроксиды являются основными, а высшие - кислотными, низшие галогениды - ионные растворимые соли, а высшие - молекулярные, легколетучие гидролизующиеся вещества. С увеличением степени окисления возрастает окислительная и уменьшается восстановительная активность соединений. Весьма характерно для d-элементов образование многочисленных и прочных комплексных соединений. В комплексных соединениях d-элементы образуют связи с лигандами по донорно-акцепторному механизму в качестве акцептора электронных пар. В царской водке, концентрированной H2SO4 и азотной кислоте любой концентрации хром пассивируется, но он способен вытеснять водород из кислот-неокислителей с образованием CrCl2 и CrSO4. При значительном нагревании хром взаимодействует с концентрированными HNO3 и H2SO4, окисляясь до трехвалентного состояния: Cr + 6HNO3 = Cr(NO3)3 + 3NO2 + 3H2O Состояние +3 наиболее устойчиво для хрома; в этой степени окисления у него существует множество обычных и комплексных соединений, кристаллогидратов и квасцов. СrCl3 – безводный;   П  |
