ОНХимияПлакидкин. Теоретические основы химии
 Скачать 25.3 Mb. Скачать 25.3 Mb.
|
|
2.4. Характерные химические свойства оксидов: основных, амфотерных, кислотных. Оксидами называются сложные вещества, которые состоят из кислорода (в степени окисления -2) и другого элемента. Основные – это оксиды, которым соответствуют основания. К2О – КОН; ВаО – Ва(ОН)2; La2O3 – La(OH)3. Кислотные – это оксиды, которым соответствуют кислоты. SO3 –H2SO4; CO2 – H2CO3; SO2 – H2SO3 и т.д. Амфотерные – это оксиды, которым соответствуют амфотерные основания. ZnO – Zn(OH)2; Al2O3 – Al(OH)3. Из основных, кислотных и амфотерных оксидов можно получать соли, поэтому их называют солеобразующими, но имеется небольшая группа оксидов, которые солей не образуют. У них нет соответствующих кислот и оснований, поэтому они называются несолеобразующими (безразличными). К ним относятся СО, N2O, NO, SiO. Неметаллы образуют кислотные и несолеобразующие оксиды, а металлы, в зависимости от степени их окисления, могут образовывать и основные, и амфотерные, и кислотные оксиды. Если степень окисления металла +1 и +2, то оксиды обладают основными свойствами, за исключением ZnO, BeO, SnO, PbO. Слабыми амфотерными свойствами обладают Ag2O и Cu2O. Если степень окисления металла +3 и +4, то оксиды обладают амфотерными свойствами, за исключением La2O3, Bi2O3, Tl2O3, которые обладают основными свойствами. При степени окисления металла больше +4 оксиды являются кислотными. Химические свойства оксидов определяются их взаимодействием с водой, кислотами и основаниями. 1. Основные оксиды наиболее активных металлов (щелочных и щелочно-земельных) взаимодействуют с водой с образованием сильных оснований – щелочей. Основные оксиды менее активных металлов с водой при обычных условиях не взаимодействуют. Все основные оксиды взаимодействуют с кислотами с образованием соли и воды. С основаниями основные оксиды не взаимодействуют. 2. Многие кислотные оксиды взаимодействуют с водой с образованием кислот: Некоторые кислотные оксиды при обычных условиях с водой не взаимодействуют. Все кислотные оксиды взаимодействуют с основаниями с образованием соли и воды. С кислотами кислотные оксиды не взаимодействуют. 3. Основные и кислотные оксиды взаимодействуют между собой с образованием соли. 4. Амфотерные оксиды обладают и основными и кислотными свойствами, поэтому реагируют и с кислотами, и с основаниями. В этих реакциях образуются соль и вода. Амфотерный оксид Al2O3 реагирует с кислотой: Он же взаимодействует с основаниями. При взаимодействии с расплавленными щелочами образуется алюминат натрия, а в водном растворе щелочи – комплексная соль (тетрагидроксоалюминат(III) натрия). 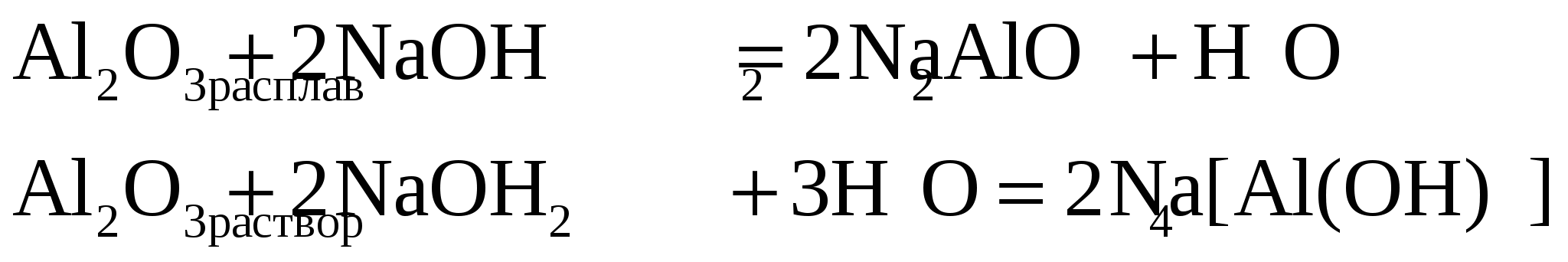 5. Амфотерные оксиды взаимодействуют с кислотными и основными оксидами, а также между собой. Обычно эти реакции идут при нагревании с образованием солей. 2.5. Характерные химические свойства оснований и амфотерных гидроксидов. С точки зрения теории электролитической диссоциации основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы. КОН К+ + ОН- NH4OH NH4+ + OH- Гидроксид щелочных и щелочно-земельных металлов являются растворимыми и называются щелочами. К растворимым основаниям относится и гидроксид аммония, но это слабый электролит. По взаимодействию с другими веществами основания подразделяются на типичные и амфотерные. К типичным основаниям относятся все щелочи, а также Mg(OH)2, Mn(OH)2, La(OH)3, Bi(OH)3 и некоторые другие. Все гидроксиды (вещества, содержащие в своем составе ОН-группу) подразделяются на основные, амфотерные и кислотные. Это зависит от заряда катиона металла. Если заряд катиона металла +1 или +2, то гидроксид обладает основными свойствами, но есть исключения La(OH)3, Bi(OH)3, Tl(OH)3 – являются основаниями, а Be(OH)2, Sn(OH)2, Pb(OH)2, Zn(OH)2, Ge(OH)2 хотя и имеют заряд катиона металла +2, являются амфотерными основаниями. В Na – OН заряд катиона натрия +1, он слабо притягивает кислород ОН-группы и связь Na – O слабая. Происходит разрыв по этой связи при диссоциации электролита в воде. Na – OН Na+ + ОН- Амфотерными основаниями являются гидроксиды, катионы металла которых имеют заряд +3 и +4, за некоторым исключением, приведенным выше. В зависимости от условий опыта их диссоциация может происходить как по основному, так и по кислотному типу. H+ + HZnO2- HO – Zn – OH ZnOH+ + OH- Свойства оснований Типичные основания взаимодействуют с кислотами и кислотными оксидами с образованием солей и воды. Ва(ОН)2 + СО2 = ВаСО3 + Н2О; КОН + HCl = KCl + Н2О Щелочи и гидроксид аммония взаимодействуют с растворами солей, если образуются нерастворимые основания. 2КОН + FeCl2 = 2KCl + Fe(OH)2 6NH4OH + Al2(SO4)3 = 2Al(OH)3 + 3(NH4)2SO4 Амфотерные основания взаимодействуют как с кислотами, так и со щелочами с образованием соли и воды. В реакции с кислотами они проявляют свойства типичных оснований. Cr(OH)3 + 3HCl = CrCl3 + 3H2O При взаимодействии со щелочами амфотерные основания проявляют свойства кислот. При сплавлении со щелочами образуется соль и вода: Zn(OH)2 + 2NaOHрасплав = Na2ZnO2 + 2H2O, а при взаимодействии с растворами щелочей образуются комплексные соли. Zn(OH)2 + 2NaOHраствор = Na2[Zn(OН)4]. Реакция кислоты с основанием называется реакцией нейтрализации. В ней катионы кислот Н+ и анионы оснований ОН- образуют молекулы воды, и среда раствора становится нейтральной. В результате реакции нейтрализации выделяется тепло, в разбавленных растворах это ведет к разогреву жидкости, но в случае крепких растворов тепла более чем достаточно, чтобы жидкость закипела. Важным является то, что реакция нейтрализации происходит быстро (как и другие ионные реакции в растворе).  Щелочи растворяют амфотерные металлы. При этом выделяется водород. 2Al +2NaOH + 6H2O = 2Na[Al(OH)4]+3H2# В результате реакции при опускании в раствор щелочи алюминия выделяется газ (водород). Это доказывается при его поджигании.   2.6. Характерные химические свойства кислот. Кислотами называются вещества, при электролитической диссоциации которых образуются только катионы водорода Н+ и никаких других катионов не образуется. Анионы, образующиеся при диссоциации кислот называются кислотными остатками. По составу кислотного остатка все кислоты делятся на кислородные и бескислородные. Кислородные кислоты тоже являются гидроксидами, так как содержат в своем составе ОН-группу. Если металл в гидроксиде имеет степень окисления больше 4, то образуется кислота: HVO3, H2CrO4, HMnO4. Неметаллы же в гидроксиде, независимо от степени окисления образуют только кислоты: HClO, HNO2, H2CO3. Свойства кислот Большинство кислот хорошо растворяются в воде, растворы имеют кислый вкус, изменяют цвет индикаторов. Сильные кислоты взаимодействуют со щелочами. Это, как указывалось выше, реакция нейтрализации, потому что кислая среда кислоты и щелочная среда щелочи превращается в нейтральную среду воды. Сокращенное ионное уравнение реакции нейтрализации одинаково для любой пары кислота-щелочь. Оно имеет вид Н+ + ОН- = Н2О и отражает саму сущность реакции нейтрализации. Кислоты взаимодействуют с типичными и амфотерными основаниями, а также с основными и амфотерными оксидами с образованием соли и воды. 2HCl + Mg(OH)2 = MgCl2 + 2H2O; H2SO4 + MgO = MgSO4 + H2O 3HNO3 +Al(OH)3 = Al(NO3)3 + 3H2O; 6HCl + Al2O3 = 2AlCl3 + 3H2O Данные реакции протекают до конца, потому что образуется очень устойчивый слабый электролит – вода, в результате этого растворяются многие оксиды и нерастворимые основания. Возможно взаимодействие кислот с солями, если при этом образуются малорастворимые или газообразные вещества. HCl + AgNO3 = AgCl + HNO3 2HNO3 + CaCO3 = Ca(NO3)2 + H2O + CO2 H2SO4 + Na2SiO3 = H2SiO3 + Na2SO4 Особое внимание следует уделить взаимодействию кислот с металлами. Взаимодействие кислот с металлами При взаимодействии соляной и разбавленной серной кислот с металлами окислителем является катион водорода Н+, поэтому они взаимодействуют с металлами, стоящими в ряду напряжений до водорода. Mg + 2HCl = MgCl2 + H2; Mg + H2SO4(разб.) = MgSO4 + H2 Металлы переменной валентности соляной и разбавленной серной кислотами окисляются до низших степеней окисления. Железо имеет наиболее распространенные степени окисления +2 и +3. При реакции с этими кислотами железо окисляется до степени окисления +2. Fe + 2HCl = FeCl2 + H2 Свинец является более активным элементом, чем водород, но в процессе реакции на его поверхности образуется плотная нерастворимая пленка хлорида или сульфата свинца(II) и реакция практически не протекает. В концентрированной серной кислоте окислителем является сульфат ион При взаимодействии концентрированной серной кислоты с активными металлами 8К + 5H2SO4(конц.) = 4К2SO4 + H2S +4H2O. Малоактивные металлы восстанавливают серную кислоту преимущественно до SO2. φ0(Ag/Ag+) = +0,8В – неактивный металл. 2Ag + 2H2SO4(конц.) = Ag2SO4 + SO2 +2H2O Металлы средней активности 3Cd + 4H2SO4(конц.) = 3CdSO4 + S +4H2O Металлы переменной валентности окисляются концентрированной серной кислотой, как правило, до высшей степени окисления. 3Sn + 8H2SO4(конц.) = 3Sn(SO4)2 + 2S +8H2O Благородные металлы (Au, Pt и некоторые другие) с концентрированной серной кислотой не взаимодействуют ни при каких условиях. Некоторые металлы (Al, Fe, Cr, Ni и др.) не взаимодействуют с концентрированной серной кислотой при обычных условиях (пассивируются), но взаимодействуют при нагревании. Это свойство железа позволяет хранить и перевозить концентрированную серную кислоту в емкостях из обычной стали. Свинец с концентрированной серной кислотой взаимодействует с образованием растворимой кислой соли. Pb + 3H2SO4(конц.) = Pb(HSO4)2 + SO2 +2H2O В азотной кислоте, независимо от ее концентрации, окислителем является нитрат-ион При взаимодействии металлов с концентрированной азотной кислотой продуктом ее восстановления является преимущественно NO2, независимо от природы металла. Mg + 4HNO3(конц.) = Mg(NO3)2 + NO2 +2H2O При реакции выделяется бурый газ NO2  Zn + 4HNO3(конц.) = Zn(NO3)2 + NO2 +2H2O  Cu + 4HNO3(конц.) = Cu(NO3)2 + NO2 +2H2O При опускании кусочка меди в концентрированную азотную кислоту выделяется бурый газ, а на дне образуется голубой раствор нитрата меди(II)    Металлы переменной валентности при взаимодействии с концентрированной азотной кислотой окисляются до высшей степени окисления, а металлы, которые окисляются до степени окисления +4 и выше, образуют кислоты или оксиды. Sn + 4HNO3(конц.) = H2SnO3 + 4NO2 +H2O 2Sb + 10HNO3(конц.) = Sb2O5 + 10NO2 +5H2O Mo + 6HNO3(конц.) = H2MoO4 + 6NO2 +2H2O В концентрированной азотной кислоте пассивируются Al, Fe, Cr, Ni, Со и некоторые другие металлы. После обработки азотной кислотой эти металлы не реагируют и с другими кислотами. При взаимодействии металлов с разбавленной азотной кислотой продукт ее восстановления зависит от активности металла: чем активнее металл, тем в большей степени восстанавливается азотная кислота. Активные металлы восстанавливают азотную кислоту максимально. 8Na + 10HNO3(разб.) = 8КNO3 + NH4NO3 +3H2O Продуктами восстановления разбавленной азотной кислоты металлами средней активности являются азот или оксид азота(I). 4Cd + 10HNO3(разб.) = 4Cd(NO3)2 + N2O +5H2O 5Mn + 12HNO3(разб.) = 5Mn(NO3)2 + N2 +6H2O При взаимодействии разбавленной азотной кислоты с малоактивными металлами продуктом восстановления является оксид азота(II). 3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO +4H2O Надо обратить внимание, что при реакции с азотной кислотой получается смесь соединений азота, но мы записываем то соединение, которое получается в большем количестве. Основное правило: чем выше активность металла и ниже концентрация азотной кислоты, тем ниже степень окисления азота в том соединении, которое образуется больше других. Для окисления золота, платины и других благородных металлов используется смесь концентрированных азотной и соляной кислот, называемая «царской водкой». В этой смеси образуется очень сильный окислитель - атомарный хлор: HNO3 + 3HCl = NOCl + Cl2 + 2H2O NOCl = NO + Cl и повышается восстановительная активность металлов вследствие образования комплексов, поэтому окисление благородных металлов происходит с образованием комплексных кислот: Au + HNO3 + 4HCl = H[AuCl4] + NO + 2H2O 3Pt + 2HNO3 + 12HCl = 3H2[PtCl4] + 2NO + 4H2O Некоторые металлы Nb, Ta, W не растворяются даже в «царской водке», но растворяются в смеси азотной и фтороводородной кислот. 3Ta + 5HNO3 + 21HF = 3H2TaF7 + 5NO + 10H2O W + 2HNO3 + 8HF = H2WF8 + 2NO + 4H2O |
