ОНХимияПлакидкин. Теоретические основы химии
 Скачать 25.3 Mb. Скачать 25.3 Mb.
|
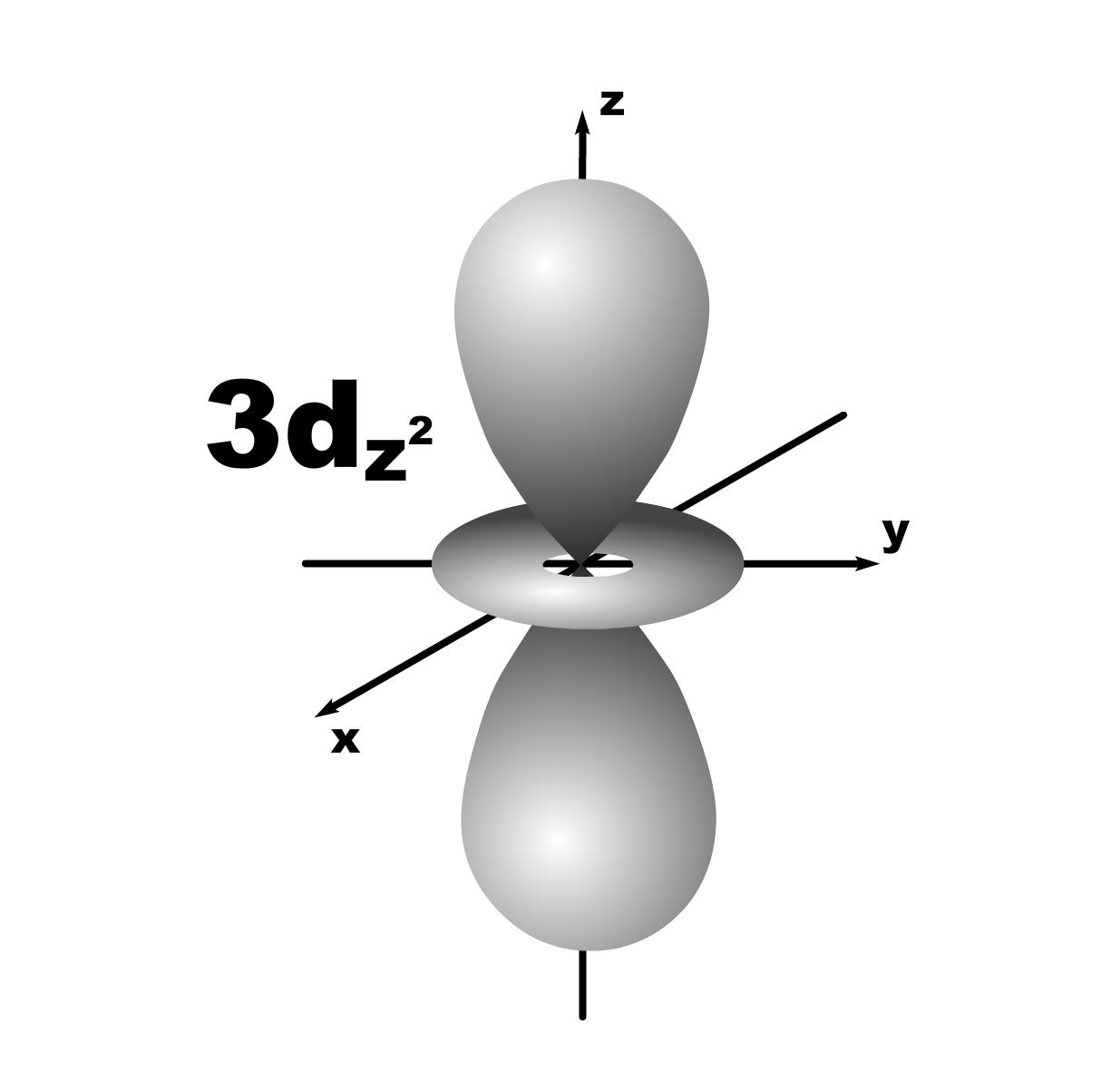
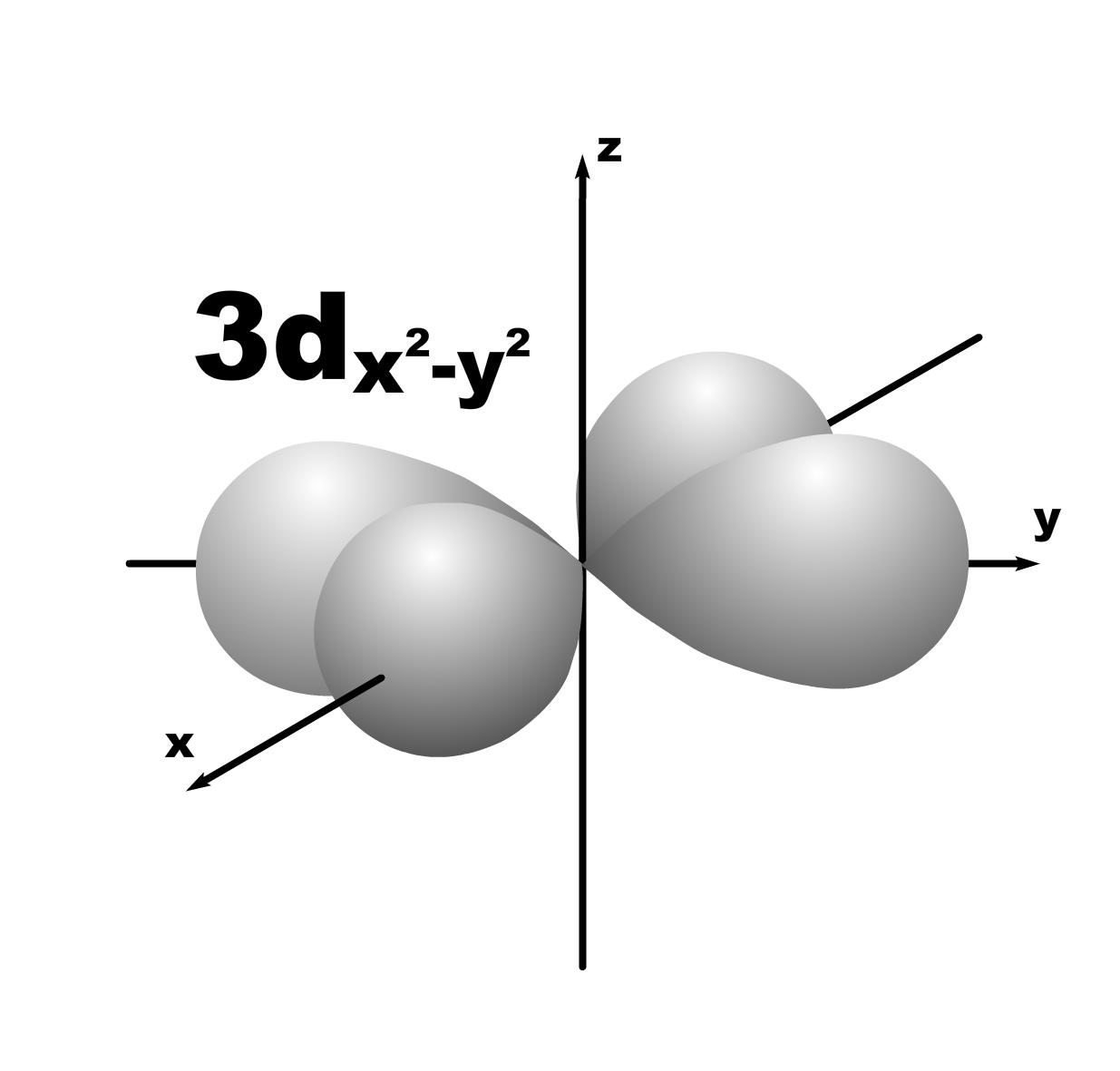
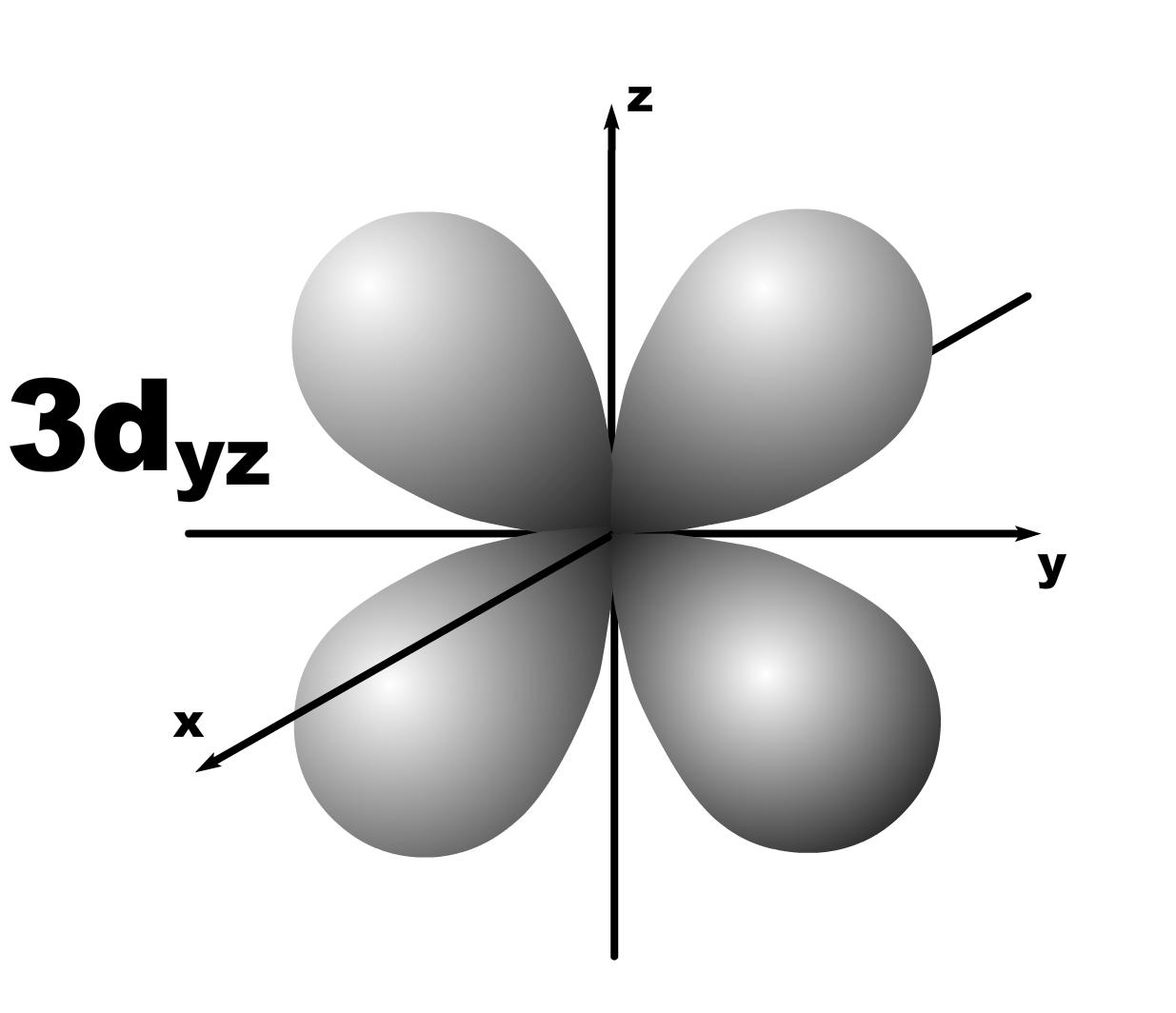
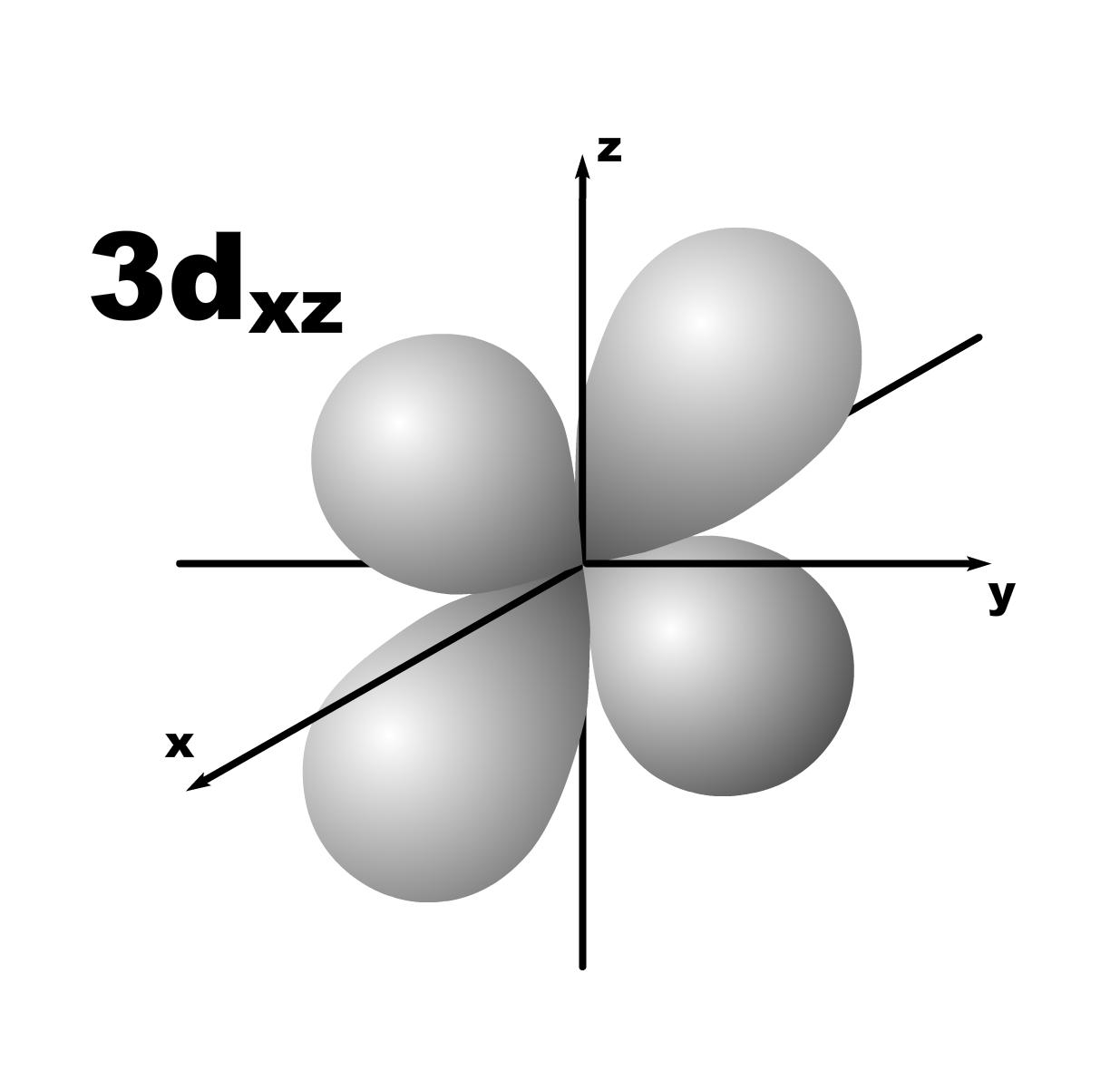
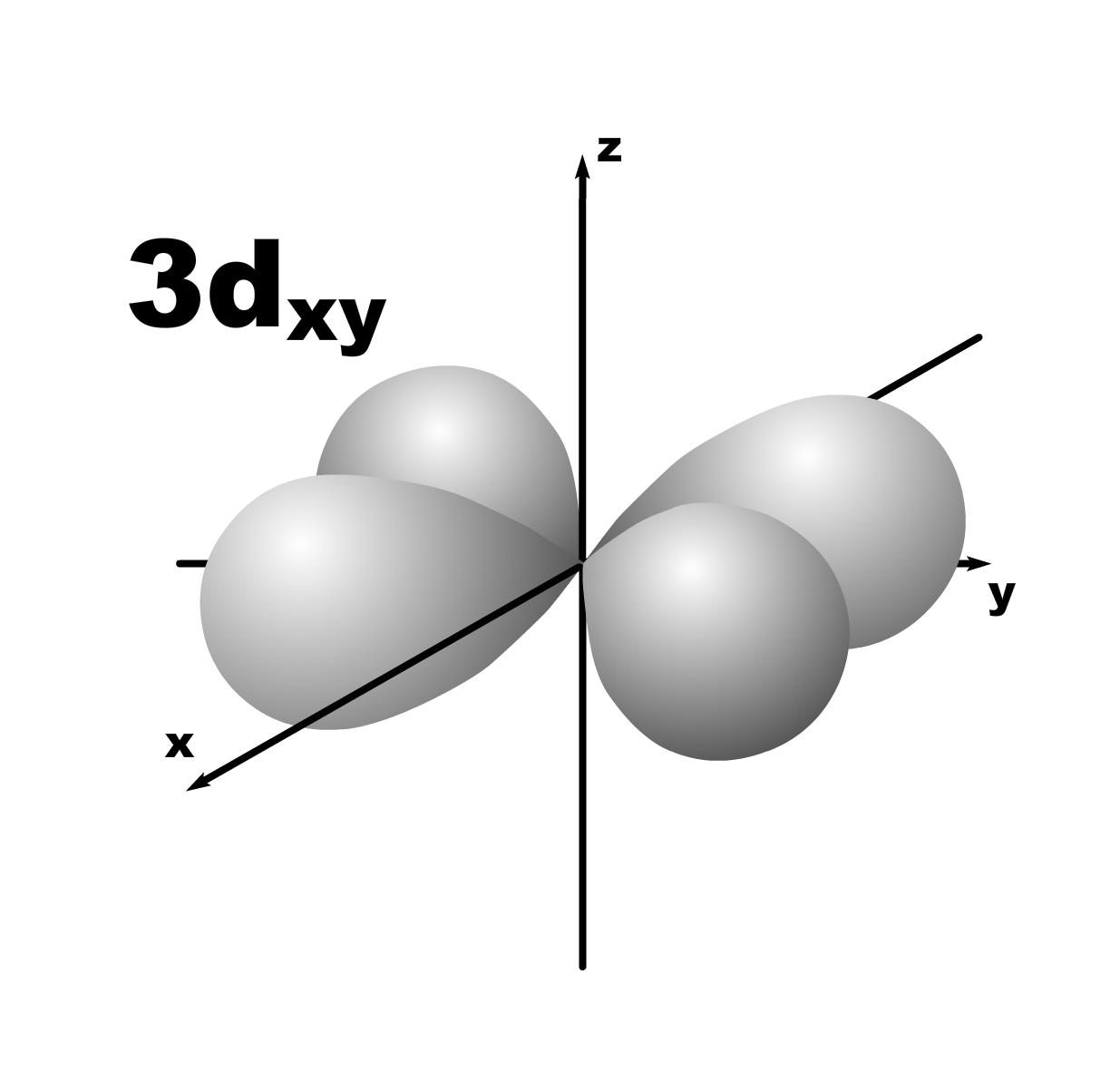
Строение атома. До конца 19 века полагали, что атом неделимая и неизменяющаяся частица. Это находило подтверждение при проведении химических реакций, в которых вещества реагируют друг с другом в определенных массовых отношениях. Но наука развивалась, накапливались новые данные, которые вынуждали по-другому смотреть на природу и строение атомов. Господствующая сегодня точка зрения об электронном строении атома основывается на ряде экспериментальных и теоретических предпосылок. Экспериментальные предпосылки теории Многими научными исследованиями было показано, что атом имеет сложное строение. а) открытие электронов. Из электрохимических исследований стало очевидно, что атомы могут нести положительный или отрицательный заряд, поскольку они выделяются на катоде или аноде электролизера. В 1870 году Стони пытался определить величину единичного заряда, связанного с одним одновалентным атомом и названного им электроном. Заряд электрона был определен позже Милликеном (1906-1916 г.г.) qe=1,602.10 19 кл; а масса покоя m=9,109.10-31 кг. На основании этих исследований Томсоном была предложена следующая модель строения атома.  б) открытие ядра и его свойства. В опытах по рассеянию -частиц (Не2+) Э.Резерфордом было показано, что почти вся масса атома сосредоточена в очень малом объеме – положительно заряженном ядре.  Согласно модели Резерфорда, вокруг ядра на относительно большом расстоянии непрерывно движутся электроны, причем их число таково, что в целом атом электрически нейтрален. Объем ядра примерно в 105 раз меньше атома, а масса одного протона примерно в 2000 раз больше массы электрона. в) открытие радиоактивности. Было показано, что атомы не являются неделимыми, в результате радиоактивного распада одни атомы могут превращаться в другие с выделением энергии. г) Главной предпосылкой электронного строения атомов служат данные, полученные при изучении атомных спектров испускания или поглощения излучения, регистрируемые спектральными методами. Планетарная модель Резерфорда противоречила факту устойчивости существования атомов. В результате ускоренного движения электрона расходуется энергия его электростатического взаимодействия с ядром и согласно расчетам через 10-8 с электрон должен упасть на ядро. Согласно модели Резерфорда энергия атома должна уменьшаться непрерывно за счет излучения, образующего сплошной спектр. Однако экспериментально установлено, что все атомные спектры имеют дискретный (линейчатый) характер. Спектр является одной из важнейших характеристик атома и отражает его внутреннее строение. Теоретические предпосылки. а). Для объяснения особенностей (дискретности) спектров нагретых тел немецким ученым Планком 1900 г. была предложена теория, основанная на предположении, что энергия не излучается атомами непрерывно, а испускается отдельными мельчайшими неделимыми порциями – квантами, величина которых зависит от частоты излучаемого света: Е = h, где Е – энергия кванта, Дж; частота, с-1; h = 6,626.10-34 Дж.с – постоянная Планка (мера дискретности), одна из фундаментальных постоянных, она входит во все квантово-механические соотношения. Согласно уравнению Планка энергия тела может меняться на величину, кратные h. Излучая квант света, атом переходит из одного энергетического состояния в другое. б) Построенная на этих представлениях модель атома водорода по Бору позволила рассчитать его спектр, результаты хорошо совпали с экспериментальными данными. Однако, она оказалась непригодна для объяснения строения сложных атомов, начиная с гелия. Даже для атома водорода она не смогла объяснить тонкую структуру линейчатого спектра. В 1924 году Луи де Бройль (Франция) высказал идею о том, что материя обладает как волновыми, так и корпускулярными свойствами. Согласно уравнению де Бройля 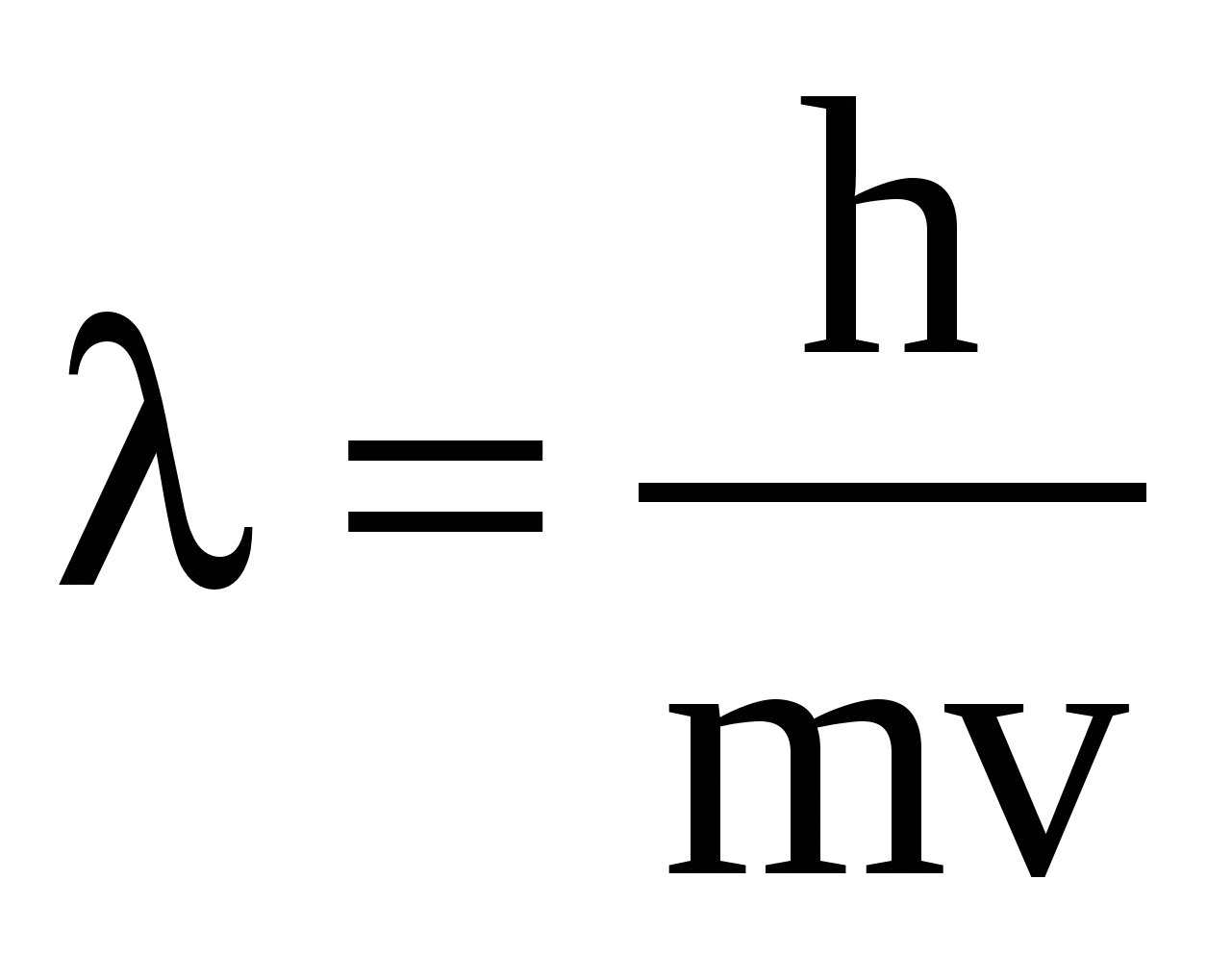 , ,т.е. частице массой m, движущейся со скоростью v, соответствует длина волны . Как правило, встретив две точки зрения, которые диаметрально противоположны, мы полагаем, что если одна из них истинна, то другая – непременно ложна. Нам трудно бывает принять, что возможны и иные уровни понимания: не "или или", а "и и", когда из двух взаимоисключающих концепций истинными могут оказаться обе, и в равной мере. Современному знанию известны объекты, которые могут быть описаны только как перечнем признаков, исключающих друг друга. Так свет представляет собой одновременно и волну и частицу. То же самое электрон. Он частица и в то же время волна, хотя одно исключает другое. Еще пример: в каждый данный момент электрон находится в определенной точке своей орбиты и в противоположность этому в тот же каждый момент он пребывает во всех точках пути своего движения. Явление, которое может быть описано только признаками, исключающими друг друга, называется антиномией. Принцип антиномии известен не только в науке. Так по буддийской традиции об одном и том же предмете могут быть высказаны два противоположных суждения, при этом они не должны пониматься как противоречие. Главное в науке гипотеза, если она правильная. Так и с гипотезой де Бройля уже в 1927 году были обнаружены у электронов как волновые, так и корпускулярные свойства. Было открыто явление дифракции электронов, т.е. при прохождении пучка электронов через дифракционную решетку на фотопленке наблюдается такая же дифракционная картина, как при прохождении излучения с длиной волны , рассчитанной по уравнению де Бройля. Возникла необходимость изменить представление об электроне как о микроскопической заряженной частице, подчиняющейся тем же законам, каким подчиняются макроскопические тела. Возникла необходимость разработки новой теории, применимой к микрочастицам. в) В 1925-1926 годах Гейзенберг (Германия) и Шредингер (Австрия) разработали теорию квантовой механики, описывающую движение микрочастиц. На основании этих предпосылок была построена теория строения атома. Согласно принципу неопределенности невозможно утверждать, что электрон, имеющий определенную скорость, находится в данной точке пространства, здесь можно использовать лишь вероятностное описание. Современные положения теории строения атома. Для описания свойств электрона используют волновую функцию (пси). Законы движения микрочастиц в квантовой механике выражаются волновым уравнением Шредингера, которое связывает волновую функцию и энергию атома. Для изучения химии очень важны результаты решения уравнений Шредингера. Основные результаты решения уравнений Шредингера 1. Наличие трех квантовых чисел. n – главное, квантует радиус орбитали, т.е. определяет ее размер. l – орбитальное, квантует форму орбитали. ml – магнитное, квантует направление волновой функции в пространстве (угол ). s – спиновое квантовое число характеризует внутреннее движение электрона в атоме. Квантует собственный внутренний момент количества движения. Оно не вытекает из уравнения Шредингера. 2. Значения, которые принимают квантовые числа. n = 1,2........ l = 0,1,.....n-1} всего n. Орбитальное квантовое число обычно обозначают буквами: 0(s), 1(p), 2(d), 3(f) и т.д. Это сложилось исторически от названий спектральных линий: s – острый (sharp); p – основной (prinzip); d – диффузионный; f – фундаментальный. ml = 0,±1,±2,....±l } всего 2l+1. 3. Обозначение состояния электрона в атоме. 2р2 – в атоме есть два электрона на орбитале с n = 2 и l = 1, т.к. р-подуровень. 4. Форма и знаки орбиталей. Атомная орбиталь – отвечающее законам квантовой механики распределение вероятности пребывания электрона в пространтстве, определяемое -функцией. n – определяет размеры АО; m – расположение АО в пространстве; l – конфигурацию, которая от значения n не зависит. l=0; сфера, m=0; одна орбиталь 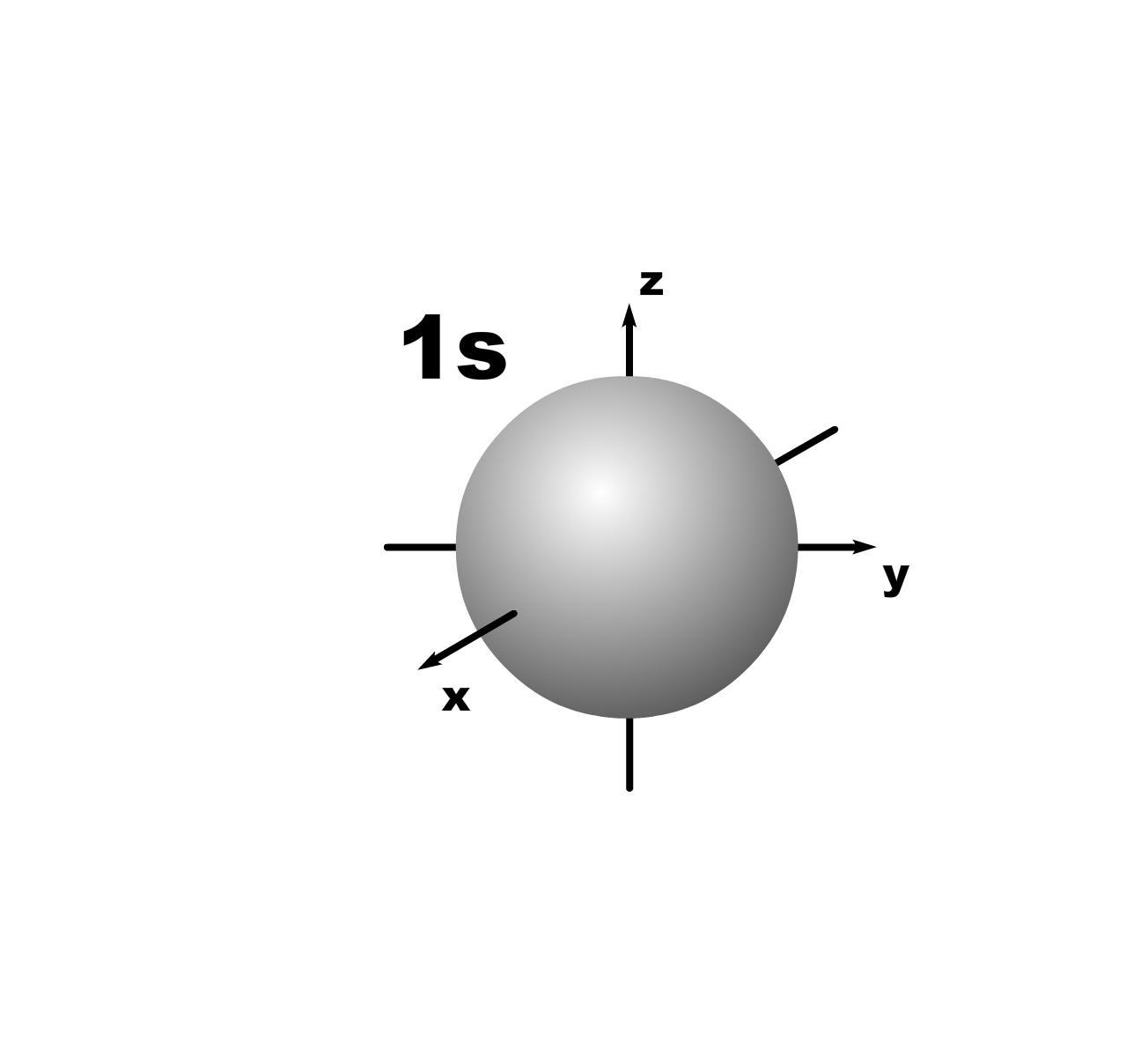 l=1; гантель, m=+1,0,-1; три орбитали по осям Х, У, Z. 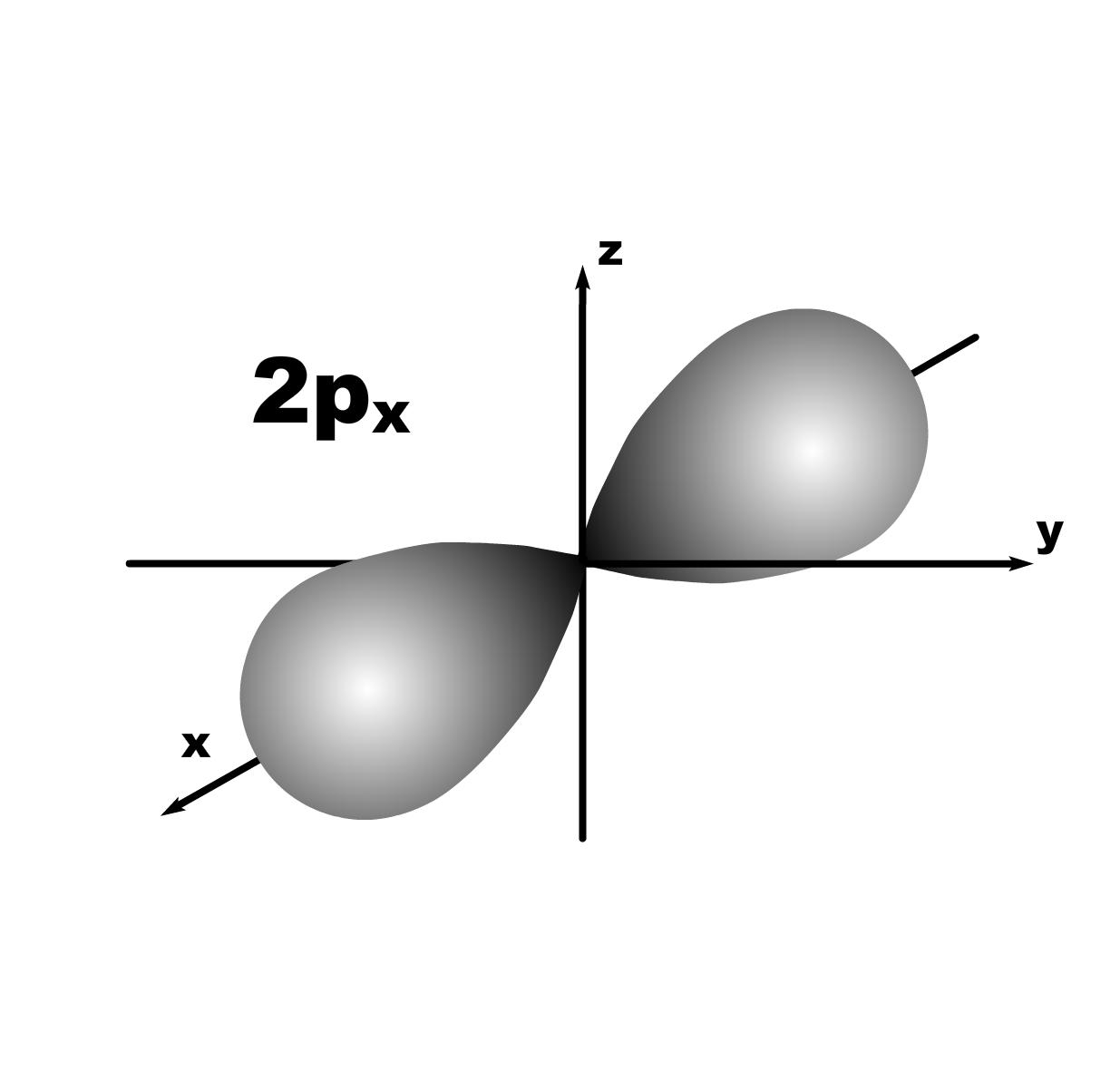 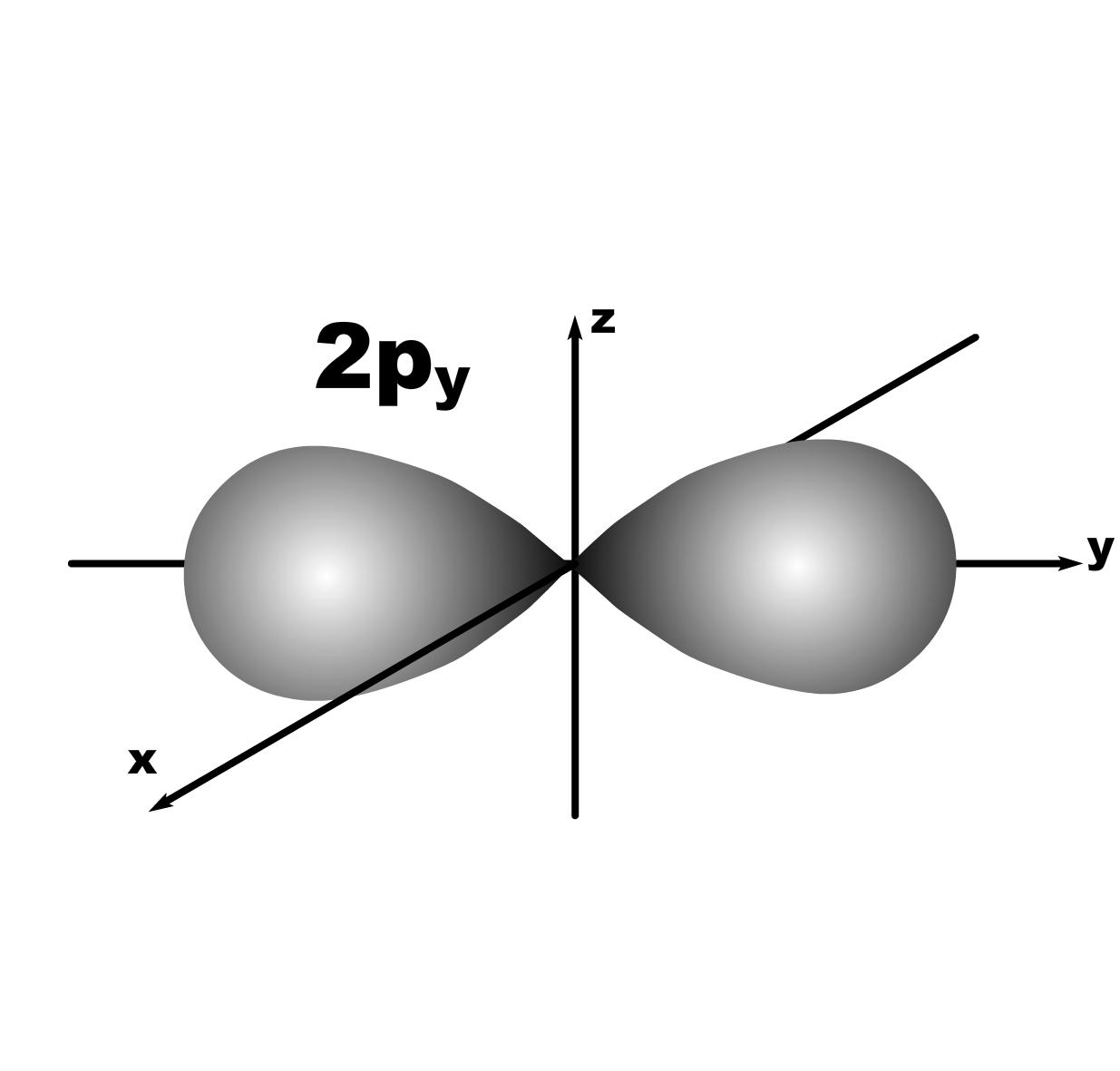 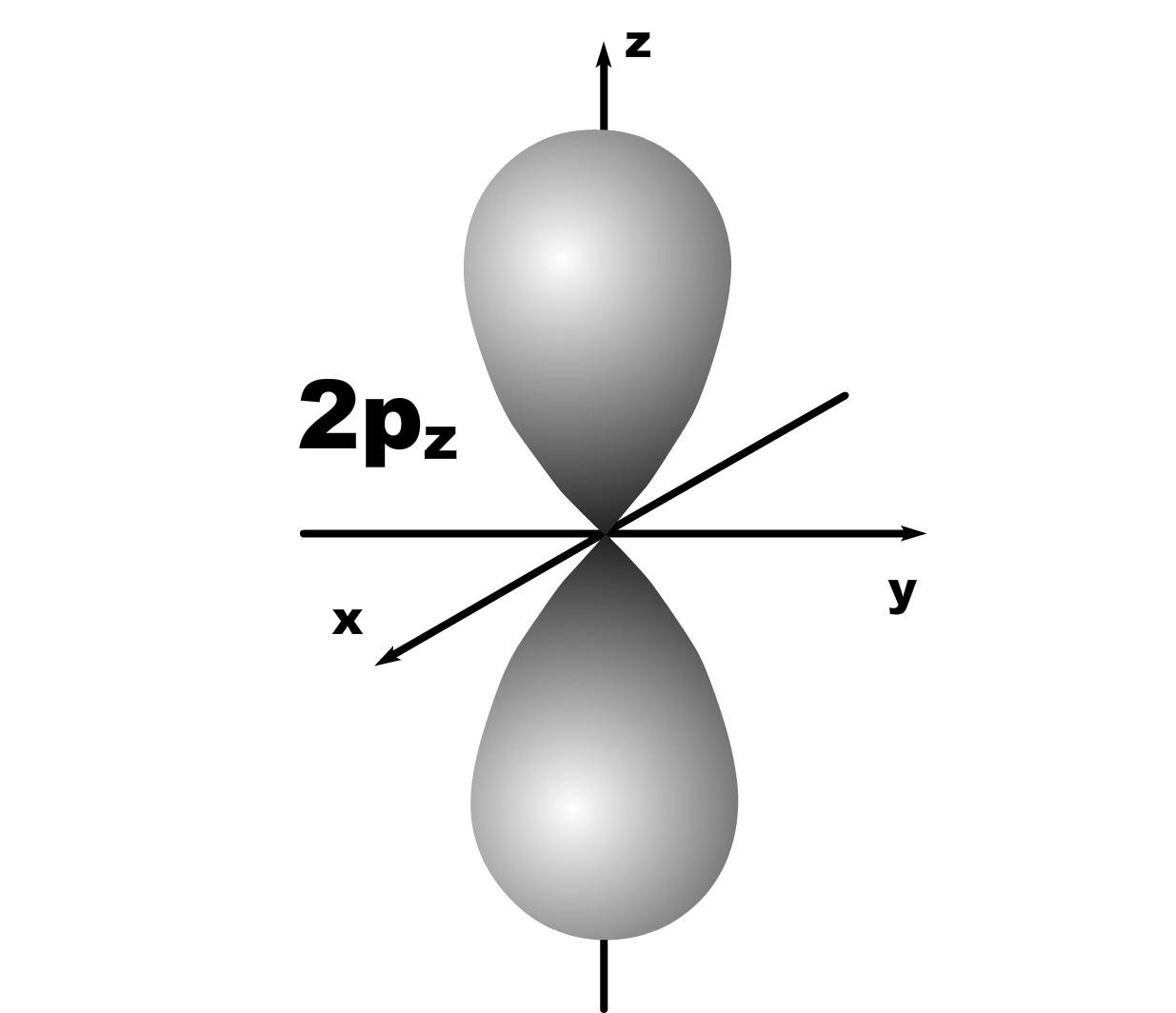 l=2; m=+2,+1,0,-1,-2; пять орбиталей.
5. Энергия электрона в многоэлектронном атоме. Решая уравнение Шредингера, получаем, что: а) чем больше n+l, тем > энергия электрона в атоме – первое правило Клечковского; б) если сумма n+l одинакова, то предпочтение отдается главному квантовому числу n. Чем больше n, тем больше энергия электрона в атоме – второе правило Клечковского. Последовательность расположения атомных орбиталей по мере увеличения энергии электрона в многоэлектронном атоме. 1s2s2p3s3p4s3d4p5s4d5p6s4f5d6p7s5f6d7p Рисунок, иллюстрирующий правило Клечковского. Легко запомнить порядок расположения подуровней, если использовать «правило стрелки»  6. Атомной орбиталью (АО) называется совокупность положений электрона в атоме, характеризуемых определенными значениями квантовых чисел n, l, m. Есть и другие определения атомной орбитали. Например, атомной орбиталью называется область пространства, где электрон находится с вероятностью 95%. А   томная орбиталь обычно обозначается . На s-подуровне одна атомная орбиталь; на р-подуровне – три ; на d-подуровне – 5. томная орбиталь обычно обозначается . На s-подуровне одна атомная орбиталь; на р-подуровне – три ; на d-подуровне – 5. У каждого атома имеется бесконечный набор атомных орбиталей, которые заполняются электронами по правилам. а). Принцип наименьшей энергии. Он отражает стремление любого атома находиться в основном (невозбужденном) состоянии. На практике заполнение по этому принципу определяется 1 и 2 правилами Клечковского. б). Принцип Паули (в рамках "а"). На каждой орбитали может быть максимум 2 электрона с противоположными спинами. в). Правило Гунда. При заполнении p, d, f – подуровней, если на них больше одного электрона, то они заполняются так, чтобы суммарный спин был максимальный. г). Наиболее устойчивые электронные конфигурации – пустые s0, p0, d0, f0; полностью заполненные s2, p6, d10, f14 и наполовину заполненные p3, d5, f7. Cr24 1s22s22p63s23p64s23d4 Cr24 1s22s22p63s23p64s13d5 Для атома хрома электроно-графическая формула выглядит так: 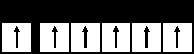 Это явление называется проскок (провал) электрона. Если Вам попадется такой вопрос, то пользуйтесь периодической системой Менделеева, т.к. проскок электрона определяется экспериментально. Например, у хрома (4s13d5) и молибдена (5s14d5) есть проскок электрона, а у их аналога вольфрама нет (6s25d4). Валентные электроны – электроны, обладающие наибольшей энергией, электроны последних уровней. Они имеют большое значение при образовании химической связи.
1.2. Периодический закон и Периодическая система химических элементов Д.И. Менделеева Одним из важнейших законов природы является периодический закон, открытый в 1869 г. Менделеевым, который он сформулировал так: "Свойства простых веществ, также формы и свойства соединений находятся в периодической зависимости от атомных весов элементов". С развитием квантовой химии периодический закон получил строгое теоретическое обоснование, а с ним и новую формулировку: "Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от величины зарядов ядер их атомов". До Менделеева многие пытались систематизировать элементы, наиболее близко подошел Майер (Германия). В 1864 г. в своей книге он привел таблицу, в которой элементы были также расположены в порядке возрастания их атомных масс, но в эту таблицу Майер поместил всего 27 элементов, меньше половины, известных в то время. Заслуга Менделеева, что в его таблице нашлось место не только всем известным элементам, но были оставлены пустые места для еще не открытых элементов (экабор – Sc, экаалюминий – Ga, экасилиций – Ge).   С точки зрения электронного строения атома: Периодом называют горизонтальную последовательность элементов, начинающуюся со щелочного металла и заканчивающуюся благородным газом с тем же максимальным значением главного квантового числа, равного номеру периода. Число элементов в периоде определяется емкостью подуровней.
Группой элементов называют вертикальную совокупность элементов, обладающую однотипной электронной конфигурацией и определенным химическим сходством. Номер группы (за исключением I, II, VIII побочных подгрупп) равен сумме валентных электронов. Кроме деления по периодам (определяемое главным квантовым числом) существует деление на семейства, определяемое орбитальным квантовым числом. Если у элемента заполняется s-подуровень, то s-семейство или s-элемент; p-подуровень – p элемент; d-подуровень – d-элемент; f-подуровень – f-элемент. В короткопериодной форме периодической системы 8 групп, каждая из которых делится на главную и побочную подгруппы. I и II главные подгруппы заполняются s-элементами; III VIII главные подгруппы – р-элементами. d-элементы находятся в побочных подгруппах. f-элементы вынесены в отдельные группы. Таким образом, каждый элемент в периодической системе элементов занимает строго определенное место, которое отмечается порядковым номером и связано со строением электронных оболочек атома. 1.2.1. Закономерности изменения свойств элементов и их соединений по периодам и группам Экспериментальными исследованиями была установлена зависимость химических и физических свойств элементов от их положения в периодической системе. Энергией ионизации называется энергия, которую надо затратить для отрыва и удаления электрона от атома, иона или молекулы. Она выражается в Дж или эВ (1эВ=1,6.10-19 Дж). Энергия ионизации является мерой восстановительной способности атома. Чем ниже значение энергии ионизации, тем выше восстановительная способность атома. Атомы, теряя электрон, превращаются в положительно заряженные ионы. Сродство к электрону называется энергия, которая выделяется при присоединении электрона к атому, молекуле или радикалу. Энергия сродства к электрону атомов закономерно изменяется в соответствии с характером электронных структур атомов элементов. В периодах слева направо сродство к электрону и окислительные свойства элементов возрастают. В группах сверху вниз сродство к электрону, как правило, уменьшается. Галогены отличаются самым высоким сродством к электрону, т.к. присоединяя один электрон к нейтральному атому, она приобретает законченную электронную конфигурацию благородного газа. Характеристика о том, какой из атомов легче отдает или присоединяет электрон, называется электроотрицательностью которая равна полусумме энергии ионизации и сродства к электрону. Электроотрицательность возрастает в направлении слева направо для элементов каждого периода и уменьшается в направлении сверху вниз для элементов одной и той же группы ПС. Атомные и ионные радиусы Атомы и ионы не имеют строго определенных границ вследствие волновой природы электронов. Поэтому определяют условные радиусы атомов и ионов, связанных друг с другом химической связью в кристаллах. Радиусы атомов металлов в периодах с ростом порядкового номера элементов уменьшаются, т.к. при одинаковом числе электронных слоев возрастает заряд ядра, а, следовательно, и притяжение им электронов. В пределах каждой группы элементов, как правило, радиусы атомов увеличиваются сверху вниз, т.к. возрастает число энергетических уровней. Радиусы ионов также находятся в периодической зависимости от порядкового номера элемента. 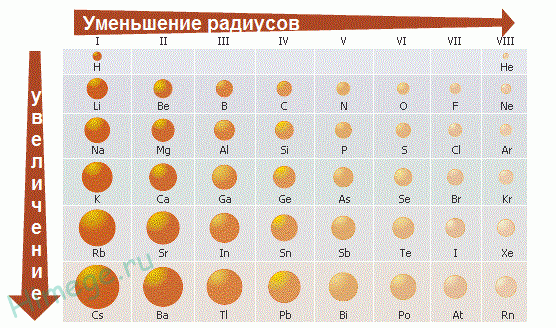 Пример. Как изменяются размеры атомов внутри периода, при переходе от одного периода к другому и в пределах одной группы? Какие элементы имеют минимальное и максимальное значения размера атома? Решение. Внутри периода (слева направо) размеры атомов уменьшаются, т.к. увеличивается заряд ядра и электроны сильнее притягиваются к ядру. В главных подгруппах размеры атомов увеличиваются, т.к. увеличивается число электронных слоев. В побочных подгруппах такие изменения меньше заметны, за счет d -сжатия, а при переходе из V в VI период происходит даже уменьшение уменьшение размеров атомов за счет f -сжатия. Согласно этим правилам минимальное значение размера атома имеет гелий, а максимальное – цезий. Франций не имеет долгоживущих изотопов (природный изотоп радиоактивен, период полураспада 21 минута). Металлы и неметаллы. Деление элементов и простых веществ на металлы и неметаллы в известной степени условно. По физическим свойствам металлы характеризуются высокой теплопроводностью и электрической проводимостью, отрицательным температурным коэффициентом проводимости, специфическим металлическим блеском, ковкостью, пластичностью и т.п. По химическим свойствам металлы характеризуются основными свойствами оксидов и гидроксидов и восстановительными свойствами. Подобные различия в свойствах простых веществ связаны с характером химической связи при их образовании. Металлическая связь в металлах образуется при дефиците валентных электронов, а ковалентная в неметаллах при их достаточном количестве. Исходя из этого, можно провести вертикальную границу между элементами IIIA и IV групп. Слева – элементы с дефицитом валентных электронов, справа – с избытком. Это граница Цинтля. Пример. Чем отличаются типичные металлы от неметаллов? Почему и как изменяются металлические свойства с увеличением порядкового номера элементов? Решение. В периодической системе элементов в основном находятся металлы, неметаллов немного (всего 22). К металлам относятся все s -элементы. Это связано с наличием у них малого числа валентных электронов (1 или 2), в результате этого дефицита электронов образуется металлическая связь. Все d - и f -элементы тоже являются металлами. При образовании химических связей в качестве валентных электронов у атомов d -элементов выступают s -электроны внешнего энергетического уровня и часть или все d -электроны предпоследнего уровня, причем d -электроны участвуют в образовании химических связей лишь после того, как будут связаны все внешние s -электроны. Кроме того, легкости удаления s -электронов способствует эффект экранирования заряда ядра. Он состоит в уменьшении воздействия на электрон положительного заряда ядра из-за наличия между рассматриваемым электроном и ядром других электронов (это d - или f -электроны). У р-элементов происходит конкуренция между увеличением числа валентных электронов (неметаллические свойства) и экранированием заряда ядра (усиливаются металлические свойства). В связи с этим у р-элементов по подгруппе сверху вниз увеличивается устойчивость низших степеней окисления. По периоду справа налево увеличиваются неметаллические свойства атомов, за счет увеличения заряда ядра атома и трудности отдачи электронов. По подгруппе сверху вниз увеличиваются металлические свойства, т. к. ослабевает связь внешних электронов с ядром. Свойства соединений подразделяются на кислотно-основные и окислительно-восстановительные. Периодическая система элементов хорошо объясняет эти закономерности. Рассмотрим это на примере гидроксидов. Если элемент имеет степень окисления маленькую (+1 или +2), например, Na—O—H, то связь Na—O менее прочная, чем O—H и разрыв связи происходит по менее прочной связи. Na—O—H Na+ + OH-. Соединение обладает основными свойствами. Если степень окисления элемента большая (от +5 до +7), то связь элемент – кислород прочнее, чем связь О—Н и соединение обладает кислотными свойствами. В азотной кислоте степень окисления азота большая (+5). 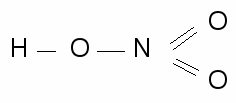 H+ + NO3-
Соединения в степени окисления +3 и +4 проявляют амфотерные свойства, т.е. в зависимости от партнера по реакции могут проявлять как кислотные, так и основные свойства. Но есть исключения Zn+2, Be+2, Sn+2, Pb+2, Ge+2 имеют степень окисления +2, но являются амфотерными соединениями. По периоду справа налево увеличивается высшая степень окисления, равная номеру группы, поэтому увеличиваются неметаллические и кислотные свойства. По подгруппе сверху вниз увеличиваются металлические и основные свойства, т.к. увеличивается размер атома и связь с соседним атомом ослабляется. Таким образом, периодическая система позволяет проанализировать положение простых веществ в связи с особенностями их свойств (металлы, неметаллы). 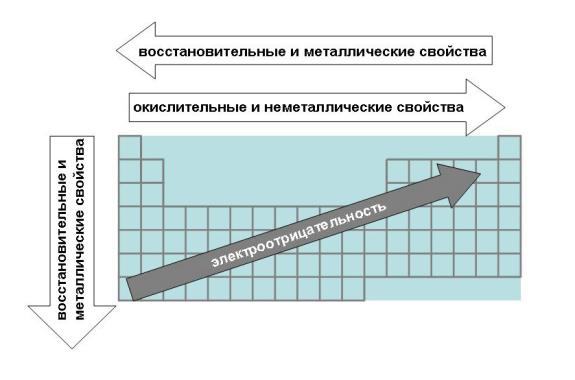 Периодический закон Менделеева дает возможность определять и свойства простых веществ в химических соединениях. Впервые предсказание свойств было осуществлено самим Менделеевым. Он рассчитал свойства и тех элементов, которые еще не были открыты. 1.2.2. Общая характеристика металлов IА – IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов Отличительной особенностью металлов, находящихся в I-III группах главных подгруппах является дефицит валентных электронов. В IА группе находятся щелочные металлы, они имеют один s-электрон на внешнем электронном слое, который при химических реакциях легко теряют, проявляя степень окисления +1. Поэтому щелочные металлы являются сильными восстановителями.  Щелочны́е мета́ллы: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr. Эти металлы получили название щелочных, потому что большинство их соединений растворимо в воде. По-славянски «выщелачивать» означает «растворять», это и определило название данной группы металлов. При растворении щелочных металлов в воде образуются растворимые гидроксиды, называемые щёлочами. Согласно положению этих элементов в Периодической системе изменение их свойств представлено на рисунке. 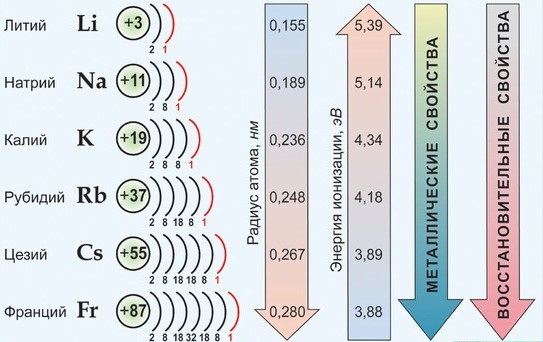 По группе сверху вниз увеличиваются радиусы атомов за счет увеличения число электронных слоев. Уменьшается энергия ионизации (легкость отрыва электрона от атома), что соответствует увеличению восстановительных, а значит и металлических свойств. Химические свойства щелочных металлов кратко можно представить в таблице. 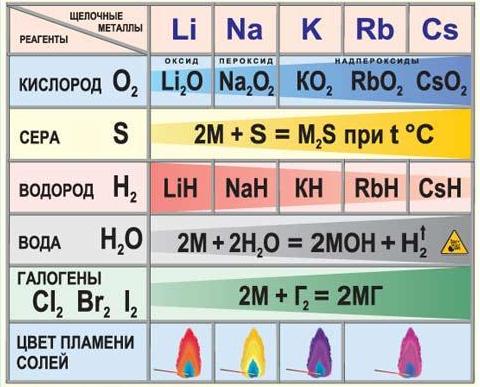 Щелочные металлы активно реагируют с кислородом с образованием оксидов, пероксидов и надпероксидов. С серой при нагревании образуют сульфиды, с водородом – гидриды, с галогенами – галогениды. Очень активно взаимодействуют с водой, часто с воспламенением выделяющегося водорода. 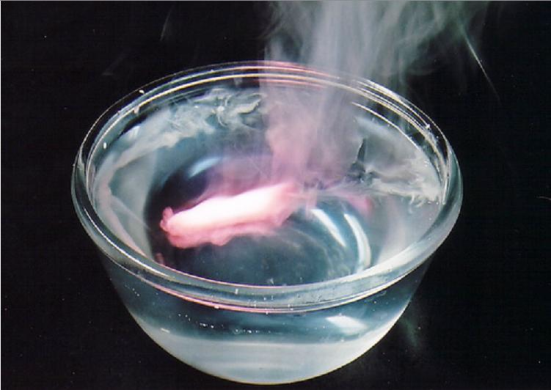 Атомы элементов IIА группе имеют на внешнем электронном уровне два s электрона: ns2. В реакциях атомы элементов подгруппы легко отдают оба электрона внешнего энергетического уровня и образуют соединения, в которых степень окисления элемента равна +2. 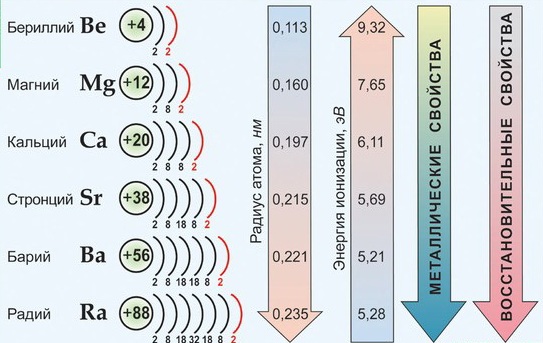 Металлы этой подгруппы менее активны, чем металлы IА группы. Бериллий является амфотерным металлом, магний образует основание – слабый электролит, а кальций, стронций и барий образуют щелочи. Это активные металлы являются сильными восстановителями. Из металлов этой подгруппы несколько менее активен бериллий, что обусловлено образованием на поверхности этого металла защитной оксидной пленки. Амфотерность бериллия проявляется в том, что он взаимодействует с водными растворами щелочей с образованием комплексной соли и выделением водорода: Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2. Остальные металлы II группы со щелочами не реагируют. В IIIА группе находятся бор (В), алюминий (Al), галлий (Ga), индий (In), таллий (Tl). В этой подгруппе особенной ярко проявляется изменение кислотно-основных свойств по подгруппе сверху вниз от кислотных до основных. Если соединения бора обладают кислотными свойствами, алюминий, галлий и индий – амфотерными, то соединения таллия – основными. На внешнем энергетическом уровне алюминия имеются свободные р орбитали, что позволяет ему переходить в возбужденное состояние. В возбужденном состоянии атом алюминия образует три ковалентные связи или полностью отдает три валентных электрона, проявляя степень окисления +3.  Общим для элементов этих групп является то, что они характеризуются небольшим (1-3) числом электронов на внешнем уровне их атомов и легкостью потери электронов, что отражает низкие значения электроотрицательности. Алюминий, галлий, бериллий проявляют уже амфотерные (то есть металлические и неметаллические – металлоидные) свойства. 1.2.3. Характеристика переходных металлов (меди, цинка, хрома, железа) по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов Понятие переходный элемент обычно используется для обозначения любого из d- или f-элементов. Эти элементы занимают переходное положение между электроположительными s-элементами и электроотрицательными p-элементами. d-элементы образуют три переходных ряда — в 4-м, 5-м и 6-м периодах соответственно. Первый переходный ряд включает 10 элементов, от скандия до цинка. Он характеризуется внутренней застройкой 3d-орбиталей. Хром и медь имеют на 4s-орбиталях всего по одному электрону. Дело в том, что полузаполненные или заполненные d-подоболочки обладают большей устойчивостью, чем частично заполненные. В атоме хрома на каждой из пяти 3d-орбиталей, образующих 3d-подоболочку, имеется по одному электрону. Такая подоболочка является полузаполненной. Cr24 1s22s22p63s23p64s13d5 Для атома хрома электроно-графическая формула выглядит так:  Это явление называется проскок (провал) электрона. В атоме меди на каждой из пяти 3d-орбиталей находится по паре электронов (аналогичным образом объясняется аномалия серебра). Cu29 1s22s22p63s23p64s13d10   Все d-элементы являются металлами. Большинство из них имеет характерный металлический блеск. По сравнению с s-металлами их прочность в целом значительно выше. В частности, для них характерны свойства: высокий предел прочности на разрыв; тягучесть; ковкость (их можно расплющить ударами в листы). d-элементы и их соединения обладают рядом характерных свойств: переменные состояния окисления; способность к образованию комплексных ионов; образование окрашенных соединений. d-элементы характеризуются также более высокой плотностью по сравнению с другими металлами. Это объясняется сравнительно малыми радиусами их атомов. Атомные радиусы этих металлов мало изменяются в этом ряду. d-элементы — хорошие проводники электрического тока, особенно те из них, в атомах которых имеется только один внешний s-электрон сверх полузаполненной или заполненной d-оболочки. Например, медь. Химические свойства. Электроотрицательность и энергии ионизации металлов первого переходного ряда возрастают в направлении от хрома к цинку. Это означает, что металлические свойства элементов первого переходного ряда постепенно ослабевают в указанном направлении. Такое изменение их свойств проявляется и в последовательном возрастании окислительно-восстановительных потенциалов с переходом от отрицательных к положительным значениям. Хром — твердый голубовато-белый металл. При высоких температурах горит в кислороде с образованием Сr2О3, реагирует с парами воды 2Сr + 3Н2O Сr2О3 + 3Н2 и с галогенами, образуя галогениды состава СrГ3. Хром (так же, как алюминий) пассивируется холодными концентрированными Н2SО4 и НNО3. Однако при сильном нагревании эти кислоты растворяют хром: 2Сr + 6Н2SО4(конц) = Сr2(SО4)3 + 3SО2↑ + 6Н2О, Сr + 6НNО3(конц) = Сr(NО3)3 + 3NO2↑ + 3Н2О. При обычной температуре хром растворяется в разбавленных кислотах (НСl, Н2SО4) с выделением водорода, образуя соли Сr2+. Обрабатывая их растворы щелочами, получают желтый осадок гидроксида хрома (II): СrСl2 + 2 NaОН = Сr(ОН)2↓ + 2 NaСl. Соли Cr3+ сходны с аналогичными солями алюминия. При действии щелочей на соли Сr3+ выпадает студнеобразный осадок гидроксида хрома (III) зеленого цвета: Сr2(SО4)3 + 6 NaОН = 2 Сr(ОН)3↓ + 3 Na2SО4, обладающий амфотерными свойствами. Он растворяется как в кислотах с образованием солей хрома (III) 2 Сr(ОН)3 + 3 Н2SО4 = Сr2(SО4)3 + 6 Н2О, так и в щелочах с образованием комплексной соли Сr(ОН)3 + 3КОН = К3[Cr(ОН)6]. Наиболее важными соединениями хрома в высшей степени окисления +6 хромат калия К2СrО4 и дихромат калия К2Сr2О7. В кислой среде ион CrO42- превращается в ион Сr2О72- . В щелочной среде эта реакция протекает в обратном направлении: Железо На воздухе в присутствии влаги ржавеет: 4Fе + 3O2 + 6Н2О = 4Fе(ОН)3. С галогенами оно образует галогениды железа (III) 2Fе + 3Вr2 = 2FеВr3, а взаимодействуя с соляной и разбавленной серной кислотами соли железа(II), так как катион водорода Н+ является слабым окислителем: Fе + Н2SО4 = FеSО4 + Н2↑. Концентрированные (НNО3, Н2SО4) пассивируют железо на холоде, однако растворяют его при нагревании: 2Fе + 6Н2SО4(конц) = Fе2(SО4)3 + 3SО2↑ + 6Н2О, Fе + 6НNО3(конц) = Fе(NО3)3 + 3NО2↑ + 3Н2О. Медь – довольно мягкий металл красно-желтого цвета, обладающий наименьшей активностью среди рассмотренных выше переходных металлов, которые вытесняют ее из растворов солей. Медь не реагирует с соляной и разбавленной серной кислотами и растворяется только в кислотах – окислителях: Сu + 2 Н2SО4(конц) = СuSО4 + SО2↑ + 2 Н2О, Сu + 4 НNO3(конц) = Сu(NО3)2 + 2 NО2↑ + 2 Н2О, 3 Cu + 8 НNО3(разб) = 3 Сu(NO3)2 + 2 NO↑ + 4 Н2О. Известны соединения меди со степенями окисления +1 и +2, из которых +2 более устойчива. Ионы Сu2+ в водном растворе существуют в виде комплексов гексааквамеди (II) [Сu(Н2О)6]2+, придающих раствору сине-голубую окраску. Основная соль меди – медный купорос CuSO4.5H2O голубого цвета, но при прокаливании теряет воду и становится белого цвета, т.е. окраску раствору придает комплексный ион. Более точное строение медного купороса [Cu(H2O)4]SO4 H2O. Цинк амфотерный металл. Валентные электроны атома цинка 4s23d10. Так как все d-орбитали у цинка заполнены электронами, все его соли бесцветны. Это объясняется теорией кристаллического поля лигандов. В соединениях проявляет только одну степень окисления +2. Взаимодействует с кислотами: Zn + 2HCl = ZnCl2 + H2 Zn + H2SO4(разб) = ZnSO4 + H2 Zn + 2H2SO4(конц) = ZnSO4 + SO2 + 2H2O 4Zn+10HNO3(разб)=4Zn(NO3)2+NH4NO3+3H2O. Zn + 4HNO3(конц) = Zn(NO3)2 + 2NO2 + 2H2O Взаимодействует со щелочами: реагирует с растворами щелочей с образованием гидроксокомплексов, при сплавлении образует цинкаты: Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2 Zn + 2KOH = K2ZnO2 + H2 1.2.4. Общая характеристика неметаллов IVА – VIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов Неметаллы – это химические элементы, для атомов которых характерна способность, принимать электроны до завершения внешнего слоя благодаря наличию, как правило, на внешнем электронном слое 4-х и более электронов и малому радиусу атомов по сравнению с атомами металлов (по периоду слева направо атомные радиусы уменьшаются). Все элементы-неметаллы (кроме водорода) занимают в периодической системе химических элементов Д. И. Менделеева верхний правый угол, образуя треугольник, вершиной которого является фтор F, а основанием диагонали B-At.
Неметаллов всего 22: к 15 представленных в таблице еще относятся водород (Н) и 6 инертных газов (He, Ne, Ar, Kr, Xe и Rn). Для неметаллов характерны высокие значения электроотрицательности, она изменяется в пределах от 2 до 4. неметаллы – это элементы главных подгрупп, преимущественно p-элементы, исключение составляет водород – s-элемент. У атомов неметаллов преобладают окислительные свойства, то есть способность присоединять электроны. В соответствии с численными значениями относительных электроотрицательностей окислительные способности неметаллов увеличиваются в следующем порядке: Все неметаллы, кроме фтора, проявляют восстановительные свойства (способность отдавать электроны). Причем эти свойства постепенно возрастают от кислорода к кремнию: |