ОНХимияПлакидкин. Теоретические основы химии
 Скачать 25.3 Mb. Скачать 25.3 Mb.
|
|
Пример. Определить степени окисления в соединениях Са(ClO2)2 и NH4NO3. Решение. В Са(ClO2)2 известны степени окисления кальция (II группа) +2 и кислорода –2. Обозначив степень окисления хлора за «х», составляем уравнение и находим неизвестную степень окисления. 2 + 2.(х + 2(–2)) = 0; 2 + 2х – 8 = 0; х = +3. Хлор в этом соединении имеет степень окисления +3. NH4NO3 – нитрат аммония является солью азотной кислоты HNO3, в которой азот имеет степень окисления +5 (1 + х + 3(–2) = 0); х=+5. В NH4NO3 х + 4.(+1) + 5 + 3.(–2) = 0; х = –3. В этом соединении азот имеет две степени окисления +5 в нитрат ионе и –3 в катионе аммония. Рассмотрим составление уравнения окислительно-восстановительной реакции по методу электронного баланса на примере реакции Fe2O3 + Br2 + KOH = K2FeO4 + KBr + H2O 1. Расставим степени окисления у элементов в данном уравнении, согласно правилам, изложенным выше. 2. Видим, что у железа степень окисления повышается (это полуреакция окисления), а у брома – понижается (полуреакция восстановления). Запишем эти две полуреакции с указанием электронов, отдаваемых восстановителем и принимаемых окислителем. Необходимо, чтобы число отданных и принятых электронов было равно, поэтому первую полуреакцию умножим на 2, а вторую на 3. Расставим коэффициенты в основном уравнении. Fe2O3 + 3Br2 + KOH = 2K2FeO4 + 6KBr + H2O Метод электронного баланса позволяет расставить коэффициенты только перед окислителем и восстановителем, остальные расставляются методом подбора. Сначала уравнивается калий, потом водород, а кислород в последнюю очередь. В правой части 10 калия, ставим 10 перед КОН. Стало 10 моль водорода в левой части, ставим 5 перед водой. Количество кислорода при правильной расстановке оказывается уравнено самостоятельно. Fe2O3 + 3Br2 + 10KOH = 2K2FeO4 + 6KBr + 5H2O Fe2O3 в этой реакции будет восстановителем, а Br2 – окислителем. Так как окислитель и восстановитель находятся в разных соединениях, то тип ОВР называется межмолекулярный Я    1 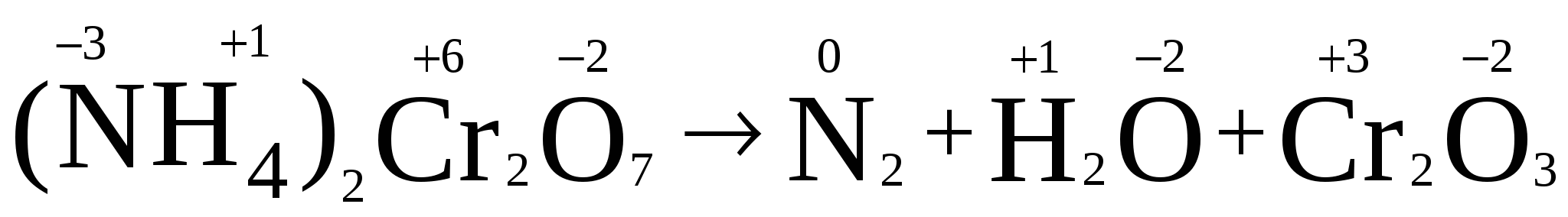 . Расставим степени окисления у элементов в данном уравнении, согласно правилам, изложенным выше. . Расставим степени окисления у элементов в данном уравнении, согласно правилам, изложенным выше.2 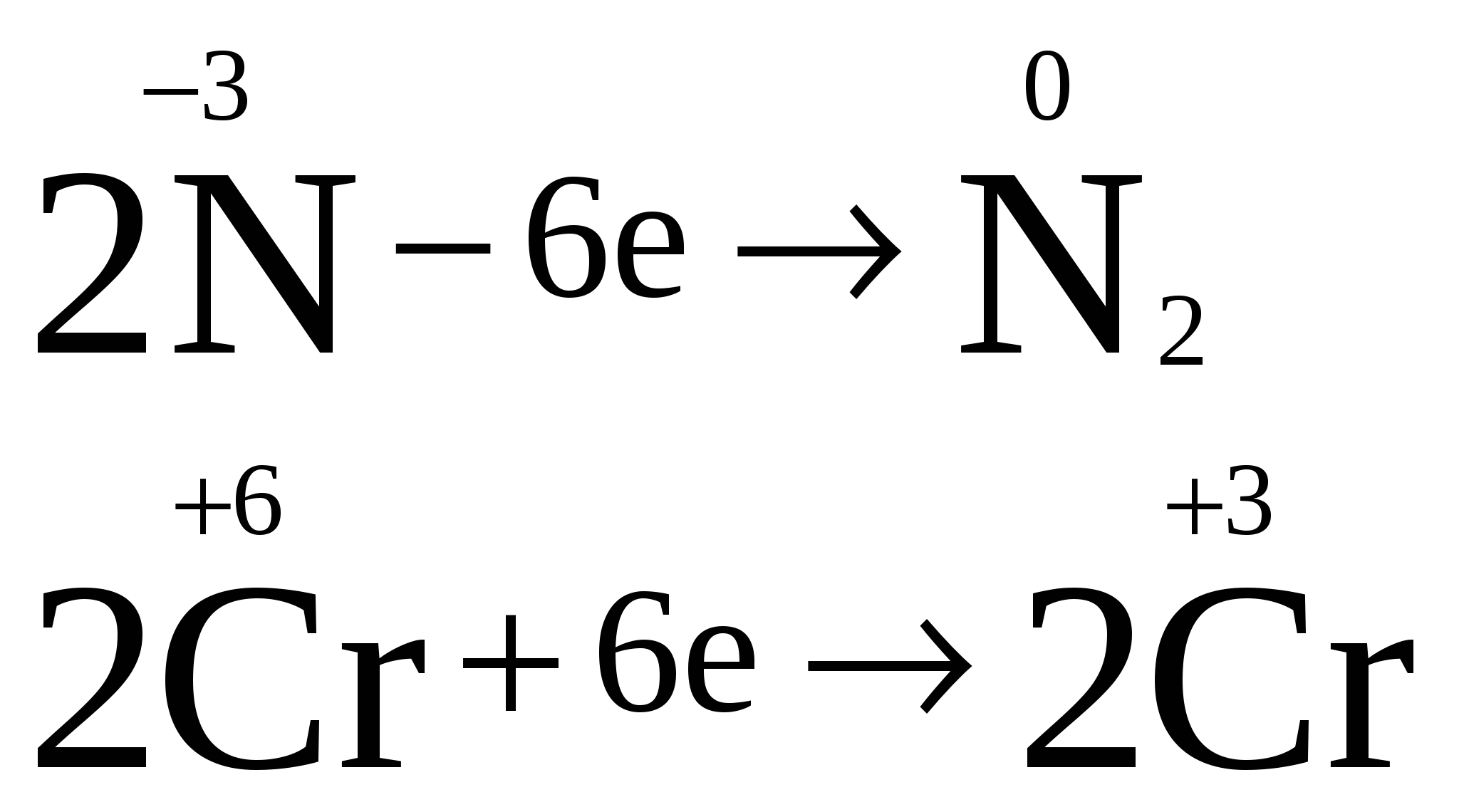 . Видим, что у азота степень окисления повышается (это полуреакция окисления), а у хрома – понижается (полуреакция восстановления). Запишем эти две полуреакции с указанием электронов, отдаваемых восстановителем и принимаемых окислителем. . Видим, что у азота степень окисления повышается (это полуреакция окисления), а у хрома – понижается (полуреакция восстановления). Запишем эти две полуреакции с указанием электронов, отдаваемых восстановителем и принимаемых окислителем.Р д должно быть 2 моль. В молекуле азота уже есть 2 моль азота. 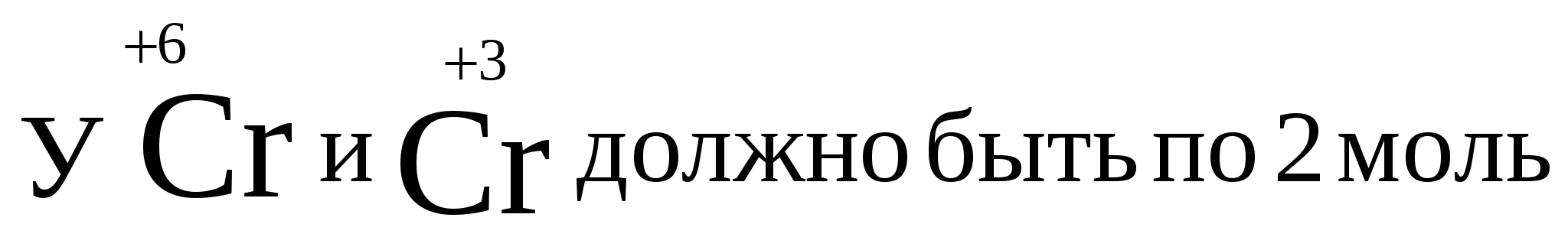 В дихромате аммония и в оксиде хрома(III) уже есть по 2 моль хрома. Значит перед дихроматом аммония, азотом и оксидом хрома(III) должны стоять единицы, которые обычно не ставятся. У В этом уравнении и элемент окислитель, и элемент восстановитель находятся в одном соединении, но это разные элементы. Такой тип ОВР называется внутримолекулярный. А Коррозия металлов и способы защиты от нее. Самопроизвольно протекающий процесс разрушения металлов в результате взаимодействия с окружающей средой называется коррозией. Металлы окисляются и образуются продукты коррозии, состав которых зависит от ее условий. Меры борьбы с коррозионными процессами являются актуальной задачей современной техники. Наиболее актуальна защита от электрохимической коррозии металла в средах, имеющих ионную проводимость, протекает через анодное окисление металла Ме – nе Men+ и катодное восстановление окислителя. Наиболее часто при коррозии окислителями являются: 1) кислород и протекает кислородная коррозия О2 + 2Н2О + 4е = 4ОН–; 2) ион водорода в кислой среде и протекает водородная коррозия 2Н+ + 2е = Н2 Защита металлов от коррозии 1. Создание рациональных конструкций, способствующее предотвращению коррозии. Необходимо, чтобы при выпадении осадков не происходило скапливание атмосферной воды на агрегатах и приборах, что приводит к «точечной» коррозии. Очень важна также термическая обработка изделий, подвергающихся различным деформациям, чтобы избежать «ножевой» коррозии. 2. Изменение свойств коррозионной среды. Для снижения агрессивности среды уменьшают концентрацию компонентов, опасных в коррозионном отношении. Например, удаление кислорода из воды кипячением. Восстановление окислителей сульфитами, гидразином и др.. Удаляют галогены, так как они чаще всего ускоряют коррозию. Вводят ингибиторы, при добавлении которых резко уменьшается скорость коррозии по разным причинам. Легирование (пассивация) металлов – эффективный, но дорогой метод повышения коррозионной стойкости металлов. В качестве компонентов, вызывающих пассивацию металлов применяют хром, никель вольфрам и некоторые другие металлы. 3. Защитные покрытия. Защитными покрытиями являются искусственно создаваемые слои на поверхности металлов, предохраняющие их от коррозии. Различают катодные и анодные покрытия. В качестве катодного покрытия используют неактивный металл (золото и др.), электродный потенциал металла-покрытия больше чем у защищаемого металла. 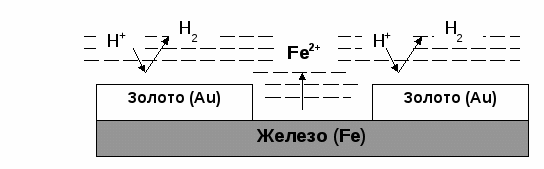 Рис. Процессы, проходящие при разрушении катодного покрытия защищаемого металла. При разрушении покрытия образуется коррозионный гальванический элемент. Металл покрытия является катодом, а защищаемый металл – анодом. В качестве анодного покрытия используются металлы, электродный потенциал которых меньше, чем у защищаемого металла, но эти металлы в природных условиях покрыты прочной оксидной пленкой, которая защищает их от разрушения под действием окружающей среды (цинк, хром и другие металлы). 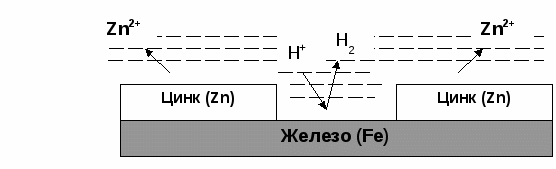 Рис. Процессы, проходящие при разрушении анодного покрытия защищаемого металла. При разрушении покрытия образуется коррозионный гальванический элемент. Металл покрытия является анодом, а защищаемый металл – катодом. Для получения металлических и неметаллических защитных покрытий существуют различные способы их нанесения. А. Металлизация. Б. Термодиффузия. В. Химические способы (лакирование, окраска, покрытие полимерами, оксидирование, фосфатирование и другие). Г. Электрохимические методы (гальванические покрытия).  «Метод внешнего потенциала». В этом методе защищаемое изделие подключается к отрицательному полюсу внешнего источника постоянного тока, поэтому оно становится катодом, а в качестве анода обычно стальной электрод, который заземляется. Этот метод используется, если нет контакта с человеком или животными. 1.4.9. Электролиз расплавов и растворов (солей, щелочей, кислот). Электролизом называется несамопроизвольная химическая реакция, протекающая при пропускании постоянного тока через раствор или расплав электролита. Простейшая установка для проведения реакции электролиза. Через раствор электролита пропускается постоянный электрический ток  К катоду (-) движутся катионы, а к аноду (+) – анионы 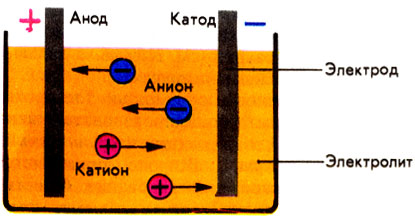 Закономерности катодного восстановления Так как на катоде идет реакция восстановления, то в первую очередь должны реагировать наиболее сильные окислители, т.е. имеющие наиболее положительный электродный потенциал. Для катодного восстановления при электролизе водного раствора электролита все окислители можно разделить на три группы. 1. Если соль содержит катион активного металла, электродный потенциал которых существенно более отрицателен, чем потенциал водородного электрода (в ряду напряжений до Аl). В водных растворах разряд этих ионов практически не происходит, так как на катоде происходит разложение только воды. Kатод: 2H2O + 2e = H2 + 2OH 2. Если соль образована катионом неактивного металла (в ряду напряжений за водородом), то на катоде выделяется сам металл, а разряд катионов водорода не происходит. Катод: Cu2+ + 2e = Cu 3. Если соль образована катионом металла, электродный потенциал которого мало отличается от водородного (они стоят в ряду напряжения между алюминием и водородом), то идут оба процесса, которые в сильной степени зависят от условий электролиз (плотности тока и т.д.). На катоде в этом случае мы будем писать оба процесса: и разложение воды, и выделение металла. Kатод: 2H2O + 2e = H2 + 2OH Ni2+ +2e=Ni Кроме того, выделение водорода на многих катодах идет с более высоким перенапряжением, чем перенапряжение разряда многих металлов. Так, например, для солей цинка сначала выделяется водород, а при больших плотностях тока только цинк. В данном случае высокое водородное перенапряжение – явление положительное, т.к. из водных растворов удается выделить многие металлы, которые более активны, чем водород. Закономерности анодного окисления Характер реакций, протекающих на аноде, зависит как от присутствия молекул воды, так и от вещества, из которого сделан анод. Нерастворимые аноды (графит, платина) при электролизе сами не посылают электроны во внешнюю цепь, электроны посылаются в результате окисления анионов и молекул воды. На аноде протекают реакции окисления восстановителей, поэтому в первую очередь на аноде должны реагировать наиболее сильные восстановители (имеющие меньший электродный потенциал). 1. На аноде разряжаются простые анионы (Cl , Br , I , S2-), кроме F . Анод: 2Cl 2e = Cl2 2. Сложные анионы и F сами не разряжаются, а происходит анодное окисление воды: Анод: 2Н2О – 4е = О2 + 4Н+ 3. Если анод растворимый, то конкурируют три процесса: а) Ме – ne = Men+ растворение (окисление) металла; б) 2Н2О – 4е = О2 + 4Н+ окисление воды =1,23 В; в) Окисление анионов. Наименьшим потенциалом обладает окисление металла, поэтому на аноде будет происходить именно этот процесс. В случае электролиза CuCl2 с растворимым медным анодом будут происходить следующие процессы: на аноде: Cu – 2e = Cu2+ на катоде: Cu2+ + 2e = Cu Суммарная реакция 0=0, т.е. просто происходит перенос меди с анода на катод. Этот процесс называется рафинированием (очисткой) меди. При электролизе расплавов воды нет, и будут разряжаться сами катионы и анионы. Примеры 1. Электролиз СuSO4 Cur2+ + SO42- Медь – металл неактивный (φо= +0,34 В), поэтому на катоде идет только: разрядка катиона, а на аноде разрядка воды, т.к. анион SO42- сложный. на катоде (-): Cu2+ + 2е Cu; Cu2+ и Н2О на аноде (+): 2Н2О - 4е О2 + 4Н+ SO42- и Н2О Схема электролиза: Для СuSO4 на аноде выделяется кислород, а на катоде медь.  2. Электролиз HCl Н+ можно отнести к неактивным, поэтому на катоде идет разрядка катиона, а на аноде идет разрядка хлорид иона, т.к. анион простой. На катоде: 2Н+ + 2е Н2 Н+ и Н2О На аноде: 2Cl- - 2e Cl2 Cl- и Н2О Схема электролиза 2HCl Н2 + Cl2 3. Электролиз NaOH Натрий – активный металл (φо= -2,71 В), поэтому на катоде идет только разрядка вода, а на аноде тоже разрядка воды, т.к. анион ОН- сложный. на катоде (-): 2Н2О + 2е Н2 + 2ОН- Na+ и Н2О на аноде (+): 2Н2О - 4е О2 + 4Н+ OH- и Н2О Схема электролиза 2Н2О 2Н2 + О2 При электролизе гидроксида натрия на катоде выделяется в 2 раза больше газа (водорода), чем на аноде (кислорода).  2. НЕОРГАНИЧЕСКАЯ ХИМИЯ 2.1. Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная) 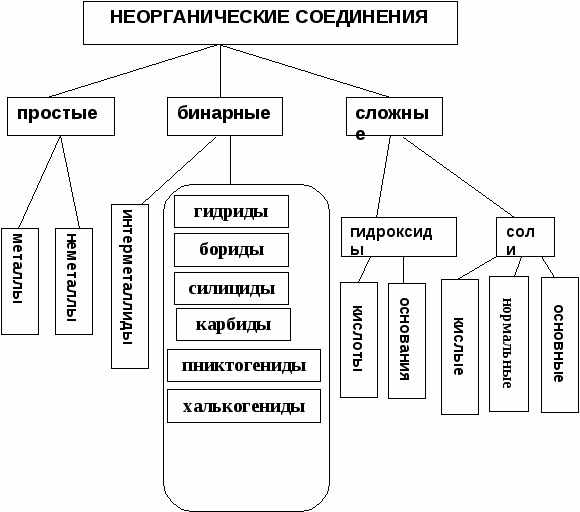 п о с о с т а в у п о ф у н к ц и о н а л ь н ы м п р и з н а к а м 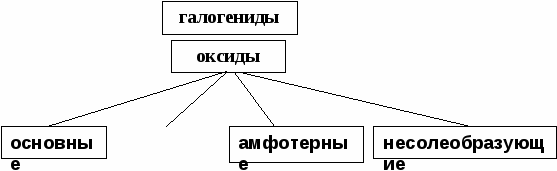 кислые Химия, как и любая наука, имеет свой язык, причем письменная форма химического языка играет более важную роль по сравнению с его устной формой. Основным отличием языка химии от обычных языков является наличие в нем номенклатурных правил, то есть таких правил, руководствуясь которыми можно давать названия элементам, соединениям. Для химика наиболее важны правила называния огромного числа известных химических соединений. Надо обратить внимание, что неорганическая химия более древняя наука, чем остальные разделы химии. Существовали две объективные причины препятствующие созданию единой систематизированной химической номенклатуры - наличие языковых барьеров (одно и то же вещество может по-разному называться на национальных языках) и сложившиеся традиции в крупных сообществах химиков, работающих в разных странах. Только в 1978 году номенклатурная комиссия ИЮПАК (Международный союз теоретической и прикладной химии) на своем съезде решила упорядочить названия химических элементов и создать современную номенклатуру. Целью современной систематической химической номенклатуры является однозначное описание состава и, по мере возможности, строения соединений. Необходимо, чтобы по названию можно было бы написать формулу и наоборот. Например, знакомая нам серная кислота по новой номенклатуре называлась бы тетраоксосульфат диводорода; зато по этому названию легко написать формулу. Соединение называется справа налево: тетра 4, оксо –кислород О4, сульфат – сера SO4, ди – 2 - 2SO4, водорода – Н - Н2SO4. По названию написали формулу. Но традиции есть традиции, и решили современную номенклатуру адаптировать для каждой страны. В нашей стране этим занимался профессор МГУ Бокий. Новые соединение (комплексные) уже называются по новой номенклатуре. В соответствии с этими правилами названия соединений можно разделить на три категории. 1. Рекомендованные названия химических соединений, построенные в соответствии с принципами систематической химической номенклатуры. 2. Альтернативные (традиционные) названия соединений, построенные с нарушением принятых новых принципов номенклатуры, но имеющие широкое распространение. 3. Неноменклатурные (тривиальные или специальные) названия, которые подлежат изъятию из языка. |
