ОНХимияПлакидкин. Теоретические основы химии
 Скачать 25.3 Mb. Скачать 25.3 Mb.
|
|
2.7. Характерные химические свойства солей: средних, кислых, основных, комплексных (на примере соединений алюминия и цинка) Солями называются соединения, состоящие из катионов металлов (или аммония) и кислотных остатков. Соли можно рассматривать как продукт взаимодействия кислоты и основания при этом могут получаться нормальные (средние), кислые и основные соли. Нормальные соли образуются в том случае, когда количеств кислоты и основания достаточно для полного взаимодействия. Н3РО4 + 3КОН = К3РО4 + 3Н2О Кислые соли образуются при недостатке основания, когда катионов металла недостаточно для замещения всех катионов водорода в молекуле кислоты. Н3РО4 + 2КОН = К2НРО4 + 2Н2О Н3РО4 + КОН = КН2РО4 + Н2О В кислых солях в составе кислотных остатков содержится водород. Кислые соли возможны для многоосновных кислот и невозможны для одноосновных. Основные соли образуются при недостатке кислоты, когда анионов кислотных остатков недостаточно для полного замещения всех гидроксогрупп в основании. Cr(OH)3 + HNO3 = Cr(OH)2NO3 + H2O Cr(OH)3 + 2HNO3 = CrOH(NO3)2 + 2H2O В основных солях в составе катионов содержатся гидроксогруппы. Основные соли возможны для многокислотных оснований (содержат две и больше ОН-группы) и невозможны для однокислотных. Некоторые основные соли самопроизвольно разлагаются с выделением воды, при этом образуются оксосоли. Sb(OH)2Cl = SbOCl + H2O Bi(OH)2NO3 = BiONO3 + H2O Оксосоли обладают всеми свойствами основных солей. Многие соли в твердом состоянии являются кристаллогидратами: CuSO4.5H2O; Na2CO3.10H2O и т.д. Свойства солей Соли – твердые кристаллические вещества с ионными химическими связями между катионами и анионами. Химические свойства солей обусловлены их взаимодействием с металлами, кислотами, основаниями и солями. Соли взаимодействуют с металлами: более активные металлы вытесняют менее активные из растворов их солей. Zn + CuSO4 = ZnSO4 + Cu Cu + Ag2SO4 = CuSO4 + 2Ag При взаимодействии солей с кислотами, щелочами и другими солями реакции проходят до конца, если образуется осадок, газ или малодиссоциируемое соединение. Для реакции солей с кислотами: H2S сероводород – газ; BaSO4 сульфат бария – осадок; CH3COOH уксусная кислота – слабый электролит, малодиссоциируемое соединение. K2S + H2SO4 = K2SO4 + H2S BaCl2 + H2SO4 = BaSO4 + 2HCl CH3COONa + HCl = NaCl + CH3COOH Для реакции солей со щелочами: Ni(OH)2 гидроксид никеля(II)– осадок; NH3 аммиак– газ; H2O вода – слабый электролит, малодиссоциируемое соединение. NiCl2 + 2KOH = Ni(OH)2 + 2KCl NH4Cl + NaOH = NH3 +H2O +NaCl Соли реагируют между собой, если образуется осадок Ca(NO3)2 + Na2CO3 = 2NaNO3 + CaCO3 или образуется более устойчивое соединение. Ag2CrO4 + Na2S = Ag2S + Na2CrO4 В этой реакции из кирпично-красного хромата серебра образуется черный сульфид серебра, т.к. он является более нерастворимым осадком, чем хромат. Произведение растворимости ПР(Ag2S)=7,2.10-50, а ПР(Ag2CrO4)=1,2.10-12. Многие соли разлагаются при нагревании с образованием двух оксидов – кислотного и основного. CaCO3 = СаО + СО2 Несколько отлично от остальных солей разлагаются нитраты. При нагревании нитраты щелочных и щелочноземельных металлов выделяют кислород и превращаются в нитриты: 2NaNO3 = 2NaNO2 + O2 Нитраты почти всех других металлов разлагаются до оксидов: 2Zn(NO3)2 = 2ZnO + 4NO2 + O2, а нитраты некоторых тяжелых металлов (серебра, ртути и др) разлагаются при нагревании до металлов: 2AgNO3 = 2Ag + 2NO2 + O2 Особое положение занимает нитрат аммония, который до температуры плавления (170оС) частично разлагается по уравнению: NH4NO3 = NH3 + HNO3 при температурах 170 - 230оС - по уравнению: NH4NO3 = N2O + 2H2O, а при температурах выше 230оС - со взрывом по уравнению: 2NH4NO3 = 2N2 + O2 + 4H2O Хлорид аммония NH4Cl разлагается с образованием аммиака и хлороводорода. NH4Cl = NH3 + НCl Комплексные соли (на примере соединений алюминия и цинка) Комплексным (координационным) соединением (комплексом) называется такое соединение, в узлах кристаллической решетки которого находятся комплексные ионы, обладающие высокой симметрией, устойчивые как в твердом состоянии, так и в растворах. Na[Al(OH)4] – Кнест.= 3,16×10-33; Na2[Zn(OH)4] – Кнест.= 2,34×10-17 [Al(NH3)4](NO3)3; [Zn(NH3)4]SO4 Кнест.= 3,50×10‾10. В центре комплексного иона находится металл (обычно d-металл, реже р-металл), который называется комплексообразователь. Вокруг него очень симметрично располагаются лиганды, за счет чего электронная плотность распределяется равномерно и комплекс становится устойчивым. Лигандами могут быть анионы кислот или нейтральные молекулы (Н2О, СО, NH3), которые имеют неподеленную пару электронов. Она принимает участие в донорно-акцепторном взаимодействии с вакантной орбиталью комплексообразователя. Комплексный ион может выступать как в качестве аниона ([Al(OH)4]-, [Zn(OH)4]2-), так и в качестве катиона ([Al(NH3)4]3+, [Zn(NH3)4]2+). 2.8. Взаимосвязь различных классов неорганических веществ. Между классами веществ существует возможность их взаимного превращения: из простых веществ получают оксиды, из оксидов – основания или кислоты, из кислот – соли. Возможен и обратный переход от солей к основаниям и кислотам, от основания и кислот к оксидам, а от оксидов к простым веществам. Подобная связь между классами соединений, позволяющая получать вещество одного класса из вещества другого, называется генетической. Необходимо иметь в виду, что не всегда одно вещество из другого можно получить напрямую. Например, гидроксид меди(II) Cu(OH)2 нельзя получить взаимодействием оксида меди(II) с водой. В этом случае применяют косвенный путь: на оксида меди(II) действуют кислотой и получают соль, а из соли действием щелочи получают гидроксид меди(II). Генетическую связь между основными классами неорганических соединений можно показать схематически 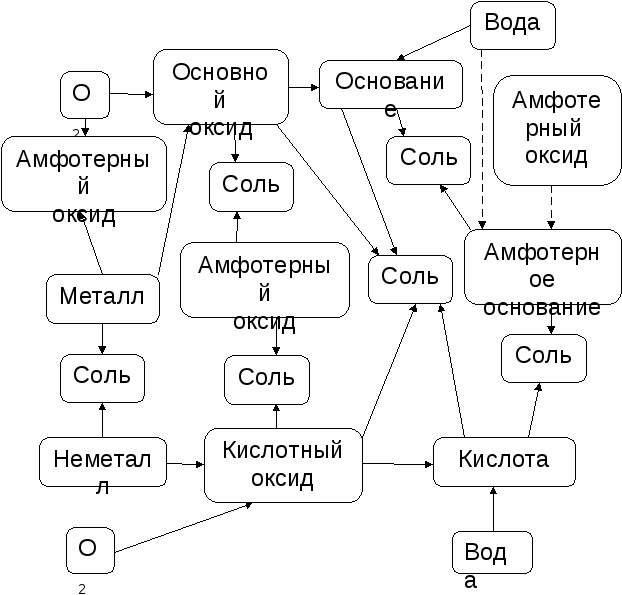 1. Металл, реагируя с кислородом, дает основной или амфотерный оксид. Неметалл при реакции с кислородом дает только кислотный оксид. Реакции проходят при нагревании, так как кислород имеет прочную двойную связь. 2. Металл может реагировать с неметаллом, образуя соль. Только активные металлы и неметаллы реагируют при обычных условиях. Для остальных элементов для проведения реакции необходимо нагревание. 3. Основной оксид может реагировать с амфотерным и кислотным оксидами, образуя соли. Кислотный оксид может реагировать с амфотерным и основным оксидами, образуя соли. Оксиды активных металлов могут реагировать при обычных температурах, а остальные при нагревании. 4. Основной оксид с водой образует основания. Только активные щелочные и щелочно-земельные металлы реагируют с водой при обычных условиях с образованием сильных оснований, для остальных необходим нагрев. Например, оксид магния лучше реагирует с водой при нагревании, так как гидроксид магния малорастворим. MgO + Н2О = Mg(OH)2 Многие кислотные оксиды реагируют с водой, образуя кислоты. Некоторые кислотные оксиды с водой при обычных условиях не взаимодействуют, поэтому их получают косвенным путем. Амфотерные оксиды с водой практически не взаимодействуют, поэтому их получают косвенным путем. 5. Основания могут реагировать с амфотерным основаниями и кислотами, образуя соли. Кислоты реагируют с основаниями и амфотерными основаниями, образуя соли. |
