ОНХимияПлакидкин. Теоретические основы химии
 Скачать 25.3 Mb. Скачать 25.3 Mb.
|
|
1.3.2. Электроотрицательность. Степень окисления и валентность химических элементов. Электроотрицательностью называется свойство химического элемента притягивать к своему атому электроны от атомов других элементов, с которыми данный элемент образует химическую связь в соединениях. При образовании химической связи между атомами разных элементов общее электронное облако смещается к более электроотрицательному атому, из-за чего связь становится ковалентно-полярной, а при большой разности электроотрицательностей – ионной. Электроотрицательность учитывается при написании химических формул: в бинарных соединениях сзади записывается символ наиболее электроотрицательного элемента. Электроотрицательность возрастает в направлении слева направо для элементов каждого периода и уменьшается в направлении сверху вниз для элементов одной и той же группы ПС. Валентностью элемента называется свойство его атомов соединяться с определенным числом других атомов. Различают стехиометрическую, электронную валентность и координационное число. Мы рассмотрим только стехиометрическую валентность. Стехиометрическая валентность показывает, сколько атомов другого элемента присоединяет атом данного элемента. За единицу валентности принята валентность водорода, т.к. водород всегда одновалентен. Например, в соединениях HCl, H2O, NH3 (правильное написание аммиака Н3N уже используется в современных пособиях), СН4 хлор одновалентен, кислород двухвалентен, азот трехвалентен и углерод четырехвалентен. Стехиометрическая валентность кислорода обычно равна 2. Так как почти все элементы образуют соединения с кислородом, то удобно его использовать в качестве эталона для определения валентности другого элемента. Например, в соединениях Na2O, CoO, Fe2O3, SO3 натрий одновалентен, кобальт двухвалентен, железо трехвалентно, сера шестивалентна. В окислительно-восстановительных реакциях нам важно будет определять степени окисления элементов. Степенью окисления элемента в веществе называется его стехиометрическая валентность, взятая со знаком плюс или минус. Химические элементы подразделяются на элементы постоянной валентности элементы переменной валентности. 1.3.3. Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения. В зависимости от того, в каком состоянии соединения находятся в природе, они делятся на молекулярные и немолекулярные. В молекулярных веществах мельчайшими структурными частицами являются молекулы. Эти вещества имеют молекулярную кристаллическую решетку. В немолекулярных веществах мельчайшими структурными частицами являются атомы или ионы. Кристаллическая решетка у них атомная, ионная или металлическая. Тип кристаллической решетки во многом определяет свойства веществ. Например, металлы, имеющие металлический тип кристаллической решетки, отличаются от всех остальных элементов высокой пластичностью, электро- и теплопроводностью. Эти свойства, а также и многие другие – ковкость, металлический блеск и т.п. обусловлены особым видом связи между атомами металла -- металлической связью. Необходимо отметить, что свойства, присущие металлам, проявляются только в конденсированном состоянии. Например, серебро в газообразном состоянии не обладает физическими свойствами металлов. Особый тип связи в металлах – металлическая – обусловлен дефицитом валентных электронов, поэтому они общие для всей структуры металла. Наиболее простая модель строения металлов предполагала, что кристаллическая решетка металлов состоит из положительных ионов, окруженных свободными электронами, движение электронов происходит хаотически, подобно молекулам газа. Однако такая модель, качественно объясняя многие свойства металлов, при количественной проверке оказывается недостаточной. Дальнейшая разработка теории металлического состояния привела к созданию зонной теории металлов, которая основывается на представлениях квантовой механики. В узлах кристаллической решетки находятся катионы и атомы металла, а электроны свободно перемещаются по кристаллической решетке. 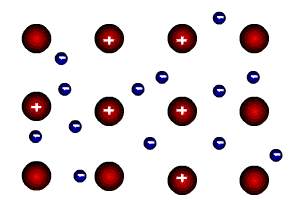 Характерным механическим свойством металлов является пластичность, обусловленная особенностями внутреннего строения их кристаллов. Под пластичностью понимают способность тел под действием внешних сил подвергаться деформации, которая остается и после прекращения внешнего воздействия. Это свойство металлов позволяет придавать им различную форму при ковке, прокатывать металл в листы или вытягивать в проволоку. Пластичность металлов обусловлена тем, что при внешнем воздействии слои ионов, образующих кристаллическую решетку, сдвигаются относительно друг друга без разрыва. Это происходит в результате того, что переместившиеся электроны благодаря свободному перераспределению продолжают осуществлять связь межу ионными слоями. При механическом воздействии на твердое вещество с атомной решеткой смещаются отдельные ее слои и сцепление между ними нарушается из-за разрыва ковалентных связей. Если в узлах кристаллической решетки находятся ионы, то эти вещества образуют ионный тип кристаллической решетки.  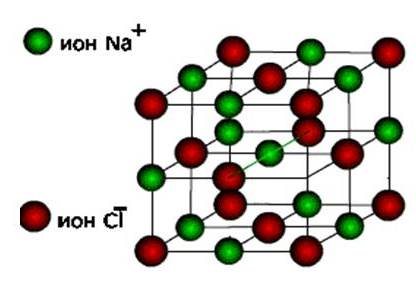 Это соли, а также оксиды и гидроксиды типичных металлов. Это твердые, хрупкие вещества, но основное их качество: растворы и расплавы этих соединений проводят электрический ток. Если в узлах кристаллической решетки находятся атомы, то эти вещества образуют атомный тип кристаллической решетки (алмаз, бор, кремний оксиды алюминия и кремния). По свойствам очень твердые и тугоплавкие, нерастворимы в воде. Если в узлах кристаллической решетки находятся молекулы, то эти вещества образуют молекулярный тип кристаллической решетки (при обычных условиях газы и жидкости: О2, HCl; I2 органические вещества). Интересно отметить металл галлий, который плавится при температуре 30оС. Эта его аномалия объясняется тем, что в узлах кристаллической решетки находятся молекулы Ga2 и его свойства в чем становятся схожи с веществами, имеющие молекулярную кристаллическую решетку. 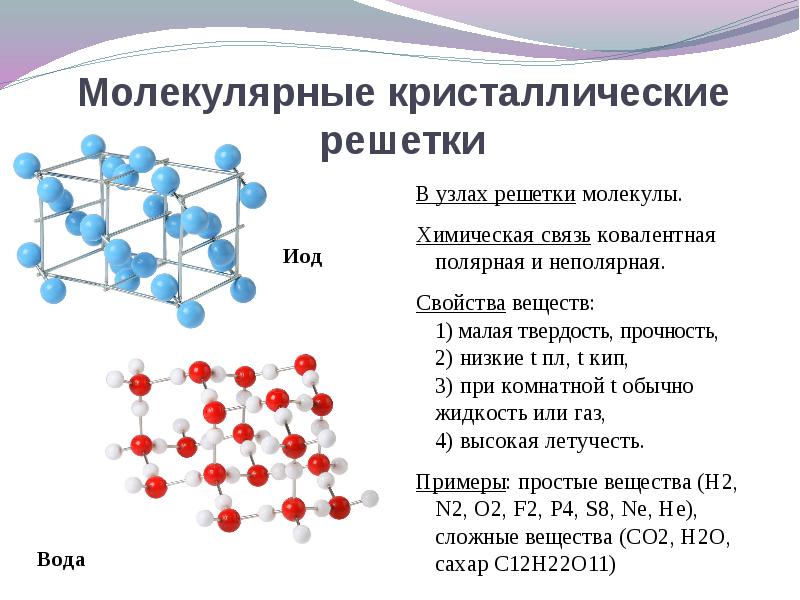 Пример. Немолекулярное строение имеют все неметаллы группы: 1) углерод, бор, кремний; 2) фтор, бром, иод; 3)кислород, сера, азот; 4) хлор, фосфор, селен. В немолекулярных веществах мельчайшими структурными частицами являются атомы или ионы. Кристаллическая решетка у них атомная, ионная или металлическая При решении этого вопроса проще идти от противного. Если в узлах кристаллической решетки находятся молекулы, то эти вещества образуют молекулярный тип кристаллической решетки (при обычных условиях газы и жидкости: О2, HCl; также I2, ромбическая сера S8, белый фосфор Р4, органические вещества). По свойствам это непрочные легкоплавкие соединения. Во втором ответе есть газ фтор, в третьем – газы кислород, азот, в четвертом – газ хлор. Значит, эти вещества имеют молекулярную кристаллическую решетку и молекулярное строение. В первом ответе все вещества – твердые соединения при обычных условиях и образуют атомную решетку, значит, имеют немолекулярное строение. Правильный ответ: 1) углерод, бор, кремний 1.4. Химическая реакция. 1.4.1. Классификация химических реакций в неорганической и органической химии. В неорганической химии химические реакции классифицируются по разным признакам. 1. По изменению степени окисления на окислительно-восстановительные, идущие с изменением степени окисления элементов и кислотно-основные, которые протекают без изменения степеней окисления. 2. По характеру процесса. Реакции разложения называют химические реакции, в которых простые молекулы получаются из более сложных. Реакции соединения называются химические реакции, в которых сложные соединения получаются из нескольких более простых. Реакции замещения называются химические реакции, в которых атом или группа атомов в молекуле замещаются на другой атом или группу атомов. Реакции обмена называют химические реакции, протекающие без изменения степени окисления элементов и приводящие к обмену составных частей реагентов. 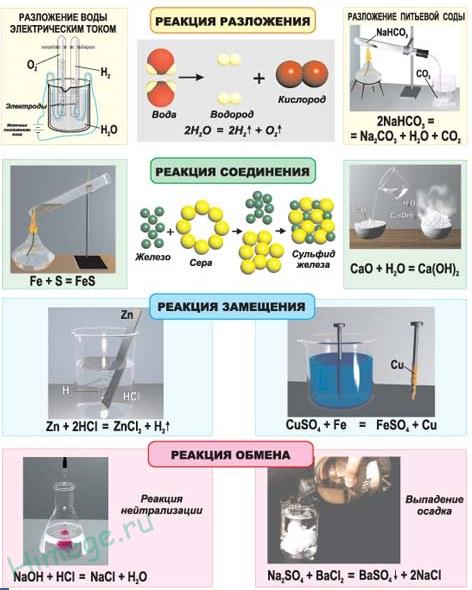  3. По возможности протекать в обратном направлении на обратимые и необратимые. Некоторые реакции, как например реакция горения этанола практически необратима, т.е. нельзя создать условия, чтобы она протекала в обратном направлении. Однако, существует много реакций, которые в зависимости от условий протекания процесса могут протекать как в прямом, так и в обратном направлениях. Реакции способные протекать как в прямом, так и в обратном направлении называются обратимые. 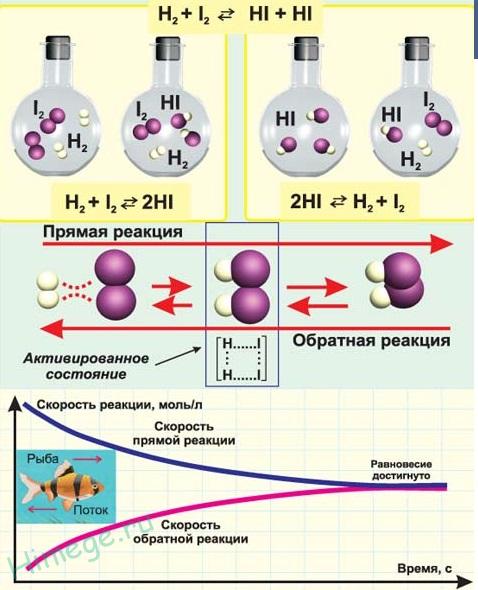 4. По типу разрыва связи – гомолитические (равный разрыв, каждый атом получает по одному электрону)и гетеролитические (неравный разрыв – одному достается пара электронов). 5. По тепловому эффекту экзотермические (выделение тепла) и эндотермические (поглощение тепла). Реакции соединения, как правило, будут экзотермическими реакциями, а реакции разложения – эндотермическими. Редкое исключение – реакция азота с кислородом эндотермическая N2 + O2 = 2NO – Q. 6. По агрегатному состоянию фаз. Гомогенные (реакция проходит в одной фазе, без границ раздела; реакции в газах или в растворах). Гетерогенные (реакции, проходящие на границе раздела фаз). 7. По использованию катализатора. Катализатор – вещество, ускоряющее химическую реакцию, но остающееся химически неизменным. Каталитические без использования катализатора практически не идут и некаталитические. 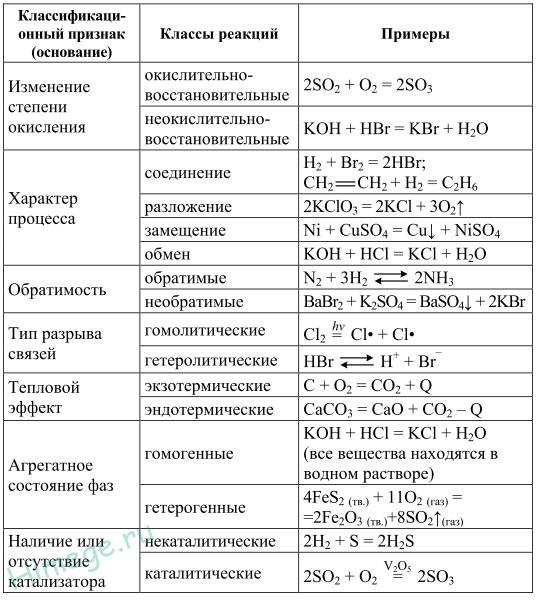 Классификация органических реакций
Электрофильными называют гетеролитические реакции органических соединений с электрофилами – частицами, несущими целый или дробный положительный заряд. Они подразделяются на реакции электрофильного замещения и электрофильного присоединения. Например, Н2С=СН2 + Вr2 BrCH2 – CH2Br Нуклеофильными называют гетеролитические реакции органических соединений с нуклеофилами – частицами, несущими целый или дробный отрицательный заряд. Они подразделяются на реакции нуклеофильного замещения и нуклеофильного присоединения. Например, CH3Br + NaOH CH3OH + NaBr Радикальными (цепными) называют химические реакции с участием радикалов, например 1.4.2. Тепловой эффект химической реакции. Термохимические уравнения. Любые химические реакции всегда сопровождаются теми или иными энергетическими эффектами, выделением или поглощением тепла, совершением электрической или механической работы. Изучением энергетических эффектов химических и физико-химических явлений занимается наука, называемая химической термодинамикой. Количество выделившейся или поглотившейся теплоты в химической реакции называется тепловым эффектом.  Химические реакции, в которых указан тепловой эффект реакции при Р,Т=const называются термохимическими.   Так как тепловой эффект зависит от агрегатного состояния вещества, его обозначают нижними индексами справа у химических формул (к – кристаллическое, г – газообразное, ж жидкое). Н2(г) + Сl2(г) = 2НСl(г) + 185 кДж Независимость теплового эффекта химической реакции от пути процесса при Р,Т = const была установлена в 1836 г русским ученым Гессом Германом Ивановичем. Закон Гесса гласит. Тепловой эффект химической реакции не зависит от пути ее протекания, а зависит лишь от природы и агрегатного состояния исходных веществ и продуктов реакции. 1.4.3. Скорость реакции, ее зависимость от различных факторов. Если рассмотреть две реакции: горения водорода 1. 2Н2 + О2 = 2Н2О(ж) и реакцию нейтрализации 2. Н+ + ОН– = Н2О(ж), то с точки зрения химической термодинамики вероятность протекания первой реакции почти в 3 раза превышает вероятность протекания второй. Однако, скорость первой реакции очень мала: при 25 С она прореагирует наполовину за 500 млрд лет; при 300 С прореагирует наполовину за 300 млн лет; при 600 С прореагирует наполовину за доли секунды. В то же время реакция нейтрализации с образованием воды, протекающая в растворах, вероятность протекания которой значительно меньше по сравнению с первой реакцией, идет практически мгновенно. Представление о скоростях химических реакций и факторах, влияющих на скорость, исключительно важно для управления химическими процессами. Область химии, изучающая молекулярный механизм химических реакций и скорость их протекания, называется ХИМИЧЕСКОЙ КИНЕТИКОЙ. В зависимости от типа химической реакции, их скорость может определяться по-разному, поэтому необходима классификация химических реакций. На данном этапе мы ограничимся изучением только гомогенных реакций. Гомогенные реакции – протекающие в однородной среде без каких-либо границ раздела между реагирующими веществами (газ, раствор). В этом случае молекулы всех реагирующих веществ находятся в одинаковых условиях. В результате химической реакции происходит изменение количества исходных веществ и образование новых. Поэтому для гомогенных реакций скорость химической реакции измеряется изменением концентрации реагирующих веществ в единицу времени: Скорость химической реакции – величина переменная по времени, т.к. концентрации веществ непрерывно изменяются, поэтому часто используют истинную (мгновенную) скорость реакции. Скорость реакции можно измерять, зная изменение концентрации хотя бы одного участника реакции. Например, для реакции: аА + вВ = сС + dD ее скорость можно определить по любому участнику реакции с учетом стехиометрических коэффициентов (минус для реагентов, т.к. их концентрация в процессе реакции уменьшается, плюс для продуктов, т.к. их концентрация увеличивается): V = Зависимость скорости реакции от концентрации реагирующих веществ. Необходимым условием для осуществления акта химического взаимодействия между молекулами должно быть их столкновение, необходимое для разрушения старых и образования новых связей. Столкновение молекул в некотором реакционном пространстве при заданной температуре происходит тем чаще, тем больше этих молекул. Поэтому скорость реакции зависит от концентрации реагирующих веществ. С этой точки зрения интересно рассмотреть такую задачу. Пример. Какая реакция протекает с наибольшей скоростью при комнатной температуре?
В растворе некоторые вещества (сильные электролиты) подвергаются электролитической диссоциации на ионы. Таким образом, в растворах первую задачу – разрушение старых связей – осуществляет полярный растворитель (в водных растворах – вода). Напишем молекулярные и ионные уравнения этих реакций (для 1-3 реакций они будут одинаковы). Zn + 2HCl = ZnCl2 + Н2; Zn + 2H+ + 2Cl- = Zn2+ + 2Cl- + Н2 4. ZnCl2 + 2AgNO3 = 2AgCl + Zn(NO3)2; |
