ОНХимияПлакидкин. Теоретические основы химии
 Скачать 25.3 Mb. Скачать 25.3 Mb.
|
|
Железо медленно окисляется атмосферным кислородом и влагой: 4Fe + 6H2O + 3O2 = 4Fe(OH)3 Этот процесс называется атмосферной коррозией. Железо при обычных температурах взаимодействуют с кислотами-неокислителями с образованием солей (МеСl2, MeSO4) в степени окисления +2 и выделением водорода. В холодных концентрированных Н2SO4 и HNO3 металлы пассивируются, что позволяет концентрированную серную кислоту перевозить в железных цистернах; в разбавленной азотной кислоте железо окисляется до степени окисления +3. Fe+4HNO3=Fe(NO3)3+NO+2H2O Медь является неактивным металлом, не реагирует с кислотами-неокислителями, но реагирует с азотной и концентрированной серной кислотами. Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O Для меди наиболее характерна степень окисления +2. Пример. Какое уравнение соответствует реакции разбавленной азотной кислоты с медью 1) 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O 2) Cu + 2HNO3 = Cu(NO3)2 + H2 3) Cu + 2HNO3 = CuO + NO2 + H2O 4) Cu + HNO3 = CuO + NH2NO3 + H2O В азотной кислоте окислителем является азот в степени окисления +5, поэтому в этой реакции водород не выделяется. CuO в реакции образоваться не может, так как обязательно прореагирует с азотной кислотой. Чем активнее металл и разбавленнее азотная кислота, тем в большей степени она восстанавливается. Медь неактивный металл, значит с разбавленной кислотой будет образовываться NO, а с концентрированной – NO2. Описание опыта: медь опустили в раствор разбавленной азотной кислоты и сверху накрыли воронкой. В колбу, наполненную водой, начинает выделяться бесцветный газ (значит NO), а раствор становится голубым: образование сульфата меди(II).   Правильный ответ: 1) 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O Если NO соприкоснется с кислородом воздуха, то он превращается из бесцветного NO в бурый NO2.  Цинк устойчив на воздухе благодаря покрывающей его оксидной пленке. Цинк активно вытесняет водород из кислот-неокислителей: Zn + 2HCl = ZnCl2 + H2 Цинк с щелочами активно реагирует, т.к. он является амфотерным металлом: Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2 На гранулах цинка образуются пузырьки газа (водорода).  Цинк образует соединения только в степени окисления +2. 2.3. Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния. Водород (Н) - особый элемент, т.к. в его атоме единственный электрон не экранирован от ядра другими электронами. В периодической системе водород размещается в первой группе, потому что его атом, как и атомы щелочных металлов, содержит один валентный электрон. Одновременно водород находится и в седьмой группе, поскольку в его атоме, как и в атомах галогенов, не достаёт одного электрона до полного заполнения внешнего энергетического уровня. Положение водорода в седьмой группе вместе с галогенами более правомерно, т.к. он образует, подобно галогенам, двухатомные молекулы и отрицательно заряженные ионы. К тому же он, как и галогены, неметалл. Ионизационный потенциал атомарного водорода 13,6 эв, электроотрицательность 2,1. Двухатомные молекулы водорода Н2 очень легки, подвижны, неполярны. Межмолекулярное взаимодействие между ними слабое - дисперсионное. Поэтому водород плохо растворяется в жидкостях и очень летуч - температура его кипения 20,5 К или -252,6oC, а затвердевает водород при 14 К. Энергия связи в молекуле довольна велика (434 кДжмоль), поэтому ее распад на атомы начинается лишь при 2000 К. По этой причине реакции с участием водорода протекают, как правило, при нагревании. При этом водород проявляет как восстановительные, так и окислительные свойства: CuO + H2 (восстановитель) =Cu + H2O 2Na + H2 (окислитель) =2NaH - гидрид натрия Благородные металлы, никель, железо катализируют реакции с участием водорода; в присутствии катализаторов проводятся синтезы аммиака, метанола и все реакции с участием водорода в органической химии. Водород входит в состав соединений в степенях окисления -1 и +1. Соединения водорода с более электроположительными элементами называются гидридами; они подразделяются на ионные, ковалентные и металлические. p-Элементы седьмой группы имеют общее название галогены (“солеобразователи”). Наиболее распространенным галогеном является хлор, который в виде хлоридов натрия, калия, кальция и магния находится в водах океанов, морей и соленых озер. В таблице приведены некоторые характеристики атомов и двухатомных молекул галогенов:
Из таблицы видно, что у галогенов закономерно возрастают радиусы атомов, уменьшается электроотрицательность, увеличивается длина связи в молекулах простых веществ. Энергия связи при переходе от F2 к Cl2 увеличивается, т.к. в молекуле хлора дополнительно образуются донорно-акцепторные связи за счет свободных d-орбиталей и заполненных р-орбиталей, а при переходе от хлора к брому, иоду и астату из-за увеличения длины связи – энергия связи уменьшается. Электронная конфигурация валентных электронов атомов галогенов ns2np5. Галогены - неметаллы, обладающие большим сродством к электрону. Присоединение электрона приводит к образованию галогенид-ионов с устойчивой 8-электронной оболочкой благородного газа. Все галогены - окислители: фтор - наиболее сильный окислитель, хлор и бром тоже относятся к окислителям, а йод проявляет как окислительные, так и восстановительные свойства. Таким образом, окислительная активность галогенов по группе сверху вниз уменьшается, поэтому вышестоящий галоген вытесняет нижестоящие из их соединений с металлами: Cl2+2NaBr=2NaCl+Br2 Сl2+2KI=2KСl + I2 Молекулы галогенов двухатомны. При обычных условиях F2 и Сl2 - газы, Вr2 - жидкость, а I2 - твердое вещество с молекулярной кристаллической решеткой. Фтор и хлор, а также пары брома и йода ядовиты. Так как йод имеет молекулярную кристаллическую решетку, то при нагревании он сублимируется (возгоняется) без разрушения в виде молекул I2  Фтор образует соединения только в одной степени окисления -1. Остальные галогены, кроме этой степени окисления, образуют соединения в положительных степенях окисления от +1 до максимальной +7. Кислород - самый распространенный элемент в природе. Он входит в состав песка, глины, горных пород и воды, в виде простого вещества О2 присутствует в воздухе. Энергия двойной связи в молекуле О2 довольно велика (498 кДж/моль), поэтому распад молекулы на атомы начинается при температуре свыше 2000 К. Кислород - сильный окислитель, однако из-за прочности его молекулы реакции окисления (горения) проходят, как правило, при высоких температурах. Если в колбу, наполненную кислородом опустить кусочек раскаленного железа, то начинается бурная реакция. 4Fe + 3O2 =2 Fe2O3  Кислород входит в соединения в степенях окисления -2, -1, +2 и +1. Соединения в степени окисления -2 (оксиды, основания, кислоты, соли) наиболее распространены. В степени окисления -1 он находится в пероксидах. Сера существует в виде восьмиатомных молекул S8. Сера плавится при 115оС и кипит при 445оС. Сера при взаимодействии с металлами является окислителем: Zn + S = ZnS 2Al + 3S = Al2S3 а при взаимодействии с сильными окислителями - восстановителем: S + 6HNO3 = H2SO4+ 6NO2 + 2H2O С водой сера не взаимодействует, в щелочах при нагревании диспропорционирует по уравнению: 3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O Азот содержится в атмосфере Земли в виде прочных двухатомных молекул N2 с тройной связью. Большая прочность молекулярного азота является причиной его малой химической активности. Лишь с некоторыми активными металлами, например с литием, азот взаимодействует как окислитель при невысоких температурах, образуя нитриды. Другие металлы и водород окисляются азотом при высоких температурах. В реакции с кислородом азот является восстановителем. Взаимодействие этих веществ с образованием NO заметно только при 4000оС; энергия активации этой реакции - самая высокая из всех известных - равна 540 кДж/моль. Основная область применения азота - синтез аммиака. Аммиак NH3 получают взаимодействием простых веществ по обратимой реакции: N2 + 3H2 Белый фосфор - мягкое воскообразное вещество, состоящее из тетраэдрических молекул Р4. Он плавится при 44оС, кипит при 257оС. При 800оС начинается диссоциация четырехатомных молекул на двухатомные Р2, а при 1200оС - на атомы. Белый фосфор - реакционноспособное вещество. На воздухе при комнатной температуре он окисляется до Р4О10, а при 40оС происходит самовоспламенение и бурное горение фосфора: Р4 + 5О2 = Р4О10 Самовоспламенение белого фосфора  Изучение окисления белого фосфора привело к открытию цепных реакций Н.Н.Семеновым - российским физико-химиком, лауреатом Нобелевской премии.  Фосфор также горит в среде галогенов, диоксида азота и СО2, окисляется азотной и концентрированной серной кислотами до Н3РО4: Р4 + 10Сl2 = 4РCl5 2P4 + 10NO2 = 2P4O10 + 5N2 P4 + 10CO2 = P4O10 + CO 3P4 + 20HNO3 + 8H2O = 12H3PO4 + 20NO При нагревании в растворах щелочей белый фосфор диспропорционирует: Р4 + 3КОН + 3Н2О = РН3 + 3КН2РО2 Белый фосфор и, особенно, его пары очень ядовит. Существуют другие модификации фосфора. Красный фосфор образуется при нагревании белого фосфора без доступа воздуха до 300oC. Красный фосфор не ядовит, на воздухе воспламеняется при 240оС. Черный фосфор образуется при нагревании белого под большим давлением. Он наименее активен, не ядовит, по внешнему виду и свойствам напоминает графит. 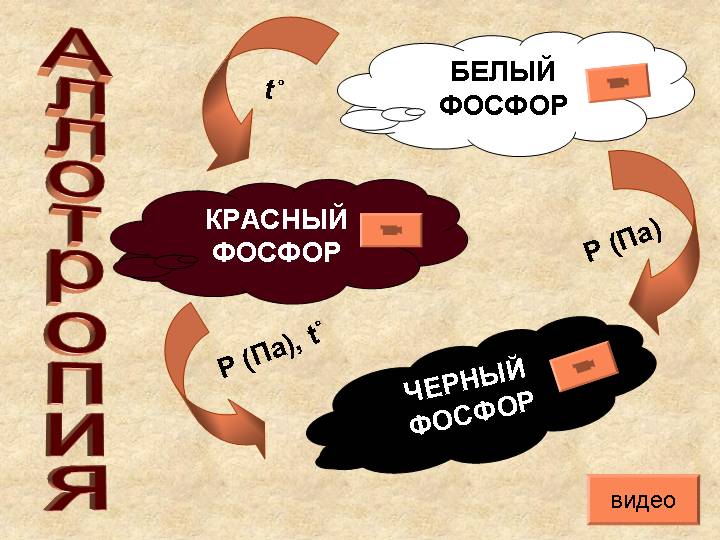 Углерод широко распространен в природе: углекислый газ в атмосфере, карбонаты кальция, магния, цинка, железа в земной коре, углеводородные соединения в нефти, природном газе, торфе и растениях. Каменный уголь является углеродом с различными примесями. В свободном состоянии углерод встречается в природе в двух аллотропических модификациях: графит и алмаз. Графит Алмаз   Кристаллическая решетка графита состоит из плоских слоев атомов углерода, которые в sp2 - гибридном состоянии связаны между собой в правильные смыкающиеся шестиугольники. Соседние слои атомов углерода в графите связаны между собой слабым межмолекулярным взаимодействием. Слои легко отделяются один от другого, поэтому при проведении графитом по бумаге или дереву остается след (черта). Атомы углерода в алмазе находятся в состоянии sp3 - гибридизации и связаны между собой в трехмерную тетраэдрическую сетку. Из всех твердых веществ алмаз имеет максимальное число атомов в единице объема, что объясняет его твердость Графит и алмаз химически очень инертны: не взаимодействуют с HNO3 и царской водкой, устойчивы в щелочах, с кислородом, серой, галогенами и металлами взаимодействуют только при высоких температурах. Аморфный углерод более активен: он окисляется азотной кислотой и концентрированной серной: С + 4HNO3 = CO2 + 4NO2 + 2H2O C + 2H2SO4 = CO2 + 2SO2 + 2H2O Углерод широко используется в хозяйственной деятельности человека. В виде кокса он применяется в металлургии для восстановления металлов. FeO + C = CO + Fe, т.е. является восстановителем. Кремний - второй по распространенности (после кислорода) элемент. Он входит в состав около 3000 минералов, из которых состоят горные породы и земная кора. Кремний химически инертен. При комнатной температуре он взаимодействует только со фтором, а реакции с хлором и кислородом протекают с заметной скоростью при 400оС и 600оС. С кислотами и царской водкой кремний не взаимодействует, и только смесь азотной и фтороводородной кислот переводит кремний в раствор в виде комплексного соединения: 3Si + 4HNO3 + 18НF = 3H2SiF6 + 4NO + 8H2O Кремний взаимодействует с расплавами и растворами щелочей, при этом он, в отличие от других неметаллов, не диспропорционирует, а только окисляется: Si + 4KOH = K4SiO4 + 2H2 Кремний взаимодействует при высоких температурах со многими металлами, образуя силициды. В силицидах щелочных и щелочноземельных металлов химическая связь имеет ионно-ковалентный характер, состав соединений постоянный, соответствующий степени окисления кремния (-4): Na4Si, Mg2Si и т.д. Таким образом, кремний проявляет окислительные свойства. Кремний не реагирует с водородом, но его соединения с водородом силаны существуют: SiH4 (моносилан). С галогенами кремний образует тетрагалогениды: газообразный SiF4, жидкие SiCl4 и SiBr4 и твердый SiI4. С серой кремний образует дисульфид кремния SiS2. С углеродом кремний образует карбид кремния. |
