учебник по патфизу. Учебник для слушателей и курсантов военномедицинской академии и военномедицинских институтов под редакцией проф. В. Ю. Шанина
 Скачать 4.96 Mb. Скачать 4.96 Mb.
|
|
Патогенез синдрома множественной системной органной недостаточности Согласно представлениям относительно недавнего времени, этиология СМСОН в основном сводилась к инфекции, которую невозможно локализовать посредством иммунных саногенетических реакций и лечебных воздействий. Поэтому основным содержанием лечения считали действие антибиотиков и хирургическую санацию очагов инфекции. В дальнейшем стало ясно, что инфекция не может быть единственным этиологическим фактором синдрома, так как данное патологическое состояние развивается у больных с панкреатитом, ожогами, после травматичных вмешательств, вследствие системной ишемии с реперфузионными повреждениями, а также осложняет тяжелую травматическую болезнь. При этом у многих больных с СМСОН не удается выявить источник инфекции и определить ее возбудитель. Осознание общности патогенеза синдрома вне зависимости от природы этиологических факторов (расстройства системного кровообращения, микроциркуляции, а также аэробного биологического окисления) послужило стимулом для разработки теории униформного патогенеза СМСОН. В соответствии с инфекционной теорией патогенеза СМСОН, кишечник - это среда обитания бактерий (десяти аэробов и десяти анаэробов) и может быть источником патогенов и токсичных бактериальных продуктов, циркулирующих с кровью; ишемия кишечной стенки угнетает барьерные функции слизистой оболочки, а также клеточных и молекулярных эффекторов систем иммунитета кишечной стенки. Это обуславливает форсирование барьера бактериями и бактериальными продуктами из просвета кишечника, то есть бактериемию и токсемию. При ишемии слизистой оболочки кишечника она становится источником воспалительных медиаторов, циркулирующих с кровью в повышенной концентрации, превращаясь в очаг эндотоксикоза. Концентрация протонов в кишечной стенке находится в прямой связи с тяжестью ишемии кишечной стенки и риском летального исхода при СМСОН. Так как кишечник при СМСОН считали источником бактериемии, то посредством стерилизации его просвета антибиотиками и другими лечебными воздействиями пытались снизить частоту пневмонии у больных при СМСОН и искусственной вентиляции легких. Оказалось, что возбудители пневмонии, связанной с длительной искусственной вентиляцией, попадают в легкие из ротовой полости и с кожных покровов. Известно, что у больных, выживающих, несмотря на развитие СМСОН, сердечный индекс и потребление кислорода выше, а периферическое сосудистое сопротивление ниже, чем в случаях летального исхода. Для выживания больных с СМСОН необходимо, чтобы сердечный индекс был выше 4,5 л•мин–1•м-2, системный транспорт кислорода превышал уровень в 600 мл•мин–1•м-2 , а потребление кислорода было более высоким, чем 170 мл•мин–1•м-2. Несмотря на данные факты, попытки снизить летальность при СМСОН, повышая системный транспорт кислорода действием средств с положительным инотропным эффектом (допексамин и др.) оказались неудачными. При СМСОН нарушается равновесие между образованием свободных кислородных радикалов, а также их элиминацией и инактивацией. Под действием свободных кислородных радикалов образуются повреждающие клетки высокореактогенные азотистые и другие соединения. Свободные кислородные радикалы участвуют в патогенезе СМСОН, подвергая клетки деструкции и действуя как вторичные мессенджеры при каскадах реакций, составляющих воспаление. При СМСОН растет фракция системного потребления кислорода, которую поглощают мононуклеарные фагоциты. Данная часть потребляемого кислорода поглощается мононуклеарами для усиленного образования и высвобождения свободных кислородных радикалов. В настоящее время патогенез СМСОН связывают с системной воспалительной реакцией. При системной воспалительной реакции активируются лейкоциты, циркулирующие с кровью, эндотелиальные клетки, клетки систем иммунитета (Купферовские и др.), локализованные в печени, гепатоциты, а также усиливается высвобождение и действие множества медиаторов воспаления, которым в физиологических условиях противостоят влияния антагонистов (медиаторов противовоспалительных реакций). Патогенез СМСОН во многом составляется усиленными системным действием хемоаттрактантов, экспрессией адгезивных молекул на эндотелиальных клетках и лейкоцитах, а также эффектами молекулярных эффекторов цитотоксических реакций клеток, участвующих в воспалении. СМСОН развивается при избыточности как системной воспалительной, так и системной антивоспалительной реакции. При неограниченности системной воспалительной реакции воспалительная альтерация вызывает необратимую потерю структурно-функциональных элементов регуляторных и исполнительных аппаратов. При избыточности антивоспалительной реакции организм становится беззащитным перед бактериальной инфекцией. При СМСН системная патологическая реакция индуцируется через действия клеток печени (гепатоцитов и клеточных эффекторов систем иммунитета), нейтрофилов, макрофагов и эндотелия. Гепатоциты образуют воспалительные белки. Один из них, С-реактивный белок, представляет собой опсонин, облегчающий фагоцитоз продуктов деградации белка и элементов клеточного ядра, которые могут быть субстратами при образовании токсичных соединений. Макрофаги участвуют в системной патологической реакции, высвобождая медиаторы воспаления: фактор некроза опухолей, интерлейкин-1, интерлейкин-6 и др. Данные медиаторы воспаления повышают экспрессию адгезивных молекул на нейтрофилах (L – селектина), эндотелиальных клетках (P-селектина, E-селектина, межклеточной адгезивной молекулы- 1, сосудистой адгезивной клеточной молекулы – 1), стимулируя выход лейкоцитов в межклеточные пространства. После эмиграции нейтрофилов в интерстиций полиморфноядерные лейкоциты высвобождают свободные кислородные радикалы и эндопептидазы, вызывающие системную воспалительную альтерацию и активирующие для воспаления его клеточные эффекторы. Так персистирует и усиливается лишенное защитного значения распространенное в пределах всего организма воспаление. Гиперцитокинемия, то есть циркуляция с кровью в повышенных концентрациях агентов ауто- паракринной регуляции клеток систем врожденного и приобретенного иммунитетов, характеризует патогенез МСОН. Цитокины – это медиаторы воспаления, действия которых вызывают: a) усиление защитных и цитотоксических эффектов T-лимфоцитов; б) экспрессию генов ферментов (например, индуцируемой синтетазы окиси азота в эндотелии и ключевого фермента синтеза С-реактивного белка в гепатоцитах; в) экспрессию на клеточной поверхности адгезивных молекул. Цитокины подразделяют на факторы роста (транформирующий фактор β и др.), лейкоцитарные хемотаксические хемокины (интерлейкин-8 и др.), модуляторы функций лимфоцитов (интелейкин-4 и др.), а также на модуляторы воспалительной реакции (интерлейкин-6 как провоспалительный цитокин и интерлейкин-10 как медиатор противовоспалительных реакций). Можно предположить, что целенаправленное ослабление действия цитокинов как медиаторов системной воспалительной реакции, сепсиса и СМСОН может снизить тяжесть данных угрожающих жизни состояний и подвергнуть их обратному развитию. К возможным патологическим следствиям эффектов цитокинов при гиперцитокинемии относят: а) избыточное образование свободных кислородных радикалов клетками систем врожденного иммунитета; в) рост высвобождения данными клетками эластазы и эндопептидаз; в) рост циркуляции с кровью растворимых в ней пептидаз со свойствами индукторов апоптоза. Концентрация данных обладающих разнонаправленным действием (плейотропных) медиаторов СМСОН не всегда находится с летальностью в достоверной прямой связи. Полагают, что отсутствие связи обусловлено тем, что ведущими звеньями патогенеза синдрома могут быть ишемия и реперфузия вследствие распространенного тромбоза микрососудов. В патогенезе СМСОН участвует множество медиаторов воспаления. Их действия варьируют по ходу движения патологического состояния во времени. Патогенные следствия эффекта медиаторов СМСОН (воспаления) не находятся в прямой связи с концентрацией того или иного флогогена в сыворотке крови. Тому причиной могут быть противодействия медиаторов противовоспалительной системы. В это связи можно предположить, что способ лечения СМСОН, состоящий в ослаблении действия какого-либо одного медиатора, или обречен на неэффективность или будет эффективным не всегда. Следует учитывать, что системная реакция на действие того или иного медиатора воспаления варьирует от больного к больному в зависимости от генетически детерминированной системной и органной реактивности (генетический плейоморфизм). При этом резистентность больного при развитии СМСОН во многом определяется варьирующим в пределах фенотипа и по ходу онтогенеза состоянием здоровья пациента. Примером проявления генетического полиморфизма может служить тот факт, что экспрессия адгезивных молекул на эндотелии микрососудов под действием гиперцитокинемии варьирует от больного к больному. Образование клетками печени белков острой фазы воспаления также варьирует в зависимости от особенностей наследственности больного. При такой особенности системной реактивности как большее образование фактора некроза опухолей в ответ на действие этиологических факторов шока, системной воспалительной реакции и сепсиса, вероятность СМСН выше. Выявление особенностей реакции на действие этиологических факторов СМСОН у определенного больного может быть информационной основой для целенаправленного использования генной терапии с использованием рекомбинантных технологий. Посредство генной терапии с использованием рекомбинантных технологий представляется возможным оптимизировать активацию организменных воспалительной и противовоспалительной системы. Терапия, ориентирования на дезоксирибионуклеиновую кислоту или рибонуклеиновую кислоты (олигонуклеотиды и др.) может ослабить избыточное образование медиаторов воспаления и СМСОН. Септический шок Определения сепсиса и септического шока Сепсис – это системная патологическая реакция на тяжелую инфекцию. Ее характеризуют лихорадка, тахикардия, тахипноэ, лейкоцитоз при идентификации очага первичной инфекции. При этом микробиологическое исследование крови нередко выявляет бактериемию. У части пациентов с синдромом сепсиса бактериемии не выявляют. Когда составляющими синдрома сепсиса становятся артериальная гипотензия и множественная системная недостаточность, то констатируют развитие септического шока (табл. 9.5). Частота сепсиса и септического шока неуклонно возрастает с тридцатых годов прошлого века и, по-видимому, будет продолжать возрастать. Тому причинами являются:
Сепсис остается наиболее частой причиной смерти в отделениях интенсивной терапии и одним из наиболее фатальных патологических состояний. Например, в Соединенных Штатах каждый год умирают от сепсиса около 100000. Сепсис, системная воспалительная реакция и септический шок (табл. 9.5) - это следствия избыточной реакции на стимуляцию бактериальными антигенами клеток, осуществляющих реакции врожденного иммунитета. Избыточная реакция клеток систем врожденного иммунитета и вторичная по отношению к ней реакция Т-лимфоцитов и В-клеток вызывают гиперцитокинемию. Гиперцитокинемия – это патологический рост содержания в крови агентов ауто- паракринной регуляции клеток, осуществляющих реакции врожденного иммунитета и приобретенные иммунные реакции. Таблица 9.5 Признаки септического шока
Таблица 9.5. (продолжение)
При гиперцитокинемии в сыворотке крови аномально возрастает содержание первичных провоспалительных цитокинов, фактора некроза опухолей-альфа и интерлейкина-1. В результате гиперцитокинемии и системной трансформации нейтрофилов, эндотелиальных клеток, мононуклеарных фагоцитов и тучных клеток в клеточные эффекторы воспаления, во многих органах и тканях возникает лишенный защитного значения воспалительный процесс. Воспаление сопровождается альтерацией структурно-функциональных элементов органов-эффекторов. Критический дефицит эффекторов обуславливает множественную системную недостаточность. Системная воспалительная реакция может быть следствием антигенной стимуляции экзо- и эндогенными антигенами, а также представлять собой результат воспаления в массивах некробиотически измененных тканей. О развитии системной воспалительной реакции говорит наличие двух или более следующих признаков:
О сепсисе свидетельствуют два или более признаков системной воспалительной реакции при подтвержденном данными бактериологических и других исследований наличии патогенных микроорганизмов во внутренней среде. Индукция сепсиса и септического шока При септическом шоке гиперцитокинемия повышает активность индуцибельной синтетазы оксида азота в эндотелиальных и других клетках. В результате снижается сопротивление резистивных сосудов и венул. Снижение тонуса данных микрососудоу уменьшает общее периферическое сосудистое сопротивление. Это снижает уровень возбуждения рецепторов транспортно-демпферного отдела системного кровообращения. Активность вагальных кардиальных нейронов падает и минутный объем кровообращения растет вследствие тахикардии. Несмотря на рост минутного объема кровообращения, часть клеток организма при септическом шоке страдает от ишемии, обусловленной расстройствами периферического кровообращения. Расстройства периферического кровообращения при сепсисе и септическом шоке - это следствия системной активации эндотелиоцитов, полифорфоядерных нейтрофилов и мононуклеарных фагоцитов. В активированном состоянии данные клетки осуществляют адгезию и экзоцитоз, что разрушает стенки микрососудов. Ишемия при сепсисе отчасти возникает вследствие спазма резистивных сосудов и прекапиллярных сфинктеров, который связан с дефицитом активности конституционной синтетазы оксида азота эндотелиоцитов и других клеток. Реакция системного кровообращения на возникновение воспалительного очага определенной распространенности направлена на уничтожение и элиминацию источников чужеродных антигенов, в том числе и своих некробиотически измененных тканей. При этом рост минутного объема кровообращения (МОК) отчасти представляет следствие выхода в кровь и супрасегментарного действия первичных провоспалительных цитокинов (фактора некроза опухолей-альфа и др.), которое повышает МОК. Рост МОК увеличивает доставку лейкоцитов в очаг воспаления. Кроме роста МОК, системную воспалительную реакцию и сепсис характеризует снижение общего периферического сосудистого сопротивления посредством дилатации сосудов сопротивления на периферии. Это повышает доставку лейкоцитов в капилляры. Если в физиологических условиях нейтрофилы незатрудненно минуют артериолы, капилляры и венулы, то при гиперцитокинемии они задерживаются эндотелиоцитами венул. Дело в том, что гиперцитокинемия, повышая экспрессию адгезивных молекул на поверхности как эндотелиоцитов, так и нейтрофилов, вызывает адгезию полиморфонуклеаров к эндотелиальным клеткам второго типа, выстилающим стенку венул. Адгезия выступает начальным этапом патогенного воспаления, не имеющего защитного значения. До стабильной адгезии посредством одновременной экспрессии и соединения друг с другом адгезивных молекул эндотелиоцитов и полифорфноядерных лейкоцитов происходит роллинг (катание) нейтрофилов по поверхности эндотелия. Роллинг и адгезия - необходимые этапы трансформации нейтрофилов в клетки, осуществляющие воспаление и способные к экзо- фагоцитозу. Это те этапы воспаления, после реализации которых почти полностью развертывается последовательность причин и следствий, составляющих данную защитно-патогенную реакцию. Воспаление данного генеза имеет сугубо патологический характер, происходит во всех органах и тканях, повреждая элементы исполнительных аппаратов. Критическое падение числа структурно-функциональных элементов большинства органов-эффекторов составляет основное звено патогенеза так называемой множественной системной недостаточности. Адгезия приводит к обтурации венул, что повышает гидростатическое давление в капиллярах и массу ультрафильтрата, поступающую в интерстиций. Согласно традиционным и верным представлениям сепсис и системную воспалительную реакцию вызывает патогенное действие грамотрицательных микроорганизмов (рис. 9.1). В индукции системной патологической реакции на инвазию во внутреннюю среду и кровь грамотрицательных микроорганизмов определяющую роль играют:
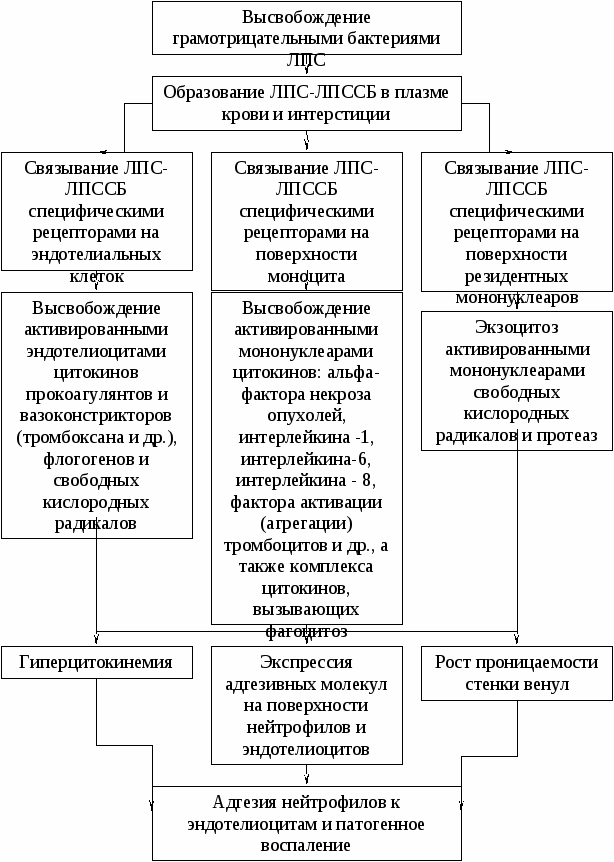 Рисунок 9.1. Индукция сепсиса и септического шока грамотрицательными бактериями В настоящее время растет частота сепсиса, обусловленного инвазией во внутреннюю среду грамположительных бактерий. Индуцирование сепсиса грамположительными бактериями обычно не связано с высвобождением ими эндотоксина. Известно, что предшественники пептидогликана и другие компоненты стенок грамположительных бактерий вызывают высвобождение клетками систем иммунитета фактора некроза опухолей-альфа и интерлейкина-1. Пептидогликан и другие компоненты стенок грамположительных бактерий активируют систему комплемента по альтернативному пути. Активация системы комплемента на уровне всего организма вызывает системное патогенное воспаление и вносит свой вклад в эндотоксикоз при сепсисе и системной воспалительной реакции. Большинство из опытных клиницистов с легкостью распознают состояние септического шока (СШ). Если тех же врачей-исследователей попросить дать определение данного патологического состояния, то будет дано множество разных дефиниций, во многом противоречащих друг другу. Дело в том, что патогенез септического шока остается во многом неясным. Несмотря на многочисленные исследования патогенеза септического шока, антибиотики остаются средствами, действие которых составляет главный этиопатогенетический элемент терапии при СШ. При этом летальность среди пациентов в септическом шоке составляет 40-60%. Исследования, направленные на ослабление действия некоторых из медиаторов септического шока, не привели к разработке эффективной терапии. В настоящее время остается неясным, должна ли система терапии быть ориентированной на блокаду действия какого-либо одного из ведущих звеньев патогенеза септического шока, или у каждого из пациентов лечение должно быть строго индивидуализированным. Септический шок – это совокупность расстройств функциональных систем, при которых артериальная гипотензия и недостаточная объемная скорость тока крови на периферии не подвергаются обратному развитию под действием внутривенных инфузий тех или иных плазмозамещающих средств. Это результат не ограниченного системной регуляцией действия некоторых из механизмов врожденных иммунных реакций. Врожденные иммунные реакции обладают собственными бактерицидными эффектами, а также готовят и вызывают приобретенные клеточные и гуморальные иммунные реакции. Реакции врожденного иммунитета во многом вызываются взаимодействием лигандов патогенов с гуморальными и клеточными рецепторами организма. Одни из таких рецепторов – это TL - рецепторы (англ. toll-like, со свойствами барьера, «набата», «передового охранения»). В настоящее время уже известно шесть разновидностей TL - рецепторов млекопитающих. Соединение лиганда бактериального происхождения с TL – рецептором запускает комплекс клеточных реакций. В результате этих реакций оказывается бактерицидное действие, индуцируется воспаление и происходит подготовка к специфической иммунной реакции. При избыточности комплексной реакции систем врожденного иммунитета возникает септический шок. Существует несколько уровней, на которых представляется возможным заблокировать патологическую реакцию систем врожденного иммунитета, вызывающую септический шок. Первый из них – это уровень взаимодействия экзогенных бактериальных лиганд с гуморальными и клеточными рецепторами систем врожденного иммунитета. Ранее считалось, что септический шок всегда вызывается эндотоксином (липополисахаридом бактериального происхождения), который высвобождается грамотрицательными бактериями (рис. 9. 1). Теперь общепризнанным является тот факт, что менее, чем в 50% случаев септический шок вызывается грамположительными Возбудителями. Грамположительные патогены, высвобождают компоненты своей стенки, аналогичные по структуре эндотоксину. Эти компоненты способны вызывать септический шок, вступая во взаимодействие с клеточными рецепторами (рецепторами наружной поверхности мононуклеарных фагоцитов). Следует заметить, что при обследовании больного весьма трудно определить механизм индукции септического шока. Возникновение септического шока своим необходимым условием имеет гиперцитокинемию, то есть рост концентрации в циркулирующей крови первичных провоспалительных цитокинов. В этой связи были предложены различные способы блокады действия первичных провоспалительных цитокинов (моноклональные антитела к фактору некроза опухолей альфа и др.), которые не снизили летальности при септическом шоке. Дело в том, что воздействие оказывалось лишь на один элемент иммунопатологической реакции. Избрать мишенью терапии один противоспалительный цитокин, – это означает влиять лишь на одно из многих одновременных и одинаковых по значению звеньев патогенеза септического шока. Итак, можно считать, что в настоящее время известен ряд в эволюционном отношении древних лигандов, принадлежащих грамотрицательным и грамположительным бактериям, а также микобактериям и грибковым возбудителям. Данные экзогенные лиганды способны взаимодействовать с небольшим числом гуморальных и клеточных рецепторов, вызывая сепсис и септический шок. В этой связи нельзя исключить, что в будущем патологическую реакцию систем врожденного иммунитета можно будет оптимально блокировать, воздействуя на гуморальные и клеточные рецепторы лиганд бактерий, ответственных за возникновение септического шока. Для распознавания своих лиганд TL – рецепторам необходимы вспомогательные молекулы. Очевидно, что предстоит еще выявить тот гуморальный рецептор (плазменный белок), который связывается с элементами наружной мембраны грамположительных бактерий. Прежде чем молекулярный комплекс компонента бактериальной стенки и гуморального рецептора свяжется с TL-рецептором, он соединяется с CD14. В результате TL-рецептор активируется, то есть начинается передача сигнала генам клетки о начале экспрессии первичных провоспалительных цитокинов и бактерицидных агентов. Существует принципиальная возможность предотвратить индукцию септического шока воздействием на CD14. Кроме того, представляется теоретически возможным блокировать патогенез септического шока в зародыше, блокируя TL-рецепторы, а также передачу генерируемого ими сигнала на пострецепторном внутриклеточном уровне. Этиология и патогенез сепсиса и септического шока Септический шок - это наиболее частая причина летальных исходов в хирургических стационарах и отделениях интенсивной терапии. Термины “сепсис”, “тяжелый сепсис”, “септический шок” соответствуют разным степеням тяжести патологической реакции организма и системы иммунитета на инфекцию. В основном сепсис как синдром характеризуют признаки инфекции и воспаления. При тяжелом сепсисе в различных органах падает объемная скорость тока крови, что вызывает сочетанные расстройства функциональных систем (множественную системную недостаточность). Возникновение септического шока знаменует устойчивая артериальная гипотензия. Смертность при сепсисе - 16 %, а при септическом шоке – 40-60 %. Бактериальная инфекция - это наиболее частая причина септического шока. При сепсисе первичные очаги инфекции чаще локализованы в легких, органах живота, брюшине, а также в мочевыводящих путях. Бактериемию выявляют у 40-60 % больных в состоянии септического шока. У 10–30 % больных в состоянии септического шока невозможно выделить культуру бактерий, действие которых вызывает септический шок. Можно предположить, что септический шок без бактериемии – это результат патологической иммунной реакции в ответ на стимуляцию антигенами бактериального происхождения. По-видимому, данная реакция сохраняется после элиминации из организма патогенных бактерий действием антибиотиков и других элементов терапии, то есть происходит ее эндогенизация. В основе эндогенизации сепсиса могут лежать многочисленные, усиливающие друг друга и реализуемые через выброс и действие цитокинов взаимодействия клеток и молекул систем врожденного иммунитета, и, соответственно, иммунокомпетентных клеток. Раньше тяжелый сепсис и септический шок связывали исключительно с грамотрицательными аэробными бациллами. В настоящее время частота грамположительной инфекции как причины сепсиса равна частоте сепсиса, обусловленного инвазией во внутреннюю среду грамотрицательных микроорганизмов. Это произошло из-за широкого использования внутрисосудистых катетеров, других устройств, так или иначе находящихся во внутренней среде, а также из-за роста частоты пневмоний. Грибковые, вирусные и протозойные инфекции также могут быть причинами септического шока. Системная воспалительная реакция индуцируется высвобождением из очага воспаления самих патогенных бактерий, их токсинов, а также цитокинов со свойствами медиаторов воспаления. В наибольшей степени как индуктор системной воспалительной реакции изучен эндотоксин грамотрицательных аэробных бацилл. Кроме того, известны другие бактериальные продукты (токсины), которые могут вызвать массивный выброс клетками систем врожденного иммунитета медиаторов воспаления. К таким бактериальным продуктам относят формиловые пептиды, экзотоксины, энтеротоксины, гемолизины-протеогликаны, а также липотейхоевую кислоту, которую образуют грамположительные микроорганизмы. Бактериальные токсины стимулируют высвобождение мононуклеарными фагоцитами цитокинов со свойствами медиаторов воспаления, которые сначала вызывают, а затем усиливают системную воспалительную реакцию. Токсины связываются со своими клеточными рецепторами, активируя регуляторные белки. В частности, таким образом, активируется транскрипционный фактор NF-кВ. В активированном состоянии NF-кВ усиливает экспрессию генов цитокинов со свойствами медиаторов воспаления. Активация NF-кВ прежде всего повышает образование мононуклеарными фагоцитами фактора некроза опухолей-альфа и интерлейкина-1. Данные цитокины называют первичными провоспалительными. Фактор некроза опухолей-альфа и интерлейкин-1 стимулируют высвобождение мононуклеарными фагоцитами, а также иммунокомпетентными клетками интерлейкинов 6 и 8 и других медиаторов воспалительной реакции: тромбоксанов, лейкотриенов, фактора активации тромбоцитов, простагландинов и активированных фракций системы комплемента. Полагают, что оксид азота служит главным медиатором системного расширения сосудов, падения общего периферического сосудистого сопротивления и артериальной гипотензии у больных в состоянии септического шока. Индуцируемая (индуцибельная) форма синтетазы оксида азота экспрессируется и высвобождается эндотелиальными и другими клетками только при определенных условиях. К одному из таких условий относится действие на эндотелиоциты первичных провоспалительных цитокинов. Вызывая экспрессию индуцируемой формы синтетазы в эндотелиальных, гладкомышечных клетках сосудистой стенки и мононуклеарных фагоцитах, первичные провоспалительные цитокины повышают высвобождение оксида азота на системном уровне. Усиление действия оксида азота на системном уровне снижает общее периферическое сосудистое сопротивление и вызывает артериальную гипотензию. При этом оксид азота служит субстратом образования пероксинитрита, то есть продукта реакции NO со свободными кислородными радикалами, который обладает прямым цитотоксическим действием. Этим не исчерпывается роль оксида азота в патогенезе септического шока. Он оказывает отрицательное инотропное действие на сердце и повышает проницаемость стенки микрососудов. Угнетение сократимости сердца при септическом шоке происходит также вследствие отрицательного инотропного действия фактора некроза опухолей-альфа. Действие фактора некроза опухолей-альфа вызывает отек митохондрий и повреждает митохондриальные цепи дыхательных ферментов. В результате в клетке возникает дефицит свободной энергии, и наступает клеточная гибель, обусловленная гипоэргозом. Известно, что митохондрии - это главный источник свободных кислородных радикалов, высвобождаемых в цитозоль клетки. Действие марганцевой супероксиддисмутазы инактивирует О2-, который высвобождается цепью дыхательных ферментов. При этом антиоксидант предотвращает апоптоз, который вызывается фактором некроза опухолей-альфа. Это заставляет считать механизм апоптоза под действием фактора некроза опухолей-альфа связанным с высвобождением митохондриями свободных кислородных радикалов. Образование свободных кислородных радикалов митохондриями растет под действием фактора некроза опухолей-альфа. При этом свободные кислородные радикалы, высвобождаемые митохондриями, повреждают цепи их дыхательных ферментов. Определенная активность цепей дыхательных ферментов митохондрий - необходимое условие апоптотического действия фактора некроза опухолей-альфа. В эксперименте было показано, что угнетение тканевого дыхания в митохондриях вызывает резистентность клетки по отношению к апоптотическому действию фактора некроза опухолей-альфа. Можно предположить, что клетки с особо высоким содержанием митохондрий и повышенной активностью цепей дыхательных ферментов обладают особо выраженной чувствительностью к действию фактора некроза опухолей-альфа, повреждающему цепи дыхательных ферментов митохондрий и вызывающему гипоэргоз клетки. Такими клетками являются кардиомиоциты. Поэтому действие фактора является особо выраженным на уровне миокарда, сократимость которого падает при шоке. При этом системное повреждающее действие фактора некроза опухолей-альфа на митохондрии может лежать в основе тканевой гипоксии при септическом шоке. В ответ на действие флогогенов, высвобождаемых при септическом шоке, растет экспрессия адгезивных молекул на поверхности эндотелиоцитов и нейтрофилов. В частности, на поверхности нейтрофилов появляется интегриновый комплекс (CD11/CD18), что происходит одновременно с появлением на поверхности эндотелиальной клетки межклеточных адгезивных молекул комплементарных по отношению к интегриновому комплексу. Экспрессия на поверхности нейтрофилов интегринового комплекса - это одно из следствий активации данных клеток. Расстройства периферического кровообращения при септическом шоке, адгезия активированных полиморфоядерных лейкоцитов к активированным эндотелиоцитам - все это ведет к выходу нейтрофилов в интерстиций и воспалительной альтерации клеток и тканей. Одновременно эндотоксин, фактор некроза опухолей-альфа, а также интерлейкин-1 повышают образование и высвобождение эндотелиальными клетками тканевого фактора свертывания. В результате активируются механизмы внешнего гемостаза, что вызывает отложение фибрина и диссеминированное внутрисосудистое свертывание. При септическом шоке рост экспрессии и высвобождения провоспалительных цитокинов вызывает патологическую реакцию выброса в интерстиций и кровь эндогенных иммунодепрессантов. Это обуславливает фазу иммунодепрессии септического шока. Индукторами иммунодепрессии при септическом шоке являются: 1) кортизол и эндогенные катехоламины; 2) интерлейкины 10 и 4; 3) простагландин Е2; 4) растворимые рецепторы фактора некроза опухолей; 5)эндогенный антагонист рецептора интерлейкина-1 и др. Растворимые рецепторы фактора связывают его в крови и межклеточных пространствах. При иммунодепрессии падает содержание антигенов тканевой совместимости второго типа на поверхности мононуклеарных фагоцитов. Без таких антигенов на своей поверхности мононуклеары не могут действовать в качестве антиген-презентирующих клеток. Одновременно угнетается нормальная реакция мононуклеаров на действие медиаторов воспаления. Все это может служить причиной нозокомиальных инфекций и смерти. Артериальная гипотензия при септическом шоке в основном представляет собой следствие снижения общего периферического сосудистого сопротивления. Гиперцитокинемия и рост концентрации в крови оксида азота при септическом шоке обуславливает расширение артериол. При этом посредством тахикардии компенсаторно растет минутный объем кровообращения. Артериальная гипотензия при септическом шоке возникает, несмотря на компенсаторный рост минутного объема кровообращения. Общее легочное сосудистое сопротивление при септическом шоке растет, что можно отчасти связать с адгезией активированных нейтрофилов к активированным эндотелиоцитам легочных микрососудов. При септическом шоке выявляют следующие признаки юкстакапиллярного шунтирования крови:
При септическом шоке расширены емкостные сосуды, что приводит к общей венозной гиперемии. Расширение артериол и вен выражено при септическом шоке по-разному в разных областях. Это определяет патологическую вариабельность пре- и посткапиллярных сосудистых сопротивлений. Патологическая вариабельность вызывает аномальное перераспределение минутного объема кровообращения и объема циркулирующей крови. Дилатация сосудов при септическом шоке наиболее выражена в очаге воспаления. Расширение сосудов при септическом шоке связано с ростом содержания в крови эндогенных вазодилататоров и снижением чувствительности альфа-адренорецепторов сосудистой стенки к эндогенным катехоламинам. Выделяют следующие основные звенья патогенеза расстройств периферического кровообращения при септическом шоке:
В эксперименте было показано, что общая площадь поперечного сечения капилляров у экспериментальных животных в состоянии септического шока снижается. Это следствие патогенных межклеточных взаимодействий с участием эндотелиальных клеток. Снижение общего просвета капилляров у больных в состоянии септического шока проявляется угнетением реактивной гиперемии. Реактивную гиперемию угнетают расстройства местной регуляции тока крови по микрососудам и падение способности клеток крови проходить по капиллярам. В частности такую способность снижает появление на поверхности нейтрофилов и моноцитов адгезивных молекул. Кроме того, данная способность падает вследствие снижения деформируемости нейтрофилов и эритроцитов. Известно, что при септическом шоке снижается активность конституционной (постоянно присущей клеточному фенотипу) синтетазы оксида азота. Действие конституционной синтетазы повышает ток крови на периферии. Падение активности данного фермента снижает ток крови на периферии, что угнетает реактивную гиперемию. У больных в состоянии септического шока выявляют отек эндотелиоцитов, депозиты фибрина в микрососудах и межклеточных пространствах, увеличение адгезивной способности нейтрофилов и эндотелиальных клеток, а также образование агрегатов из нейтрофилов, тромбоцитов и эритроцитов в венулах, артериолах и капиллярах. В некоторых случаях возникает открытие артериоло-венулярных анастомозов как причина юкстакапиллярного шунтирования. Гиповолемия – это один из факторов артериальной гипотензии при септическом шоке. Выделяют следующие причины гиповолемии (падения преднагрузки сердца) у больных в состоянии септического шока: 1)дилатация емкостных сосудов; 2)потеря жидкой части плазмы крови в интерстиций из-за патологического роста проницаемости капилляров. Падение преднагрузки сердца и общего периферического сосудистого сопротивления - это еще не все причины артериальной гипотензии при септическом шоке. Ее также обуславливает отрицательное действие на сердце медиаторов септического шока. И левый, и правый желудочки сердца при септическом шоке последовательно проходят стадии ригидности (недостаточности диастолической функции) и дилатации (недостаточности систолической функции). Ригидность и дилатация не связаны с падением тока крови по венечным артериям и ростом потребности кардиомиоцитов в кислороде. Насосную функцию сердца при септическом шоке угнетают фактор некроза опухолей-альфа, а также интерлейкин-1. Угнетение насосной функции сердца при септическом шоке отчасти связано с легочной артериальной гипертензией и падением чувствительности бета-адренорецепторов сердца. Можно считать, что у большинства больных в состоянии септического шока падение потребления кислорода организмом преимущественно обусловлено первичными нарушениями тканевого дыхания. При кардиогенном шоке лактатный метаболический ацидоз вызывается тяжелой циркуляторной гипоксией. При этом напряжение кислорода в смешанной венозной крови находится на уровне ниже 30 мм рт. ст. При септическом шоке умеренный лактатный ацидоз развивается при нормальном напряжении кислорода в смешанной венозной крови. Лактатный ацидоз при септическом шоке считают следствием снижения активности пируватдегидрогеназы и вторичной аккумуляции лактата, а не падения тока крови на периферии. В случае септического шока причины падения улавливания клеткой свободной энергии при аэробном биологическом окислении - это цитотоксические эффекты (прямые или опосредованные) эндотоксина, оксида азота, фактора некроза опухолей-альфа. Патогенез септического шока во многом складывается из расстройств биологического окисления и определяется гипоэргозом клетки как следствием тканевой гипоксии, развившейся под действием эндотоксемии. Расстройства периферического кровообращения при сепсисе носят системный характер и развиваются при артериальной нормотензии, которую поддерживает рост минутного объема кровообращения. Системные нарушения микроциркуляции проявляют себя снижением рН в слизистой оболочке желудка и падением насыщения кислородом гемоглобина крови в печеночных венах. Гипоэргоз клеток кишечного барьера, действие иммуносупрессивных звеньев патогенеза септического шока, - все это снижает защитный потенциал кишечной стенки, что служит еще одной из причин эндотоксемии при септическом шоке. Лечение при сепсисе, системной воспалительной реакции и септическом шоке Патогенетически обоснованная система терапии при сепсисе, системной воспалительной реакции и септическом шоке преследует следующие цели:
Бактериологическое исследование сыворотки артериальной крови, а также экссудатов, мокроты и др. – необходимое условие эффективности антимикробной терапии. До получения результатов бактериологического исследования и определения чувствительности клона возбудителей к определенному антибиотику, применяют сочетание антибиотиков широкого спектра. Антибиотики широкого спектра, которые применяют для лечения больных в состоянии сепсиса, должны действовать как на грамположительные, так и на грамотрицательные бактерии. Антимикробиальные средства вводят внутривенно и в максимальных дозах. Предпочтение следует отдавать бактерицидным препаратам, а не бактериостатическим. Зная локализацию очага первичной инфекции, можно с большой вероятностью предсказать, какие именно возбудители ответственны за развитие сепсиса и системной воспалительной реакции. Определив предположительного возбудителя, строят соответствующий режим антимикробиальной терапии с учетом возможной резистентности к эффектам антибиотиков. Например, при нейропении и пневмонии, вызванной грамотрицательными микроорганизмами, используют минимум два антибактериальных препарата. При энтерококковой инфекции также целесообразна комбинация двух препаратов. Анаэробная инфекция наиболее вероятна при интраабдоминальных инфекциях, аспирационной пневмонии, а также при асцессах. При инфекции, связанной с внутрисосудистыми катетерами, сепсис обычно вызывается клоном стафиллококков устойчивому к действию метициллинов. При таком генезе инфекции применяют ванкомицин или аналогичные препараты. У одной трети пациентов в состоянии сепсиса, особенно когда системная воспалительная реакция вызывает нейтропению, невозможно определить возбудителя. В таких случаях применяют комбинации антибиотиков широкого спектра и других антимикробиальных препаратов: а) ванкомицина, гентамицина и метронидазола; б) цефтазидина и гентамицина. У больных с нейтропенией, явным приобретенным иммунодефицитом и резистентностью к действию упомянутых комбинаций антибиотиков следует заподозрить микоинфекцию и использовать антифунгальный препарат амфотерицин B. Устранение артериальной гипоксемии (см. главу 4)(рациональное обогащение кислородом вдыхаемой газовой смеси, положительное давление в дыхательных путях при самостоятельном дыхании, контролируемая механическая вентиляция строго по показаниям, частая санация трахеобронхиального дерева, ПДКВ при искусственной вентиляции) – необходимое условие эффективности всей системы терапии больных в состоянии сепсиса, системной воспалительной реакции. При сепсисе активно предупреждают и устраняют вторичное воспаление легких (аэрозольные ингаляции с применением антибиотиков, массаж грудной клетки, парокислородные ингаляции, ингаляции фитонцидов через полузакрытый контур аппарата для ингаляционного наркоза при самостоятельном дыхании больного кислородновоздушной смесью, обязательное использование отхаркивающих средств и препаратов, разжижающих мокроту). Тем самым восстанавливают действенность легких как главного бактерицидного фильтра организма, а также инактиватора биоактивных веществ (цитокинов и др.). Патогенетически обоснованную интенсивную терапию расстройств системного кровообращения (см. главу 2) проводят таким образом, чтобы устранить дефицит объема внеклеточной жидкости, снизить вязкость циркулирующей крови, избежать гемической гипоксии и легочной артериальной гипертензии. У многих пациентов приходится использовать средства с положительным инотропным действием (допамин, добутамин и др.) и осуществлять непрерывный инвазивный мониторинг насосных функций сердца и системного кровообращения, для чего используют артериальный катетер и плавающий катетер Сван-Ганца. Для слежения за состоянием системного и периферического кровообращения у пациентов в состоянии сепсиса непрерывно определяют концентрацию в крови молочной кислоты, скорость мочеотделения. С учетом высокой потребности организма в усиленном транспорте кислорода минутный объем кровообращения посредством инфузий и действий инотропных средств удерживают на уровне выше 4 л х мин-1 х м2. Больному в состоянии септического шока при артериальной гипотензии внутривенно вливают 1-2 л кристаллоидных и коллоидных растворов. К гемотрансфузиям прибегают, когда концентрация гемоглобина в циркулирующей крови становится ниже 100 г/л. Раствор альбумина или аналогичный препарат (протеин) инфузируют, когда концентрация альбуминов в сыворотке крови находится на уровне ниже 20 г на 1 л Особое внимание при сепсисе уделяют смешанному (энтерально-парентеральному) искусственному питанию. При этом смеси для энтерального и парентерального питания должны в повышенном количестве содержать аминокислоты (глутамат и др.), которые становятся условно незаменимыми вследствие их усиленной утилизации для реализации барьерной функции стенок кишечника, а также для защитных и патогенных действий клеток иммунной системы. Несмотря на то, что экзогенные кортикостероиды тормозят образование и высвобождение первичных провоспалительных цитокинов, препараты глюкокортикоидов не снижают летальность при сепсисе. Нельзя исключить, что препараты на основе моноклональных тел к эндотоксину будут эффективными в лечении сепсиса, вызванного грамотрицательными микроорганизмами. Вполне допустимым предположением можно считать мнение, что средства на основе моноклональных антител к фактору некроза опухолей, рекомбинатные лиганды рецепторов первичных провоспалительных цитокинов, а также ингибиторы синтеза оксида азота могут быть эффективными в устранении расстройств системного кровообращения, обусловленных сепсисом. |
