Глава 26
Антибактериальные, противогрибковые, противовирусные средства
В стоматологической практике АМП по частоте применения уступают только обезболивающим средствам. Амбулаторно стоматолог проводит лечение пациентов с локализованными формами одонтогенной и пародонтальной инфекции, в условиях стационара оказывается помощь при распространенных формах инфекций и их осложнениях. Решающим в терапии этих заболеваний являются стоматологические манипуляции и хирургическое пособие.
АМП в стоматологии назначают и с профилактической целью, например, для профилактики инфекционного эндокардита при выполнении некоторых стоматологических манипуляций у пациентов с заболеваниями клапанного аппарата сердца, сосудистом шунтировании и др.
Наряду с этим могут быть изменения в полости рта (например, стоматит) как проявление осложнений антимикробной терапии. Неоправданное и неадекватное использование АМП может значительно повлиять на резистентность микрофлоры в различных локусах организма, привести к снижению эффективности терапии других заболеваний.
Общие особенности антимикробных препаратов
АМП – это ЛС,избирательно угнетающие жизнедеятельность микроорганизмов. Под избирательностью понимается: (1) активность только в отношении возбудителей инфекции, при сохранении жизнеспособности клеток хозяина, и (2) действие на определенные роды и виды микроорганизмов. Они подразделяются на антибактериальные, противовирусные и противогрибковые.
Все АМП объединяет ряд уникальных свойств:
мишень (рецептор) АМП находится не в тканях человека, а в микроорганизме;
активность АМП может снижаться со временем, что обусловлено развитием лекарственной устойчивости (резистентности).
Резистентные возбудители представляют опасность не только для пациента, от которого они были выделены, но и для других людей. Борьба с резистентностью является глобальной задачей.
АМП делятся на природные (собственно антибиотики: пенициллин), полусинтетические (модификация природных молекул: амоксициллин, цефазолин) и синтетические (сульфаниламиды, нитрофураны). Сегодня такая систематизация утратила актуальность, так как ряд природных АМП получают путем синтеза (хлорамфеникол), а некоторые антибиотики (фторхинолоны), являются синтетическими соединениями.
АМП подразделяются на отдельные группы и классы. Неверно рассматривать все препараты, входящие в один класс или поколение, как взаимозаменяемые. Так, среди цефалоспоринов III поколения, клинически значимой активностью в отношении синегнойной палочки обладают только цефтазидим и цефоперазон, а из фторхинолонов лучше всего на нее действует ципрофлоксацин.
На протяжении многих лет АМП классифицировались по широте спектра своей антимикробной активности. С позиций сегодняшнего дня деление на препараты широкого и узкого спектра действия является условным. При оценке спектра активности необходимо учитывать приобретенную антибиотикорезистентность. Например, тетрациклины, которые изначально были активны в отношении большинства клинически значимых микроорганизмов, «потеряли» значительную часть своего спектра активности из-за развития резистентности у пневмококков, стафилококков, энтеробактерий и др. Цефалоспорины III поколения обычно рассматриваются как препараты с широким спектром активности. Однако они не действуют на метициллинорезистентные стафилококки, энтерококки, многие анаэробы, хламидии, микоплазмы.
Выделяют следующие основные механизмы резистентности бактерий к АМП (рис. 26.1):
изменение мишени действия антибиотиков;
ферментативная инактивация антибиотика;
активное выведение антибиотика из микробной клетки (эффлюкс);
нарушение проницаемости микробной клетки для антибиотика;
формирование метаболических «шунтов».
Р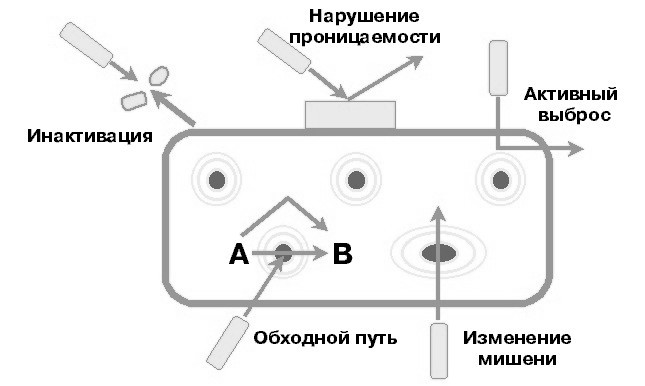
ис. 26.1. Механизмы резистентности к антибактериальным препаратам.
Механизмы резистентности можно наблюдать на примере различных групп антибиотиков:
изменение мишени действия макролидов и линкозамидов вследствие метилирования на рибосомах (этот механизм обеспечивает развитие устойчивости стрептококков);
выработка -лактамаз – ферменты, разрушающие -лактамные антибиотики. При этом наиболее опасны -лактамазы расширенного спектра (БЛРС), которые чаще наблюдаются у бактерий из рода KlebsiellaиE. coli. Они способны разрушать пенициллины и цефалоспорины всех поколений;
транспортные системы для выведения антибиотика из микробной клетки (эффлюкс) у P.aeruginosaобеспечивают снижение ее чувствительности к карбапенемам;
снижение проницаемости микробной клетки ведет к формированию устойчивости одновременно к нескольким группам антибиотиков;
появление у бактерий фермента дигидрофолатредуктазы, нечувствительного к ингибированию триметопримом, который входит в состав ко-тримоксазола, препятствуют блоку синтеза фолиевой кислоты и обусловливает резистентность бактерий и к ко-тримоксазолу.
Резистентность к антибиотикам не носит универсальный характер и зависит от места возникновения инфекции (дом, стационар), типа стационара (чаще в отделении реанимации и интенсивной терапии, гнойной хирургии), предшествующего приема антибиотиков и пр.
Планирование применения антибиотиков должно опираться на глобальные данные, региональные и локальные данные о резистентности. Например, в стационарах РоссииS. aureus часто характеризуются высокой метициллинорезистентностью (до 40%). Также отмечено распространение полирезистентной, то есть с приобретенной устойчивостью как минимум к трем антибиотикам, P. aeruginosa.
Фармакодинамика АМП
Фармакодинамика АМП характеризует действие на микроорганизм, представляющий мишень для АМП. Это отличает АМП от других ЛС, действующих на специфические рецепторы человеческого организма. Эффект зависит от спектра и степени активности АМП в отношении того или иного вида микроорганизмов. Количественным выражением активности АМП является его минимальная подавляющая концентрация (МПК): чем она меньше, тем более активен АМП.
В последние годы трактовка фармакодинамики АМП расширилась. Она предполагает взаимоотношение между концентрациями препарата в организме и его антимикробной активностью, а также между временем поддержания концентрации препарата и его активностью, поэтому выделяют две группы антибиотиков: (1) с дозо-зависимой и (2) время-зависимой антимикробной активностью.
Для первой группы (аминогликозиды, фторхинолоны), степень гибели бактерий прямо коррелирует с концентрацией антибиотика в сыворотке крови, поэтому целью режима дозирования является достижение максимально переносимой концентрации препарата.
Для второй группы, например, -лактамов, важным является длительное поддержание концентрации на относительно невысоком уровне (в 4–5 раз выше МПК). Повышение концентрации не влияет на эффективность терапии. Режимы дозирования должны быть направлены на поддержание в сыворотке крови и очаге инфекции концентрации, в 4-5 раз превышающей МПК. Достаточно, чтобы она сохранялась в течение 40–60% временного интервала между введениями.
По типу действия выделяют АМП, вызывающие гибель микроорганизма - бактерицидное фунгицидное, вирицидное действие и приостанавливающие размножение микроорганизма – бактериостатическое, фунгистатическое, виристатическое действие. Одни и те же АМП могут обладать и «цидным», и «статическим» действием. Это определяется видом микроорганизма, концентрацией АМП и длительностью экспозиции. Так, ванкомицин в отношении стрептококков оказывает бактериостатическое действие, а в отношении стафилококков — бактерицидное.
Тип действия имеет значение при выборе АМП в различных клинических ситуациях. Бактерицидные АМП являются препаратами выбора при тяжелых инфекциях или у пациентов с нарушениями иммунитета: сепсис, менингит, эндокардит, тяжелые инфекции головы и шеи и др.
Фармакокинетика АМП
Из фармакокинетических характеристик АМП наиболее важными являются способность проникать в очаг инфекции и создавать в нем концентрации, достаточные для «цидного» или «статического» действия. Поэтому антимикробная активность препарата in vitro, отображением которой является величина МПК, является только ориентиром для обеспечения клинической и микробиологической эффективности.
Для АМП, которые принимаются внутрь, важнейшее значение имеет такой параметр как биодоступность (F), т.е способность проникать в системный кровоток. Например, предпочтение при приеме внутрь отдается амоксициллину (биодоступность 75-80%), нежели ампициллину (40%). Биодоступность не является неизменным параметром и, создавая современные лекарственные формы ее удается повысить. Например, если амоксициллин в таблетках или капсулах имеет биодоступность около 75–80%, то у специальной растворимой формы (Флемоксин солютаб) она превышает 90%.
Период полувыведения (T1/2) влияет на кратность введения АМП. Учитывая, что большинство АМП выводится почками, у пациентов определяют креатинин сыворотки крови и рассчитывать его клиренс (КК) по формуле Кокрофта–Голта (Cockroft, Gault, 1976) у взрослых, и по формуле Шварца (Schwarz,1987) у детей.
КК (мл/мин) =
|
(140-возраст) х идеальная масса тела (кг)
|
0,8 х креатинин сыворотки крови (мкмоль/л)
|
Для женщин = 0,85 х КК для мужчин
Нежелательные лекарственные реакции АМП
Основной особенностью НЛР антибиотиков является действие на нормальную микрофлору человека. В большинстве случаев изменения микрофлоры клинически не проявляются и не требуют коррекции. Однако в некоторых случаях может развиваться антибиотико-ассоциированная диарея, оральный или вагинальный кандидоз, что требует лечения, основанного, прежде всего, на клинической картине.
Следует отметить, что широко распространенное мнение о способности этих препаратов угнетать иммунитет является серьезным заблуждением. Все АМП, способные вызвать иммуносупрессию у человека, отсеиваются еще на стадии доклинических исследований. Более того, ряд антибиотиков способны стимулировать определенные звенья иммунной реакции, например, (макролиды, линкозамиды, фторхинолоны).
Аллергические реакции на антибиотики принципиально не отличаются от аллергических реакций на другие ЛС. Следует помнить о трех основных моментах:
Риск аллергии на антибиотики существенно преувеличивается. Не существует «аллергии на все антибиотики», так как это препараты с разным химическим строением. Аллергия может быть на препараты, входящие в определенный класс, например, -лактамы (пенициллины, цефалоспорины и др.). Поэтому абсолютно неверным является диагноз: «Аллергия на антибиотики».
Наиболее часто аллергические реакции встречаются на -лактамы, особенно пенициллины. Важнейшим средством профилактики является: (а) сбор анамнеза; (б) проведение кожных аллергических проб для выявления сенсибилизации; (в) проведение провокационных проб (при невозможности использовать другой антибиотик, проводятся специалистом).
Антигистаминные препараты не предотвращают развитие сенсибилизации к АМП, поэтому их не следует назначать вместе с антибиотиками.
Таким образом, между АМП одного класса или химической группы есть определенные сходства. При их назначении следует учитывать особенности каждого АМП, а также результаты, полученные в контролируемых клинических испытаниях.
|
 Скачать 2.43 Mb.
Скачать 2.43 Mb.
