Учебник Г. Е. Рудзитиса, Ф. Г. Фельдмана Химия, 8
 Скачать 3.78 Mb. Скачать 3.78 Mb.
|
|
Цель урока. Познакомить учащихся с символами и названиями некоторых химических элементов. Сформировать понятие об относительной атомной массе. Показать различие между понятиями «масса атома» и «относительная атомная масса». Научить находить значение относительной атомной массы. Основные понятия. Химический знак, атомная единица массы, относительная атомная масса. Планируемые результаты обучения. Знать химические знаки некоторых химических элементов. Понимать различия между абсолютной и относительной массами. Уметь находить значение относительной атомной массы. Краткое содержание урока. После проверки домашнего задания учитель переходит к рассмотрению символов химических элементов. Во время краткого рассказа об истории создания химической символики учитель обращает внимание на то, что каждый элемент имеет свой символ, понятный ученым любой страны. Эти символы одни и те же во всем мире. Не нужно запоминать химические знаки всех существующих элементов, для этого в химическом кабинете есть периодическая таблица химических элементов Д. И. Менделеева. Однако рекомендуется помнить некоторые из них. Учитель знакомит учащихся с химическими знаками 17 наиболее часто упоминаемых элементов (водород, кислород, азот, углерод, натрий, калий, магний, кальций, алюминий, марганец, железо, медь, цинк, серебро, сера, фосфор, хлор). Методика заучивания химической символики приводится во многих пособиях. Лучше это делать в игровой форме с помощью самодельных карточек. При изучении относительной атомной массы химического элемента учащимся необходимо объяснить, что атомы, как всякие частицы вещества, имеют массу, но очень маленькую. Учитель приводит примеры: масса самого легкого атома — атома водорода — равна 1,67375 · 10–24 г, масса атома кислорода — 2,656812 · 10–23 г, масса атома углерода — 1,9927 · 10–23 г. Можно привести такой пример: число атомов водорода в 1 см3 при температуре 0 °С и давлении 1 атм так велико, что если мы будем считать их со скоростью два атома в секунду, то, чтобы пересчитать все, понадобится около 900 миллиардов лет. Далее учитель разъясняет, что массы атомов, выраженные в граммах, настолько малы, что пользоваться ими неудобно. Учитель ставит проблемный вопрос: в каких единицах массы выражают массу атомов химических элементов? Здесь учитель привлекает опорные знания межпредметного характера и подводит учащихся к введению новой единицы измерения массы атома — атомной единицы массы (а. е. м.), которая равна 1/12 массы атома углерода, т. е. 1,66 · 10–24 г. Затем показывает, как вычислить в атомных единицах массы массу нескольких химических элементов. После этого учитель рассказывает о работах Дж. Дальтона, который составил первую таблицу относительных атомных масс элементов, сообщает, что на практике пользуются относительной атомной массой элементов — безразмерной величиной, округленной до целых чисел (исключение — хлор; Ar(Cl) = 35,5). В заключение учитель формирует у учащихся умение находить значение относительных атомных масс элементов в периодической таблице химических элементов. Домашнее задание. § 7, упр. 16, 17 (с. 25), § 8, упр. 18, 19 (с. 25). УРОК 9 Закон постоянства состава веществ Цель урока. Сформировать понятие о постоянстве состава веществ. Показать, что постоянный состав характерен только для веществ, имеющих молекулярное строение. Основные понятия. Вещества молекулярного и немолекулярного строения, закон постоянства состава веществ. Планируемые результаты обучения. Знать формулировку закона постоянства состава веществ. Уметь производить расчеты на основе закона постоянства состава веществ. Демонстрации. Синтез воды в эвдиометре. Краткое содержание урока. В начале урока проводится диктант с целью проверки знания символов (знаков) химических элементов. Для этого учитель сначала диктует названия семи-восьми химических элементов (учащиеся записывают на листочках символы элементов), затем пишет на доске символы семи-восьми элементов (учащиеся записывают названия элементов). На последующих пяти-шести уроках также полезно проводить диктанты. Изучение закона постоянства состава веществ следует начать с повторения. Учащиеся должны вспомнить, чем отличаются смеси от химических соединений по составу и свойствам (табл. 1, с. 19 учебника). Учитель напоминает о проводимом ранее опыте разложения воды электрическим током и выясняет с учащимися, что водород и кислород, образуя воду, вступают в реакцию в соотношении 2 : 1 (по объему) или в соотношении 1 : 8 (по массе). 2Ar(H) : Ar(O) = 2 · 1 : 1 · 16 = 1: 8 Затем можно продемонстрировать взаимодействие водорода и кислорода (синтез воды в эвдиометре) и убедиться, что водород и кислород вступают в реакцию в соотношении 2 : 1 (по объему). Если это соотношение не соблюдается, то одно из веществ остается в избытке. Если взять 3 г водорода и смешать с 8 г кислорода, то химическая реакция произойдет, образуется вода, но 2 г водорода останется, не вступит в реакцию. Затем учитель переходит к формулировке закона постоянства состава и уточняет, что этот закон справедлив только по отношению к веществам, имеющим молекулярное строение. Далее учитель показывает, как производить расчеты на основе закона постоянства состава (с. 27 учебника). Домашнее задание. § 9, упр. 1—3 (с. 31). УРОК 10 Химические формулы. Относительная молекулярная масса Цель урока. Сформировать понятия о химической формуле, качественном и количественном составе вещества, индексе, коэффициенте, относительной молекулярной массе. Основные понятия. Химическая формула, качественный и количественный состав вещества, индекс, коэффициент, относительная молекулярная масса. Планируемые результаты обучения. Знать определение понятия «химическая формула» и что обозначает индекс в химической формуле. Уметь вычислять относительную молекулярную массу, характеризовать по данной формуле качественный и количественный состав вещества. Краткое содержание урока. В начале урока либо проводится диктант для проверки знания знаков химических элементов, либо вызываются к доске ученики, которые выполняют задания по карточкам (записывают или знак элемента, или его название). При изучении нового материала необходимо пояснить учащимся, какое значение имеет закон постоянства состава веществ для выведения химических формул. Рассматриваются конкретные примеры. Учитель подчеркивает, что при составлении химической формулы простого вещества вначале записывают знак химического элемента, входящего в состав данного вещества, затем внизу справа от знака записывают цифру, обозначающую число атомов данного химического элемента в молекуле. Эту цифру называют индексом. Например, молекулы кислорода, водорода, хлора, азота состоят из двух атомов; их формулы выглядят так: O2, Н2, Cl2, N2. Если вещество сложное, т. е. его молекула состоит из нескольких химических элементов, то при составлении формулы следует записать знаки химических элементов, составляющих данное вещество и определяющих качественный состав, а внизу справа от знаков — индексы, показывающие, сколько атомов данного элемента входит в молекулу (количественный состав). Например, СО, CO2, N2O5, NO2. Учащимся необходимо упражняться в чтении химических формул: СО — цэ-о; СO2 — цэ-о-два; N2O5 — эн-два-о-пять; NO2 — эн-о-два. Если молекул несколько, то перед формулой ставится число (коэффициент). Например, 5N2O5 — это пять молекул оксида азота(V). Читается это так: пять эн-два-о-пять. Закрепляя представление о веществах молекулярного и немолекулярного строения, нужно отметить особый смысл индекса. В формулах веществ молекулярного строения индекс показывает, сколько атомов химического элемента входит в состав каждой молекулы, а в формулах веществ немолекулярного строения индексы выражают соотношение чисел атомов каждого из элементов в соединении. Например, формула Н2O показывает, что каждая молекула воды состоит из двух атомов водорода и одного атома кислорода. Формула АlСl3 показывает, что в хлориде алюминия на каждый атом алюминия приходится три атома хлора. Необходимо добиваться того, чтобы учащиеся усвоили, что индексы характеризуют постоянство состава каждого вещества и поэтому их нельзя изменять произвольно. Учитель должен подвести учащихся к выводу, что химическая формула выражает состав определенного вещества, взятого в чистом виде. Далее необходимо поупражняться в написании химических формул. К доске вызываются ученики, которым можно предложить следующие задания: 1. Напишите химические формулы веществ: а) кислорода, если молекула кислорода состоит из двух атомов кислорода; б) озона, если молекула озона состоит из трех атомов кислорода; в) сероводорода, если молекула сероводорода состоит из двух атомов водорода и одного атома серы; г) серной кислоты, если молекула серной кислоты состоит из двух атомов водорода, одного атома серы и четырех атомов кислорода; д) фторида кальция, если во фториде кальция на каждый атом кальция приходится два атома фтора. 2. Что означает следующая запись? а) 4Н; 7Fe; Н2; 4Н2 б) NaCl; AlBr3; FeS Далее учитель переходит к рассмотрению относительной молекулярной массы вещества, на конкретных примерах показывает, как ее рассчитывают. В заключение учащиеся самостоятельно выясняют, какую информацию о веществе можно получить по его химической формуле, используя материал учебника (с. 29). Домашнее задание. § 10 (примеры задач 1, 2), упр. 4—9, 11, 12 (с. 32). УРОК 11 Массовая доля химического элемента Цель урока. Научить вычислять массовую долю элементов по формулам сложных веществ и устанавливать химическую формулу сложного вещества по известным массовым долям химических элементов. Основные понятия. Относительная атомная и молекулярная массы, массовая доля химического элемента. Планируемые результаты обучения. Уметь рассчитывать массовую долю элемента в соединении по его формуле и устанавливать химическую формулу сложного вещества по известным массовым долям химических элементов. Краткое содержание урока. В начале урока можно провести проверочную работу в тестовой форме. Вариант I 1. Среди перечисленных химических знаков отметьте знак кальция. 1) K 2) Са 3) С 4) Mg 2. Установите соответствие между химическим знаком элемента и его названием.
3. Что обозначает запись 2O2? 1) четыре атома кислорода 2) два атома кислорода 3) две молекулы кислорода 4) четыре молекулы кислорода 4. Из перечисленных формул выберите формулу, обозначающую вещество, молекула которого состоит из четырех атомов. 1) Н2O2 2) С2Н4 3) Na2CO3 4) СН2СlСООН 5. Какое утверждение правильно отражает состав молекулы углекислого газа СO2? Молекула углекислого газа состоит 1) из молекулы углерода и молекулы кислорода 2) из атома углерода и двухатомной молекулы кислорода 3) из атома углерода и двух атомов кислорода 4) из молекулы углерода и двух атомов кислорода 6. Относительная молекулярная масса оксида железа(III) Fe2O3 равна 1) 320 2) 160 3) 480 4) 62 7. В каком массовом отношении находятся медь и кислород в соединении, формула которого CuO? 1) 2 : 1 2) 4 : 1 3) 1 : 1 4) 1 : 4 8. Водород соединяется с серой в массовом отношении 1 : 16. Используя данные об относительных атомных массах этих элементов, выведите химическую формулу получившегося вещества. Вариант II 1. Среди перечисленных химических знаков отметьте знак серы. 1) Сl 2) С 3) S 4) Р 2. Установите соответствие между химическим знаком элемента и его названием.
3. Какая запись обозначает, что молекула азота состоит из двух атомов? 1) 2N 2) N2 3) N2O 4) N2O3 4. Из перечисленных формул выберите формулу, обозначающую вещество, молекула которого состоит из атомов трех химических элементов. 1) K2O 2) C2H4 3) MgOHCl 4) CH3COOH 5. Какое утверждение правильно отражает состав молекулы оксида азота(IV) NO2? Молекула оксида азота(IV) состоит 1) из атомов азота и молекулы кислорода 2) из молекулы азота и молекулы кислорода 3) из атомов азота и двух атомов кислорода 4) из молекулы азота и двух атомов кислорода 6. Относительная молекулярная масса глюкозы C6H12O6 равна 1) 360 2) 90 3) 180 4) 540 7. В каком массовом отношении находятся сера и кислород в соединении, формула которого SO2? 1) 2 : 1 2) 1 : 1 3) 1 : 2 4) 1 : 4 8. Используя сведения об относительных атомных массах химических элементов, составьте химическую формулу вещества, если известно, что массовое отношение в нем меди, серы и кислорода 2 : 1 : 2. После проведения проверочной работы учитель переходит к изучению нового материала. Нахождение массовой доли элемента в сложном веществе можно осуществить двумя путями: либо как это показано в учебнике (с. 30), либо через относительную атомную и молекулярную массы: Учителю необходимо объяснить понятие доли как части целого, ввести два способа выражения долей — в долях единицы и процентах. Вывод химических формул сложного вещества по известным массовым долям химических элементов подробно рассмотрен в учебнике (с. 31). Домашнее задание: § 10, упр. 10 (с. 32). УРОКИ 12—13 Валентность химических элементов. Составление химических формул по валентности Цель урока. Сформировать понятие о валентности как о свойстве атомов одного элемента присоединять или замещать определенное число атомов другого элемента. Научить определять валентность элементов по формулам соединений и составлять формулы соединений по валентности элементов. Основные понятия. Валентность. Планируемые результаты обучения. Уметь определять валентность элементов по формулам соединений из двух элементов и составлять формулы веществ из двух элементов по известной валентности. Краткое содержание урока. Изучение валентности и составление химических формул по валентности следует рассмотреть на двух уроках. На первом уроке учитель формирует понятие о валентности, учит определять валентность атомов по формулам соединений. На втором уроке учащиеся обучаются составлению химических формул соединений по валентности. Большую помощь в этом учителю и ученикам окажут алгоритмы, представленные в учебнике, а также электронное пособие «Электронная библиотека „Просвещение“. Химия. 8 класс», урок 23. Формирование понятия «валентность» предлагаем осуществить на примерах водородных соединений неметаллов. Учитель обращает внимание учащихся на то, что атомы водорода не могут присоединять более одного атома другого химического элемента, поэтому валентность водорода принята за единицу. Свойство атомов присоединять определенное число других атомов называют валентностью и выражают ее числом, сравнивая с валентностью водорода. Например, хлор в хлороводороде НСl одновалентен, кислород в воде Н2O двухвалентен, а азот в аммиаке NH3 трехвалентен и т. д. Если валентность обозначить черточкой (число черточек указывает на валентность атомов в соединении), то мы получим структурную формулу соединения: 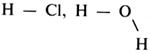 Структурная формула дает наглядное представление о валентности каждого элемента и отражает порядок связи атомов в молекуле вещества. Используя алгоритм (с. 34 учебника), учитель показывает, как определить валентность элементов по формулам их соединений. После этого необходимо предложить несколько упражнений для закрепления материала. Домашнее задание. § 11, 12 (с. 33—34), упр. 1—4 (с. 37). На втором уроке после проверки домашнего задания учитель знакомит учащихся с приемами составления формул веществ по валентности. Имеет смысл уже здесь дать названия некоторым соединениям (оксиды, хлориды, сульфиды). Это обогатит химический язык и даст возможность более свободно пользоваться формулами веществ. Для закрепления умения составлять формулы веществ по валентности можно дать упражнения с последующим обсуждением: 1. Составьте формулы следующих оксидов: оксида натрия, оксида магния, оксида алюминия, оксида фосфора(V). 2. Составьте формулы хлоридов и сульфидов калия, железа(III), кальция, алюминия. 3. Составьте формулы оксидов азота, если азот проявляет переменную валентность от I до V. Домашнее задание. § 12, упр. 5—7, задачи 1, 2 (с. 37). УРОК 14 Закон сохранения массы веществ. Химические уравнения Цель урока. Экспериментально доказать закон сохранения массы веществ. На основе этого закона сформировать понятие о материальном балансе химической реакции. Сформировать понятие об уравнении химической реакции как об условной записи, отображающей превращения веществ. Научить расставлять коэффициенты в уравнениях реакций. Основные понятия. Закон сохранения массы веществ, химическое уравнение, коэффициенты. Планируемые результаты обучения. Знать формулировку закона сохранения массы веществ, понимать смысл уравнений химических реакций, уметь расставлять коэффициенты в уравнениях реакций. Демонстрации. Опыты, подтверждающие закон сохранения массы веществ: горение красного фосфора в закрытом сосуде, взаимодействие сульфата натрия и хлорида бария в закрытом сосуде. Технические весы с разновесами. Краткое содержание урока. После проверки умения составлять химические формулы веществ по валентности элементов учитель переходит к рассказу об опытах, проводимых М. В. Ломоносовым и А. Лавуазье, которые независимо друг от друга открыли закон сохранения массы веществ при химических реакциях. Затем учитель переходит к формулировке закона. Внимание учащихся следует обратить на то, что сохранение массы веществ наблюдается только при таких явлениях, когда атомы не разрушаются — происходит их перегруппировка. Так как число атомов до реакции и после реакции остается неизменным, то их общая масса также не изменяется. Далее учитель переходит к демонстрации опытов, иллюстрирующих закон сохранения массы веществ (горение красного фосфора и взаимодействие сульфата натрия с хлоридом бария в закрытых сосудах). Рассматривается значение закона сохранения массы веществ. Затем учитель сообщает, что этот закон является основой для составления уравнений химических реакций, и переходит к условной записи химических реакций. При этом используются ранее приобретенные знания: понятие «валентность», правила составления формул веществ по валентности; формируется понятие «коэффициент» и умение расставлять коэффициенты в уравнении химической реакции. Учитель дает учащимся алгоритм расстановки коэффициентов в уравнениях химических реакций на примере реакции горения красного фосфора.
Для закрепления умения записывать химические уравнения можно вызывать учащихся к доске и упражняться в расстановке коэффициентов в уравнениях химических реакций. Этот урок можно провести, руководствуясь уроком 25 в электронном пособии «Электронная библиотека „Просвещение“. Химия. 8 класс». Домашнее задание. § 14, 15, упр. 1—4 (с. 47). УРОК 15 Классификация химических реакций по числу и составу исходных и полученных веществ Цель урока. Сформировать умение классифицировать химические реакции по числу и составу исходных и полученных веществ. Научить определять тип реакции по данному химическому уравнению. Основные понятия. Реакции разложения, соединения, замещения. Планируемые результаты обучения. Знать определения реакций разложения, соединения и замещения. Уметь определять тип реакции по данному химическому уравнению. Демонстрации. Прокаливание медной пластинки, горение магния. Лабораторные опыты. Разложение основного карбоната меди(II). Реакция замещения меди железом. Краткое содержание урока. Урок можно начать с объяснения нового материала, где учитель продолжает формировать умение записывать уравнения химических реакций и расставлять в них коэффициенты. При изучении типов химических реакций учащиеся знакомятся с классификацией химических реакций по такому признаку, как число и состав исходных и образующихся в результате реакций веществ; рассматривают особенности реакций разложения, соединения, замещения. Учитель рассказывает о реакции разложения на примере разложения воды электрическим током (рис. 9, с. 15 учебника), проводит беседу по следующим вопросам: 1. Сколько веществ было взято для реакции разложения воды и сколько веществ образовалось в результате реакции? Какие вещества образовались? 2. При каких условиях протекает эта реакция? 3. Какими признаками она сопровождается? Затем учитель вызывает к доске ученика, который записывает уравнение реакции разложения воды и расставляет коэффициенты. Далее учащиеся выполняют лабораторный опыт 6 (с. 50 учебника) — разложение основного карбоната меди(II). Учитель проводит беседу по тем же вопросам, что и при обсуждении реакции разложения воды. Один из учащихся на доске записывает уравнение химической реакции. Учащиеся должны самостоятельно дать определение реакции разложения. После этого они проверяют себя, рассматривая схему 6 (с. 41 учебника). В качестве примеров реакций соединения учитель демонстрирует горение магния и прокаливание медной пластинки. Реакцию замещения учащиеся изучают, проводя лабораторный опыт 7 (с. 51 учебника) — взаимодействие хлорида меди(II) с железным гвоздем. Методика рассмотрения этих типов реакций такая же, что и при рассмотрении реакции разложения. Если в химическом кабинете имеется электронное пособие «Электронная библиотека „Просвещение“. Химия. 8 класс», то можно разобрать с учащимися урок 24 этого пособия. Для закрепления полученных знаний учащиеся в конце урока выполняют несколько заданий, например: 1. Допишите схему химической реакции. Расставьте коэффициенты. Укажите тип каждой реакции. 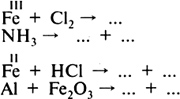 2. Сравните реакции соединения и разложения (разложения и замещения, замещения и соединения): а) по числу взятых и полученных веществ; б) по тому, являются ли исходные и полученные вещества простыми или сложными. Домашнее задание. § 16, упр. 5, 6 (с. 47). УРОК 16 Моль — единица количества вещества. Молярная масса Цель урока. Сформировать понятие о количестве вещества как об одной из основных физических величин. Показать численное равенство молярной и относительной молекулярной масс вещества. Научить вычислять количество вещества по известной массе вещества и массу вещества по известному количеству вещества. Основные понятия. Количество вещества, моль, число Авогадро, постоянная Авогадро, молярная масса. Планируемые результаты обучения. Знать число Авогадро, определения количества вещества и моля. Уметь определять число структурных единиц по данному количеству вещества и наоборот. Знать о равенстве числовых значений молярной и относительной молекулярной масс. Уметь вычислять массу данного количества вещества. Демонстрации. Показ некоторых металлов и неметаллов количеством вещества 1 моль. Краткое содержание урока. Рекомендуем в начале урока провести проверочную работу на составление уравнений химических реакций, расстановку коэффициентов и определение типа реакции. При изучении нового материала учитель обращает внимание учащихся на то, что в химии, кроме использования таких величин, как масса и объем, используется еще одна физическая величина — количество вещества. Количество вещества определяется числом структурных единиц (атомов, молекул или наименьшим повторяющимся фрагментом для веществ немолекулярного строения, ионов, электронов и других частиц). Единицей количества вещества является моль. Обозначается данная величина буквой ν (ню). Число частиц в одном моле вещества (6,02 · 1023) называют числом Авогадро. Постоянная Авогадро численно совпадает с числом Авогадро, но в отличие от него имеет единицу измерения — моль–1. Учитель обращает внимание учащихся на то, что химическая формула может обозначать как одну молекулу вещества (или наименьший повторяющийся фрагмент для веществ немолекулярного строения), так и один моль вещества, т. е. 6 · 1023 таких частиц. Затем учитель переходит к понятию «молярная масса», дает определение молярной массы, показывает, что молярная масса вещества численно равна массе 1 моль, т. е. массе 6,02 · 1023 частиц данного вещества. Важно объяснить, что числовое значение молярной массы совпадает с числовым значением относительной молекулярной массы, а также массы порции вещества, взятого в количестве 1 моль. Можно привести следующую таблицу. 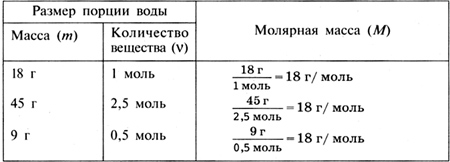 Следовательно, молярная масса — это постоянная характеристика вещества. Она численно равна относительной молекулярной (или атомной) массе данного вещества (см. табл. 5 учебника). Используя формулу Домашнее задание. § 17, упр. 7—10 (с. 47). УРОК 17 Вычисления по химическим уравнениям Цель урока. Научить вычислять по заданным химическим уравнениям массу или количество вещества по известной массе или известному количеству одного из вступающих в реакцию или получающихся в результате реакции веществ. Основные понятия. Относительная атомная и молекулярная массы, моль, количество вещества, молярная масса. Планируемые результаты обучения. Уметь вычислять по заданным химическим уравнениям массу или количество вещества по известному количеству вещества или по известной массе одного из вступающих в реакцию или получающихся в результате реакции веществ. Краткое содержание урока. Урок можно начать с изучения нового материала, так как проверку умений вычислять молярную массу можно осуществить при решении задач по химическим уравнениям. При формировании умения решать задачи по химическим уравнениям следует использовать такие задачи, решение которых не будет вызывать у учащихся затруднения в составлении уравнений реакций. На первом этапе уравнения можно давать в готовом виде. Расчетные химические задачи являются арифметическими. Решение таких задач строится на использовании прямо пропорциональной зависимости между четырьмя величинами: две из них даются в условии задачи, две другие определяются по уравнению химической реакции. Учащиеся умеют составлять и решать пропорцию. Однако необходимо обратить их внимание на то, что коэффициенты в уравнении реакции показывают количество взятых и полученных веществ. Следует также обратить внимание на то, что при выборе величин, по которым будет производиться расчет, необходимо использовать для каждого вещества одинаковые единицы измерения (как по условию задачи, так и по уравнению реакции). На первом этапе обучения решению задач по химическим уравнениям надо показать подробный образец записи условия задачи и ее решения. Затем можно постепенно переходить от подробной записи решения задачи к более краткой («Электронная библиотека „Просвещение“. Химия. 8 класс», урок 27). Домашнее задание. § 17 (с. 45—47), задачи 1, 2 (с. 48). УРОК 18 Контрольная работа по теме «Первоначальные химические понятия» Цель урока. Проконтролировать знания по теме. Методические рекомендации. Для проведения контрольной работы необходимо подготовить задания, отличающиеся по уровню сложности. Значительную помощь в составлении вариантов контрольной работы окажут пособия: 1. Гара Н. Н., Зуева М. В. Химия. Сборник заданий для проведения промежуточной аттестации (Серия «Текущий контроль»). — М.: Просвещение, 2006. 2. Иванова Р. Г., Каверина А. А., Корощенко А. С. Химия. Сборник заданий для проведения экзамена в 9 классе (Серия «Итоговая аттестация»). — М.: Просвещение, 2006. 3. Радецкий А. М. Химический тренажер (Серия «Текущий контроль»). — М.: Просвещение, 2007. 4. Радецкий А. М. Проверочные работы по химии в 8—11 классах. — М.: Просвещение, 2001. Предлагаем варианты контрольной работы в тестовой форме. Вариант I 1. В левом столбце под номерами 1—4 записаны известные вам понятия, в правом столбце буквами А—Г обозначены их характеристики. Выпишите номер, которым обозначено понятие, и букву, соответствующую его характеристике.
|
