Учебник Г. Е. Рудзитиса, Ф. Г. Фельдмана Химия, 8
 Скачать 3.78 Mb. Скачать 3.78 Mb.
|
Вариант II 1. Укажите значения валентностей металла и кислотного остатка в формуле каждой соли.
2. Установите соответствие между химической формулой вещества и его названием.
3. Установите соответствие между химической формулой соли и классом, к которому она относится.
Вместо проверочной работы учитель может провести фронтальную беседу, обобщающую и систематизирующую знания о составе, номенклатуре и классификации солей. Далее рассматриваются способы получения солей. Можно осуществить это двумя путями: либо как самостоятельную работу с учебником (с. 107—108 учебника), либо как аукцион: кто больше назовет способов получения солей. При подведении итогов по этому вопросу следует проанализировать таблицу 15 (с. 110—111 учебника). Домашнее задание. § 33 (с. 105—108), упр. 1—6, 8 (с. 112). УРОК 38 Физические и химические свойства солей Цель урока. Обобщить и систематизировать знания о химических свойствах солей. Основные понятия. Оксиды, кислоты, основания, соли. Планируемые результаты обучения. Знать химические свойства солей. Уметь записывать соответствующие уравнения реакций. Краткое содержание урока. Данный урок следует построить таким образом, чтобы учащиеся поняли, что соли — это класс веществ, который связывает другие классы неорганических соединений. Это создает условия для осознанного восприятия материала о генетической связи оксидов, оснований, кислот и солей. Урок можно провести в форме фронтальной беседы, работы в группах, самостоятельной работы с учебником. Задания следует подбирать не только теоретического, но и экспериментального характера. Домашнее задание. § 33 (с. 108—110), упр. 7, 9, 10 (а, б, в), задачи 1, 2 (с. 112). УРОК 39 Генетическая связь между основными классами неорганических соединений Цель урока. Обобщить, систематизировать и скорректировать знания учащихся о классификации и химических свойствах веществ важнейших классов неорганических соединений. Сформировать представления о генетической связи этих классов. Основные понятия. Генетический ряд, генетическая связь, оксиды, основания, кислоты, соли. Планируемые результаты обучения. Знать определения и классификацию неорганических веществ. Уметь по составу и свойствам классифицировать неорганические вещества; составлять генетические ряды металла и неметалла; иллюстрировать уравнениями химических реакций генетическую связь между основными классами неорганических соединений. Краткое содержание урока. На данном уроке следует показать учащимся, что знание взаимосвязи веществ необходимо человеку для управления их превращениями и получения новых соединений. Однако выявление генетических связей (от греч. «генезис» — происхождение) невозможно без предварительной классификации веществ. Поэтому первое задание, которое дается учащимся, касается классификации неорганических соединений. Например: Вариант I Заполните таблицу. Приведите примеры неорганических соединений.  Вариант II Зная классификацию неорганических соединений, распределите вещества по основным классам. NaCl, NaOH, CO2, Ba(OH)2, H2SO4, Cu(OH)2, HF, SO3, MgO, Li2O, Mg(OH)Cl, Mg(OH)2, HNO3, Na2CO3, K2HPO4, H2S. Затем учитель переходит к генетическим рядам металла и неметалла, т. е. учащиеся на конкретных примерах обсуждают возможность взаимного превращения веществ. Задание дается в двух вариантах: Вариант I Металл Вариант II Неметалл Во время выполнения этих заданий учащиеся могут пользоваться учебником. Химия — наука экспериментальная, поэтому желательно, чтобы эти превращения веществ выполнялись и практически. Для закрепления изученного материала можно дать учащимся небольшую самостоятельную работу. Задание. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения. 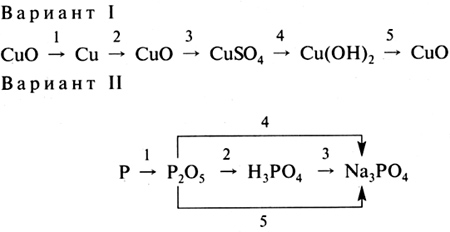 Домашнее задание. § 33 (с. 110—111), упр. 10 (г—к). УРОК 40 Практическая работа «Решение экспериментальных задач по теме «Важнейшие классы неорганических соединений» Цель урока. Применить знания о свойствах основных классов неорганических соединений при экспериментальном решении задач. Сформировать практические умения по превращению веществ разных классов друг в друга. Планируемые результаты обучения. Уметь подбирать вещества и проводить химические реакции, необходимые для решения определенной задачи, соблюдая правила работы в кабинете химии. Краткое содержание урока. Учащимся впервые предоставляется возможность решать химические задачи экспериментально. На этом уроке они должны проявить свою самостоятельность: составить план решения задачи, определить перечень необходимых для этого реактивов и оборудования, реализовать свой план и составить отчет о проделанной работе. При решении экспериментальных задач необходимо использовать тот же порядок действий, что и при выполнении предыдущих практических работ, и при оформлении отчетов к ним. Особенностью экспериментального решения задач является то, что для опыта берут не все вещество, а часть, т. е. отливают или отсыпают порцию — пробу — примерно 1 см3. При распознавании веществ, при проведении нескольких разных опытов с одним веществом или при решении задачи разными способами берут несколько проб. Чтобы их не перепутать, необходимо ставить пробирки с растворами одну за другой в штатив для пробирок. Задачи для экспериментального решения следует давать учащимся в двух вариантах. Каждый ученик должен выполнить не менее пяти задач. Можно использовать задания практической работы (с. 114 учебника). Задача 1 Вариант I. В двух склянках без этикеток находятся порошки: в одной — оксид кальция, в другой — оксид меди(II). Как различить эти вещества, не проводя химических опытов? Как химическими опытами подтвердить наличие в склянках именно этих веществ? Вариант II. В двух склянках без этикеток находятся растворы: в одной — соляной кислоты, в другой — гидроксида калия. Как опытным путем определить, в какой склянке находится каждое из веществ? Задача 2 Вариант I. Очистите химическим способом железный гвоздь от ржавчины, считая, что в состав ржавчины входят оксид железа(III) и гидроксид железа(III). Вариант II. Химическим способом отмойте пробирку, загрязненную на практическом занятии гидроксидом меди(II). Задача 3 Вариант I. Разделите любым способом выданную вам смесь медных и железных опилок. В качестве ответа представьте рисунок с обозначениями. Вариант II. Разделите выданную вам смесь железных и древесных опилок, на основе их физических свойств. В качестве ответа представьте рисунок с обозначениями. Задача 4 Вариант I. После практической работы остался розовый раствор. Лаборант предполагает, что это раствор лакмуса в кислой среде. Проведите несколько опытов для проверки этого предположения. Вариант II. В склянке без этикетки находится бесцветный раствор. Предполагают, что это раствор фенолфталеина. Проведите опыт, подтверждающий или опровергающий это предположение. Мотивированный ответ и результаты опытов запишите в произвольной форме. Задача 5 Вариант I. Из имеющихся на столе реактивов получите несколькими способами сульфат меди(II). Вариант II. В вашем распоряжении есть магний, оксид магния, гидроксид магния, соляная кислота. Сколькими способами вы сможете получить хлорид магния, используя эти реактивы? Подберите необходимое для эксперимента оборудование и получите хлорид магния. Задача 6 Вариант I. Получите опытным путем из хлорида железа(III) оксид железа(III). Вариант II. Проведя два опыта, получите из хлорида меди(II) оксид меди(II). Домашнее задание. Подготовиться к контрольной работе. УРОК 41 Контрольная работа по теме «Важнейшие классы неорганических соединений» Цель урока. Контроль знаний по теме. Методические рекомендации. См. урок 18. Контрольная работа предлагается в виде тестовых заданий: семь заданий уровня А; пять заданий уровня В; три задания уровня С (повышенный уровень). Вариант I А-1. Формулы только кислот приведены в ряду 1) НСl, NaCl, HNO3 2) H2SO3, H2SO4, H2S 3) Ca(OH)2, H3PO4, Ca3(PO4)2 4) Na2O, NaNO3, HNO3 А-2. Формулы только щелочей приведены в ряду 1) Fe(OH)2, KOH, Ва(ОН)2 2) NaOH, Ca(OH)2, Cu(OH)2 3) KOH, NaOH, LiOH 4) Fe(OH)3, Cu(OH)2, NaOH A-3. Оксид, который реагирует с гидроксидом натрия, образуя соль,— это 1) Fe2O3 2) К2О 3) SO3 4) BaO A-4. Взаимодействие оксида с водой относится к реакциям 1) соединения 2) обмена 3) разложения 4) замещения А-5. Взаимодействие гидроксида меди(II) с азотной кислотой относится к реакциям 1) соединения 2) разложения 3) замещения 4) обмена А-6. Индикатор фенолфталеин в щелочной среде становится 1) бесцветным 2) малиновым 3) красным 4) желтым А-7. Свойство, которое является общим для нерастворимых оснований и щелочей,— это 1) взаимодействие с кислотными оксидами 2) взаимодействие с кислотами 3) взаимодействие с солями 4) разложение В-8. Даны формулы веществ: FeO, K2O, CO2, MgO, CrO, CrO3, SO2, Р2О5 Выпишите формулы только основных оксидов. Ответ:_______________________________ В-9. Установите соответствие между химической формулой вещества и классом неорганических соединений, к которому оно принадлежит.
В-10. Установите соответствие между исходными веществами и продуктами химических реакций.
В-11. Вставьте в схемы химических реакций недостающие формулы веществ. 1) ... + ... 2) ... + ... 3) ... + ... 4) ... + ... В-12. Допишите уравнения химических реакций. 1) LiОН + SO3 2) NaOH + Р2О5 3) Са(ОН)2 + СО2 4) Ва(ОН)2 + SO2 С-13. Даны вещества: соляная кислота, гидроксид кальция, вода, оксид фосфора(V), оксид магния. С какими из перечисленных веществ может взаимодействовать: а) гидроксид натрия; б) гидроксид железа(III)? Напишите уравнения соответствующих реакций. Укажите тип каждой реакции. С-14. Как отмыть пробирку от остатков нерастворимого в воде основания? С-15. Составьте уравнения химических реакций, соответствующих схеме 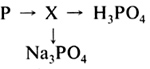 Вариант II А-1. Формулы только солей приведены в ряду 1) K2СО3, Н2СО3, KOH 2) АlСl3, Al(NO3)3, Al2S3 3) H2S, Ba(NO3)2, BaCl2 4) Cu(OH)2, CuSO4, CuS A-2. Формулы только бескислородных кислот приведены в ряду 1) НСl, HNO3, H2S 2) H2SO3, H2S, HNO2 3) Н3РО4, Н2СО3, H2S 4) H2S, HF, HCl A-3. Оксид, который реагирует с кислотой, образуя соль, — это 1) Р2О5 2) СuО 3) SO2 4) СО2 А-4. Получение оксида металла при нагревании гидроксида металла относится к реакциям 1) соединения 2) обмена 3) разложения 4) замещения А-5. Химическая реакция, уравнение которой K2О + 2HNO3 = 2KNO3 + Н2О, относится к реакциям 1) разложения 2) соединения 3) обмена 4) замещения А-6. Индикатор лакмус в щелочной среде становится 1) фиолетовым 2) красным 3) синим 4) бесцветным А-7. В каком ряду все основания, формулы которых приведены, разлагаются при нагревании? 1) NaOH, Сr(ОН)2, Са(ОН)2 2) Fe(OH)3, Cu(OH)2, Fe(OH)2 3) Ва(ОН)2, Mg(OH)2, KOH 4) KOH, LiOH, Al(OH)3 В-8. Даны формулы веществ: СО2, Na2O, СаО, МnО, Мn2О7, Сl2О7, Li2O, P2O5 Выпишите формулы только кислотных оксидов. Ответ: _____________________________________ В-9. Установите соответствие между химической формулой вещества и его названием.
|
