Учебник Г. Е. Рудзитиса, Ф. Г. Фельдмана Химия, 8
 Скачать 3.78 Mb. Скачать 3.78 Mb.
|
|
Цель урока. Сформировать представления о типах кристаллических решеток. Научить характеризовать свойства соединений по определенному типу кристаллической решетки. Основные понятия. Кристаллические и аморфные вещества, кристаллические решетки: ионные, атомные, молекулярные. Планируемые результаты обучения. Знать типы кристаллических решеток. Уметь характеризовать физические свойства вещества по типу кристаллической решетки. Демонстрации. Модели кристаллических решеток поваренной соли, алмаза, оксида углерода(IV) или иода. Лабораторные опыты. Составление моделей молекул и кристаллов веществ с различными видами химической связи. Краткое содержание урока. Перед изучением нового материала учитель актуализирует знания учащихся по видам химической связи следующими вопросами: 1. В чем особенности строения атомов металлов, неметаллов, благородных газов? 2. Что такое завершенный и незавершенный электронный слой? 3. В чем причина соединения атомов друг с другом? 4. Какие виды химической связи вам известны? Каковы механизмы их образования? 5. Как изображают электронные формулы веществ с различным видом связи? Одновременно можно предложить учащимся составить и заполнить таблицу, обобщающую сведения о видах химической связи. После этого учитель переходит к изучению нового материала, вводит понятия «кристаллические вещества» и «аморфные вещества». Большинство веществ, свойства которых изучают учащиеся, имеет кристаллическое строение. Учитель дает определение кристаллической решетки, рассматривает особенности ионной, атомной и молекулярной кристаллических решеток. Демонстрирует модели этих решеток, сравнивая их между собой. Учащиеся выполняют лабораторный опыт 19 (с. 152 учебника). Учитель обращает внимание на то, что понятие «молекула» неприменимо к веществам ионного и атомного строения. Формула ионного соединения отражает соотношение положительных и отрицательных ионов. В конце данной темы разбирается вопрос о влиянии типа кристаллической решетки на свойства вещества. Приводятся конкретные примеры. В заключение можно предложить учащимся следующие вопросы и задания: 1. Приведите примеры веществ, имеющих кристаллическую решетку: а) ионную; б) молекулярную; в) атомную. Поясните, как строение этих веществ отражается на их свойствах. 2. Используя знания о строении вещества и данные, приведенные ниже, объясните, почему у хлора, натрия и полученного из них хлорида натрия разные температуры кипения и плавления.
3. Даны вещества: иод, иодид калия, алмаз, графит, «сухой лед» (оксид углерода(IV)), фторид натрия, речной песок (оксид кремния(IV)), сахар С12Н22О11. Выпишите названия веществ с молекулярной кристаллической решеткой и ионной кристаллической решеткой, пояснив, какие свойства этих веществ определяются их строением. 4. Какую кристаллическую решетку должен иметь карбид кремния, из которого делают абразивные материалы? 5. Установите соответствие между типом кристаллической решетки и свойствами веществ.
6. Изобразите схемы строения ионов Mg2+ и Сl–. Какой тип кристаллической решетки характерен для соединения, образованного этими частицами? Домашнее задание. § 42 (с. 146—148), упр. 1—4, задачи 1, 2 (с. 152). УРОК 55 Валентность и степень окисления. Правила вычисления степени окисления элементов Цель урока. Сформировать представления о степени окисления, показать различие понятий «валентность» и «степень окисления». Основные понятия. Валентность, степень окисления, электронные и структурные формулы. Планируемые результаты обучения. Знать определения понятий «валентность» и «степень окисления». Понимать отличия степени окисления от валентности. Уметь определять степень окисления элемента по формуле вещества и составлять формулы по известной степени окисления элементов. Краткое содержание урока. После проверки домашнего задания учитель уточняет определение валентности элементов с точки зрения строения атома, т. е. формирует представления о валентности как свойстве атома, характеризующем его способность образовывать химические связи с другими атомами. Обращает внимание на запись электронных и структурных формул веществ. Затем переходит к рассмотрению степени окисления — условного заряда элемента, рассчитанного исходя из условия, что все связи в соединении являются ионными. Учитель обязательно обращает внимание учащихся на различие валентности и степени окисления. Далее учащиеся, используя алгоритм (с. 151 учебника), учатся определять степень окисления элемента по формуле вещества и составлять формулы по известной степени окисления элементов. Домашнее задание. § 42 (с. 148—149), § 43 (с. 150—152), упр. 5, 6, 8 (с. 152). УРОК 56 Окислительно-восстановительные реакции Цель урока. Сформировать первоначальные представления об окислительно-восстановительных реакциях. Научить определять окислитель и восстановитель. Основные понятия. Окислительно-восстановительные реакции, окислитель, восстановитель. Планируемые результаты обучения. Знать определения понятий «окислитель», «восстановитель», «окислительно-восстановительные реакции». Уметь определять окислительно-восстановительные реакции, различать процессы окисления и восстановления с электронной точки зрения. Краткое содержание урока. Учащимся уже известны процессы окисления и восстановления с позиций атомно-молекулярного учения. Теперь надо дать обобщенные представления об этих процессах с точки зрения строения атома. Формирование понятия «окислительно-восстановительная реакция» происходит на основе знаний о степени окисления. Учитель предлагает учащимся записать уравнение реакции окисления, например кальция, и проставить степень окисления атомов в каждом соединении: При обсуждении этого уравнения выясняется, что данная реакция сопровождается изменением степени окисления элементов. Происходит процесс отдачи электронов:
После заполнения таблицы и ее обсуждения учащиеся приходят к выводу, что химические реакции можно группировать по разным классификационным признакам. Для упражнений в составлении окислительно-восстановительных реакций следует давать учащимся известные примеры, простые в исполнении. На этом уроке даются первые представления об окислительно-восстановительных реакциях. Можно дать алгоритм составления уравнения окислительно-восстановительной реакции, например взаимодействия кальция с кислородом, методом электронного баланса. 1) Определите степень окисления атомов в каждом соединении. 2) Выпишите те элементы, у которых степень окисления изменяется, и составьте схему перемещения электронов: 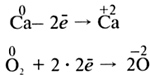 3) Запишите число отданных и принятых электронов и уравняйте их. Расставьте коэффициенты в схеме реакции: 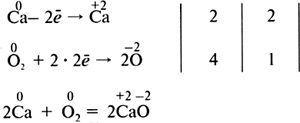 4) Определите процессы окисления и восстановления, окислитель и восстановитель и запишите их в электронной схеме: 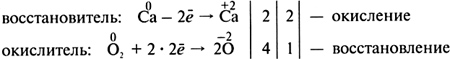 Можно записывать уравнения окислительно-восстановительных реакций так, как это показано на с. 149 учебника. Домашнее задание. § 43 (с. 149—150), упр. 7, 9 (с. 152). Повторить § 40—43, подготовиться к семинарскому занятию. УРОК 57 Повторение и обобщение по теме «Строение вещества. Химическая связь» Цель урока. Обобщить, систематизировать и скорректировать знания и умения учащихся по теме «Строение вещества. Химическая связь». Основные понятия. Электроотрицательность, степень окисления, валентность, ковалентная (полярная, неполярная) химическая связь, ионы, ионная химическая связь, кристаллические решетки. Планируемые результаты обучения. Знать определения основных понятий по теме, типы кристаллических решеток и свойства соединений с каждым типом кристаллической решетки. Уметь определять степень окисления в бинарных соединениях и вид химической связи в соединении по разности электроотрицательности двух атомов. Понимать отличие степени окисления от валентности, ионных соединений от ковалентных. Краткое содержание урока. Урок рекомендуется провести в форме семинара, используя фронтальную беседу, работу в парах, индивидуальные задания, самостоятельную работу. На данном уроке следует подготовить учащихся к контрольной работе, обсуждая и разбирая следующие вопросы: 1. Что означает понятие «электроотрицательность»? Может ли быть электроотрицательность равна нулю? Поясните примерами. Как изменяется электроотрицательность в ряду химических элементов: F, I, Br, Cl? 2. Назовите наиболее электроотрицательный химический элемент. Электроотрицательность какого химического элемента принята за единицу? 3. Какие химические элементы — металлы или неметаллы — имеют наибольшее численное значение электроотрицательности? Почему? 4. Как изменяется электроотрицательность химических элементов: а) в главной подгруппе одной группы; б) в периодах периодической системы химических элементов Д. И. Менделеева? 5. Что такое степень окисления? Составьте формулы бинарных соединений, в которых степени окисления атомов химических элементов равны: а) +4 и –2; б) +7 и –2; в) +1 и –4; г) +1 и –1. Назовите эти вещества. 6. Установите соответствие между названием химического элемента и его высшей положительной степенью окисления.
7. Установите соответствие между названием химического элемента и его отрицательной степенью окисления.
8. Установите соответствие между химическим элементом и возможными значениями его степеней окисления.
9. Дайте определение понятий «ковалентная химическая связь», «ионная химическая связь». Сравните ковалентную полярную связь с ионной связью. 10. Пользуясь знаниями о химической связи, решите, какие из веществ, формулы которых СО2, N2, NH3, H2O, AlI3, Аl2О3, являются: а) газами; б) жидкостями; в) твердыми веществами. 11. Что называют кристаллической решеткой вещества? Какие кристаллические решетки имеют: а) графит; б) поваренная соль; в) медь? Какие частицы находятся в узлах каждой кристаллической решетки? Как это отражается на свойствах названных веществ? 12. Почему вещества F2, HF, NaCl имеют разные температуры плавления, соответственно равные –220 °С, –83 °С, +800 °С? 13. Приведите по два примера уравнений химических реакций: а) соединения; б) разложения, одна из которых является окислительно-восстановительной реакцией, другая происходит без изменения степени окисления атомов химических элементов. 14. Какие химические реакции из тех, схемы которых приведены ниже, следует отнести к окислительно-восстановительным? 1) Сl2 + KI 2) Н2О + SO3 3) H2S 4) СаО + НСl 5) CuS + О2 6) WO3 + H2 Ответ объясните. 15. Какой процесс (окисление или восстановление) изображен на следующих схемах? 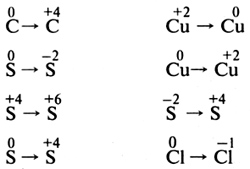 16. Какие опыты можно провести, чтобы прошла окислительно-восстановительная реакция, соответствующая схеме 17. Какие опыты можно провести, чтобы прошла окислительно-восстановительная реакция, соответствующая схеме 18. Расставьте коэффициенты в схеме химической реакции I2 + Н2 Подчеркните восстановитель. Укажите вид химической связи и тип кристаллической решетки в иодоводороде. Перечислите свойства иодоводорода, определяемые его строением. Домашнее задание. Подготовиться к контрольной работе. УРОК 58 Контрольная работа по темам «Периодический закон и периодическая таблица химических элементов Д. И. Менделеева. Строение атома» и «Строение вещества. Химическая связь» Цель урока. Контроль знаний и умений по темам. Методические рекомендации. См. урок 18. Вариант I 1. Назовите химический элемент, определите заряд ядра атомов этого элемента, зная распределение электронов в его атомах: а) 2, 5; б) 2, 8, 6; в) 2, 8, 8; г) 2, 8, 5. Какие из этих химических элементов имеют сходные свойства? Составьте формулы их оксидов, гидроксидов, летучих водородных соединений, если они их образуют. 2. Расположите: а) в порядке ослабления металлических свойств химические элементы Na, Li, Cu, Rb, K; б) в порядке усиления неметаллических свойств химические элементы Si, Al, Cl, P, S. 3. Определите по формулам степени окисления атомов в бинарных соединениях. Назовите вещества. Подчеркните наиболее электроотрицательный химический элемент. АlСl3, HF, NH3, CaBr2, NO2, IF7. 4. Запишите формулу сероводорода. Определите вид химической связи. Составьте схему ее образования. 5. Поясните, какую кристаллическую решетку имеет карбид кремния (SiC), если известно, что это вещество используют как абразивный материал. 6. Какие химические реакции, уравнения которых приведены ниже, относятся к окислительно-восстановительным? а) 2Na + 2Н2О = 2NaOH + Н2 б) K2О + Н2О = 2KOH в) СаО + 2НСl = СаСl2 + Н2О г) Fe + H2SO4 = FeSO4 + H2 Вариант II 1. Назовите химический элемент, определите заряд ядра атомов этого элемента, зная распределение электронов в его атомах: а) 2, 8, 2; б) 2, 8, 7; в) 2, 8, 8; г) 2, 8, 8, 2. Какие из этих химических элементов имеют сходные свойства? Составьте формулы их оксидов, гидроксидов, летучих водородных соединений, если они их образуют. 2. Расположите: а) в порядке усиления металлических свойств химические элементы Ва, Sr, Mg, Ca, Be; б) в порядке ослабления неметаллических свойств химические элементы F, В, N, О, С. 3. Составьте формулы веществ. Проставьте степени окисления над знаками химических элементов в каждой формуле. Подчеркните наиболее электроотрицательный химический элемент. а) нитрид кальция б) оксид марганца(VII) в) карбид кремния 4. Какая из схем соответствует изображению химической связи, удерживающей атомы в оксиде лития Назовите вид этой химической связи. 5. Поясните, какую кристаллическую решетку имеет иод, если известно, что это вещество легко возгоняется. 6. Какие химические реакции, уравнения которых приведены ниже, относятся к окислительно-восстановительным? а) Na2O + Н2О = 2NaOH б) СаСО3 = СаО + СО2 в) Zn + 2HCl = ZnCl2 + H2 г) 2Mg + О2 = 2MgO ТЕМА 8 ЗАKOH АВОГАДРО. МОЛЯРНЫЙ ОБЪЕМ ГАЗОВ (3 ч) УРОК 59 Закон Авогадро. Молярный объем газов Цель урока. Сформировать понятие о молярном объеме газов. Научить производить расчеты, используя закон Авогадро и следствие из него. Основные понятия. Закон Авогадро, молярный объем газов, нормальные условия. Планируемые результаты обучения. Знать закон Авогадро и следствие из него. Уметь определять объем определенного количества вещества газа, а также количество вещества газа, массу газа и число молекул, исходя из объема газа при нормальных условиях. Краткое содержание урока. Учитель начинает изучение данной темы с формулировки закона Авогадро, затем объясняет закон Авогадро, привлекая знания учащихся. Проводит фронтальную беседу по следующим вопросам: 1. Чем газообразное состояние вещества отличается от жидкого и твердого? 2. Каково расстояние между молекулами в газе по сравнению с размерами самих молекул? 3. Как изменяется расстояние между молекулами в газообразном веществе при изменении температуры и давления? Почему? В итоге учащиеся должны прийти к выводу, что для газообразных веществ важно знать объем, который занимают 6,02 · 1023 молекул газа, т. е. 1 моль газа. Этот объем можно вычислить, если известна масса 1 л газа. Например, при нормальных условиях масса 1 л водорода равна 0,09 г (а плотность 0,09 г/л); молярная масса водорода равна 2,016 г/моль. Тогда объем, занимаемый 1 моль водорода, равен: При нормальных условиях масса 1 л кислорода равна 1,429 г, М(О2) = 32 г/моль, тогда Учащиеся делают вывод, что 1 моль любого газа при нормальных условиях занимает объем, равный 22,4 л. Этот объем называют молярным объемом газа. Необходимо различать нормальные условия (0 °С, 1 атм) и стандартные условия (25 °С, 1 атм). На основании закона Авогадро и следствия из него школьники учатся производить расчеты. Задача 1. Рассчитайте, какой объем занимают 5 моль аммиака (н. у.). Задача 2. Рассчитайте, какой объем при нормальных условиях займет оксид углерода(IV) массой 5,6 г. Задача 3. Определите массу 5 л аммиака (н. у.). Какое количество вещества аммиака заключено в этом объеме? Задача 4. Определите, какой объем занимают 1,204 · 1023 молекул кислорода (н. у.). В конце урока следует дать самостоятельную работу на вычисление объема определенного количества вещества газа, определенной массы газа, определенного числа молекул, исходя из объема газа при нормальных условиях. Можно предложить учащимся самим составить и решить несколько задач. Домашнее задание. § 44 (с. 153—154), упр. 1, 2 (с. 156). УРОК 60 Относительная плотность газов Цель урока. Научить вычислять по химическим уравнениям объем газа (по известной массе или количеству вещества), массу или количество вещества (по известному объему газа) одного из вступивших в реакцию или получившихся в результате реакции веществ. Сформировать понятие об относительной плотности газов. Научить производить расчеты, используя понятие «относительная плотность газов». Основные понятия. Молярный объем, молярная масса, относительная плотность газов, плотность газов. Планируемые результаты обучения. Знать определение относительной плотности газов и уметь производить расчеты, используя эту величину. Уметь рассчитывать по химическому уравнению массу, количество и объем вещества. Краткое содержание урока. Фронтальная проверка домашнего задания: решение задач с использованием понятий «молярный объем», «количество вещества», «масса». К доске можно вызвать несколько учеников для выполнения индивидуальных заданий, остальные учащиеся работают в парах. Учитель должен подготовить задания для каждой пары. После проверки домашнего задания учитель переходит к понятию «относительная плотность газов». Сначала дается пояснение, что такое плотность газов, и выполняется ряд упражнений — нахождение молярной массы вещества с использованием понятия «плотность газа». Затем следует перейти к относительной плотности газов. Учитель обращает внимание учащихся на то, что при расчетах более удобно использовать относительную величину, называющую, во сколько раз один газ тяжелее или легче другого. Это понятие закрепляется расчетами на нахождение относительной плотности газа и молярной массы вещества. После этого учитель переходит к решению задач по химическим уравнениям, используя понятия «молярная масса», «масса», «молярный объем», «количество вещества». Домашнее задание. § 44, упр. 3, задача 3 (с. 156). Составить две-три задачи, используя понятия «молярный объем», «количество вещества», «масса», «относительная плотность газов». УРОК 61 Объемные отношения газов при химических реакциях Цель урока. Сформировать умение вычислять объемы газов, участвующих в химических реакциях. Основные понятия. Закон Авогадро, молярный объем. Планируемые результаты обучения. Уметь вычислять объемы газов, участвующих в химических реакциях. Краткое содержание урока. В начале урока можно провести самостоятельную работу. Вариант I 1. Рассчитайте: а) плотность (н. у.) оксида углерода(IV) (г/л); б) относительную плотность оксида азота(IV) по кислороду. 2. Рассчитайте, какой объем (н. у.) займут: а) 0,6 моль азота; б) 10 г водорода; в) 4,5 моль кислорода. 3. Сгорело 6 г углерода. Вычислите: а) объем вступившего в реакцию кислорода; б) объем образовавшегося оксида углерода(IV) (н. у.). Вариант II 1. Рассчитайте: а) плотность (н. у.) оксида серы(IV) (г/л); б) относительную плотность сероводорода H2S по водороду. 2. Рассчитайте, какой объем (н. у.) займут: а) 38 г фтора; б) 0,4 моль хлора; в) 1,5 моль кислорода. 3. Сгорело 8 г серы. Вычислите: а) объем вступившего в реакцию кислорода; б) объем образовавшегося оксида серы(IV) (н. у.). Переходя к вопросу об объемных отношениях газов при химических реакциях, учитель напоминает учащимся, что коэффициенты, стоящие перед химическими знаками и формулами, показывают не только число молекул или формульных единиц, но и число молей, участвующих в реакции. Поэтому уравнения реакций между газами можно записать и так: 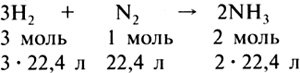 Если разделить указанные численные значения объемов реагирующих и образующихся газов на 22,4, то получатся простые целые числа, показывающие объемные отношения газов: 3 : 1 : 2. Следовательно, реакции между газообразными веществами подчиняются определенным закономерностям: при неизменном давлении объемы реагирующих и образующихся газов относятся между собой как небольшие целые числа. Коэффициенты в уравнениях реакций показывают число объемов реагирующих и образующихся веществ: Далее на конкретном примере дается алгоритм решения типовой задачи. Задача. Вычислите объем углекислого газа (оксида углерода(IV)), который выделится при сгорании 2 л метана (н. у.).  Чтобы закрепить умение решать такие задачи, учащимся можно дать несколько задач для самостоятельного выполнения. Учащиеся могут также придумать свои варианты задач и решить их. Домашнее задание. § 45, упр. 4, задачи 2, 4 (с. 156). ТЕМА 9 ГАЛОГЕНЫ (6 ч) УРОК 62 Положение галогенов в периодической таблице и строение их атомов. Хлор: физические и химические свойства, получение и применение Цель урока. Обобщить и развить знания учащихся о строении атомов, свойствах химических элементов и их соединений в зависимости от положения в периодической таблице, строении молекул на примере галогенов. Изучить свойства хлора и его применение. Основные понятия. Цепная реакция. Планируемые результаты обучения. Уметь давать характеристику элементов-галогенов по их положению в периодической таблице и строению атомов. Знать свойства хлора как простого вещества. Уметь составлять уравнения реакций, характеризующих химические свойства хлора. Демонстрации. Получение хлора в лаборатории. Горение натрия, меди, железа, сурьмы в хлоре. Отбеливание ткани и бумаги хлором (все опыты проводить в вытяжном шкафу). Краткое содержание урока. Общую характеристику семейству галогенов учащиеся могут дать самостоятельно, для этого они должны прочитать § 46 учебника и ответить на следующие вопросы: 1. Какие элементы входят в подгруппу галогенов? 2. Что общего в строении атомов галогенов? 3. Какими свойствами (металлов или неметаллов) должны обладать галогены на основании строения атомов и положения в периодической таблице? 4. Чему равна степень окисления галогенов в соединениях с металлами и водородом? 5. Чему равна степень окисления атомов галогена в следующих соединениях: HI, Сl2О7, НClO4, KClO3, НClO, OF2? 6. Какой вид химической связи и тип кристаллической решетки характерны для простых веществ — галогенов? Можно использовать и тест обучающего характера, который тут же проверяется во фронтальной беседе: 1. Что общего в строении атомов галогенов? 1) заряд ядра атома 2) радиус атома 3) одинаковое число электронов на наружном электронном слое 4) до октета (восьми электронов) на наружном электронном слое недостает по одному электрону 2. В чем различие в строении атомов галогенов? 1) заряд ядра атома 2) радиус атома 3) наружный электронный слой близок к завершенному 4) относительная атомная масса 3. Особенности в строении атомов галогенов, обусловливающие их принадлежность к типичным неметаллам 1) заряд ядра атома 2) радиус атома 3) общее число электронов, вращающихся вокруг ядра атома 4) близкое к завершению общее число электронов, находящихся на наружном электронном слое атома, и способность атома легко принимать недостающие для этого электроны 4. Неметаллические свойства галогенов в группе с увеличением порядкового номера химического элемента 1) усиливаются 2) не изменяются 3) возрастают 4) усиливаются только от химического элемента с порядковым номером 17 к элементу с порядковым номером 9, остальные — без изменения 5. Как изменяется электроотрицательность в группе галогенов? 1) ЭO(F) > ЭО(Cl) > ЭО(Br) > ЭО(I) 2) ЭO(F) = ЭО(Сl) = ЭО(Br) = ЭО(I) 3) ЭО(I) > ЭО(Br) > ЭО(Cl) > ЭО(F) 4) ЭО(F) < ЭО(Сl) = ЭО(Br) > ЭO(I) 6. Галогены являются 1) сильными восстановителями 2) сильными окислителями 3) переходными элементами 4) как восстановителями, так и окислителями 7. Галогены в своих соединениях могут проявлять переменную степень окисления. Выберите правильные ответы.
8. Вид химической связи в соединениях, образованных галогенами, неодинаков. Выберите правильные ответы.
9. Галогены и их соединения в твердом состоянии имеют кристаллическое строение. Какой тип кристаллической решетки можно предположить у галогенов и образованных ими веществ, находящихся в твердом состоянии? Выберите правильный ответ.
10. Установите соответствие между названием галогена и его физическими свойствами.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
