Учебник Г. Е. Рудзитиса, Ф. Г. Фельдмана Химия, 8
 Скачать 3.78 Mb. Скачать 3.78 Mb.
|
|
Цель урока. Конкретизировать знания о химическом элементе и простом веществе на примере изучения водорода. Сформировать представления о способах получения и собирания водорода в лаборатории. Основные понятия. Химический элемент, простое вещество, физические свойства, валентность кислотного остатка. Планируемые результаты обучения. Знать состав молекул водорода и способ его получения реакцией замещения. Уметь характеризовать физические свойства водорода, собирать водород методом вытеснения воздуха, доказывать его наличие, проверять водород на чистоту. Соблюдать меры предосторожности при работе с химическими реактивами. Демонстрации. Получение водорода в аппарате Киппа. Ознакомление с физическими свойствами водорода. Проверка водорода на чистоту. Наполнение водородом мыльных пузырей. Лабораторный опыт. Получение и свойства водорода. Краткое содержание урока. В начале урока учитель продолжает формировать умение решать расчетные задачи с использованием термохимических уравнений. К доске вызываются несколько человек, которые получают индивидуальные задания. Класс в это время обсуждает выполнение домашнего задания. При изучении нового материала продолжается конкретизация знаний о химическом элементе и простом веществе. Используя план характеристики химического элемента (см. урок 19), учащиеся самостоятельно характеризуют водород как химический элемент. Далее учитель демонстрирует получение водорода в аппарате Киппа: объясняет устройство аппарата и показывает, как проверить водород на чистоту, разъясняет, почему работать с водородом опасно. Затем учитель демонстрирует способы собирания водорода. Учащиеся, наблюдая за демонстрационным экспериментом, отмечают физические свойства водорода. Обсуждение физических свойств водорода необходимо проводить в сравнении с физическими свойствами кислорода. Говоря о том, что водород самый легкий из газов, можно продемонстрировать наполнение водородом мыльных пузырей. Готовят из туалетного мыла пену, в которую для прочности мыльных пузырей добавляют несколько капель глицерина. Затем учитель подробно разбирает запись уравнения реакции получения водорода в лаборатории, отмечает, что эта реакция относится к реакциям замещения. Обращает внимание на формулы сложных веществ — соляной кислоты НСl и серной кислоты Н2SO4. Вводит понятие о валентности кислотного остатка. Затем учащиеся выполняют лабораторный опыт 9 (с. 77 учебника), закрепляя практические умения получать водород, собирать его вытеснением воздуха, проверять на чистоту, доказывать наличие образовавшейся соли. Материал § 26 (с. 73 учебника) лучше рассмотреть при изучении химических свойств воды. Домашнее задание. § 25, 26, 27 (физические свойства водорода), упр. 1—7 (с. 76—77). УРОК 25 Химические свойства водорода. Применение водорода Цель урока. Изучить химические свойства водорода. Сформировать представления о водороде как о восстановителе и экологически чистом топливе. Основные понятия. Гремучий газ, восстановитель, восстановление, экологически чистое топливо. Планируемые результаты обучения. Уметь составлять уравнения реакций водорода с кислородом и с оксидами металлов. Демонстрация. Взрыв смеси водорода с воздухом. Лабораторный опыт. Взаимодействие водорода с оксидом меди(II). Краткое содержание урока. После краткого опроса учащихся по теме «Получение водорода в лаборатории, его физические свойства» учитель обсуждает с ними химические свойства водорода: вначале взаимодействие водорода с простыми веществами, затем со сложными. Подробно разбирается реакция горения водорода. При этом еще раз обращается внимание на то, что все эксперименты с водородом проводятся с большой осторожностью. Перед проведением какой-либо реакции с этим газом обязательно надо проверить его на чистоту. Отмечается, что чистый водород горит спокойно. При смешивании с воздухом или кислородом он горит быстро и со взрывом. Смесь одного объема кислорода с двумя объемами водорода называют гремучим газом. Затем записывается уравнение реакции взаимодействия водорода с кислородом и расставляются коэффициенты. Далее учитель демонстрирует взрыв смеси водорода с воздухом. О взрыве учитель должен предупредить учащихся заранее. Этот демонстрационный опыт описан почти во всей существующей методической литературе по химии. После рассмотрения реакции горения водорода в кислороде и на воздухе учитель рассказывает о реакциях водорода с хлором и серой. Учащиеся отмечают, что эти реакции относятся к реакциям соединения. Изучение взаимодействия водорода со сложным веществом — оксидом меди(II) осуществляется лабораторно (лабораторный опыт 10, с. 77 учебника). Учитывая, что водород — взрывоопасное вещество, перед лабораторным опытом следует обобщить правила техники безопасности при работе с этим газом. Затем надо подробно обсудить уравнение реакции водорода с оксидом меди(II). На доске записывается левая часть уравнения, определяется, к какому типу реакций это уравнение относится, и учащиеся самостоятельно определяют продукты реакции, т. е. дописывают правую часть уравнения. После обсуждения всех вопросов учащиеся приступают к выполнению лабораторного опыта. Затем учитель вводит понятия «восстановитель», «процесс восстановления» (как противоположный процессу окисления), отмечает окислитель и восстановитель как противоположные по своей роли вещества. Применение водорода следует рассматривать в зависимости от его свойств. Можно предложить учащимся составить следующую таблицу:
Домашнее задание. § 27, упр. 8—11 (с. 77). УРОК 26 Повторение и обобщение по темам «Кислород» и «Водород» Цель урока. Обобщить и систематизировать знания и умения учащихся, скорректировать знания по темам «Кислород» и «Водород». Основные понятия. Химический элемент, простое и сложное вещества, валентность, индекс, коэффициент, физические и химические свойства, катализатор, оксиды, окислитель и восстановитель, реакции соединения, разложения, замещения. Планируемые результаты обучения. Различать понятия «химический элемент» и «простое вещество», «физические свойства» и «химические свойства» на примере водорода и кислорода. Уметь собирать кислород и водород вытеснением воды и воздуха, рассматривать применение веществ в зависимости от их свойств. Соблюдать меры предосторожности при работе с химическими реактивами. Демонстрации. Газометр, аппарат Киппа, детали для сборки простейшего прибора для получения газов. Краткое содержание урока. Обобщение и систематизацию знаний и умений по темам «Кислород» и «Водород» следует провести в форме семинарского занятия. Материал двух тем лучше рассматривать в сравнении. Задания даются всем учащимся индивидуально на карточках. Время выполнения работы и обсуждения ее в парах — 15 мин. У доски обсуждаются следующие вопросы: 1. Характеристика химических элементов кислорода и водорода. 2. Характеристика простых веществ кислорода и водорода (по плану до химических свойств). Устройство газометра. 3. Взаимодействие кислорода и водорода с простыми веществами (записать соответствующие уравнения химических реакций, указать тип реакций). 4. Взаимодействие кислорода и водорода со сложными веществами (записать соответствующие уравнения химических реакций). 5. Получение кислорода и водорода в лаборатории (записать уравнения соответствующих реакций, указать тип реакций). 6. Окислитель, процесс окисления (записать уравнения химических реакций, доказывающих окислительные свойства кислорода). 7. Восстановитель, процесс восстановления (записать уравнения химических реакций, доказывающих восстановительные свойства водорода). 8. Устройство аппарата Киппа. 9. Сборка простейшего прибора для получения газов. Как проверить прибор на герметичность? (Укрепить прибор в штативе и показать способы собирания кислорода и водорода вытеснением воздуха и воды.) 10. С какой целью перед каждым опытом водород проверяется на чистоту? (Получить в простейшем приборе водород и проверить его на чистоту.) 11. На каких свойствах основано применение кислорода? 12. На каких свойствах основано применение водорода? 13. Состав воздуха. Охрана воздуха от загрязнений. 14. Решение задач по термохимическим уравнениям. Домашнее задание. Повторить темы «Кислород» и «Водород». ТЕМА 4 РАСТВОРЫ. ВОДА (6 ч) УРОК 27 Растворы. Вода — растворитель. Растворимость веществ в воде Цель урока. Сформировать понятия о растворе, растворителе, растворимости, насыщенных и ненасыщенных растворах. Научить объяснять процесс растворения веществ в воде на основе атомно-молекулярного учения. Дать первоначальные представления о гидратах. Основные понятия. Раствор, растворитель, растворимость, насыщенный и ненасыщенный растворы, гидраты. Планируемые результаты обучения. Знать определения понятий «раствор», «растворимость», «насыщенный и ненасыщенный растворы». Демонстрации. Растворение в воде сахара (соли), глины, керосина. Растворение серной кислоты в воде. Приготовление ненасыщенных и насыщенных растворов. Краткое содержание урока. Данный урок можно рассматривать как вводный урок в тему «Растворы». На этом уроке следует начать формировать представления о классификации растворов. Учитель демонстрирует учащимся различные виды растворов: истинные растворы и взвеси (суспензии и эмульсии). Объясняет, что любой раствор состоит из растворителя и растворенного вещества. В качестве растворителя рассматривается вода. Учащиеся самостоятельно могут объяснить растворение как физический процесс. Однако учитель расширяет их знания, рассказывая, что процесс растворения связан и с химическим превращением, т. е. с образованием гидратов. Например, демонстрируя растворение серной кислоты в воде, обращает внимание на сильное разогревание и образование гидратов серной кислоты (соединений серной кислоты с водой). Далее рассматривается классификация растворов на основании растворимости веществ в воде. Вводится понятие «растворимость»; учитель демонстрирует, как влияет изменение температуры на растворимость твердых веществ и изменение температуры и давления на растворимость газов. Вводятся понятия «насыщенный раствор» и «ненасыщенный раствор». Учитель показывает, как из ненасыщенного раствора приготовить насыщенный и наоборот. Домашнее задание. § 28 (с. 78—79), упр. 1—4, задача 1 (с. 81). Можно предложить учащимся подготовить следующие сообщения: 1. Вода — это жизнь. 2. Природная вода. 3. Три агрегатных состояния воды. 4. Использование воды в промышленности и быту. 5. Круговорот воды в природе. 6. Охрана природных водоемов. Для подготовки этих сообщений можно использовать фрагменты электронного пособия «Электронная библиотека „Просвещение“. Химия. 8 класс», уроки 29—32. УРОК 28 Массовая доля растворенного вещества Цель урока. Сформировать умение выражать состав раствора через массовую долю растворенного вещества и определять состав раствора по массовой доле растворенного вещества. Основные понятия. Концентрированный и разбавленный растворы, массовая доля растворенного вещества. Планируемые результаты обучения. Знать определение массовой доли растворенного вещества. Уметь вычислять массовую долю и массу вещества в растворе. Демонстрации. Приготовление раствора с определенной массовой долей растворенного вещества. Краткое содержание урока. На этом уроке следует начать слушание сообщений учащихся (первый доклад «Вода — это жизнь»). Затем к доске вызываются учащиеся, которым даются задания: 1) из насыщенного раствора нитрата калия получить ненасыщенный раствор; 2) из ненасыщенного раствора нитрата калия получить насыщенный раствор. Учащиеся демонстрируют опыты и комментируют эти задания. Далее учитель переходит к составу раствора, вводит понятия «концентрированный раствор», «разбавленный раствор», «массовая доля растворенного вещества». Обязательно надо провести аналогию с уже известным учащимся понятием массовой доли химического элемента в соединении. Учитель приводит формулу и учит учащихся вычислять массовую долю и массу растворенного вещества в растворе. Затем учитель показывает, как готовить раствор с заданной массовой долей растворенного вещества, т. е. осуществляет подготовку к практической работе. Домашнее задание. § 28 (с. 80—81), упр. 5—6, задачи 2—4 (с. 81). УРОК 29 Практическая работа «Приготовление растворов солей с определенной массовой долей растворенного вещества» Цель урока. Сформировать практическое умение готовить растворы с указанной массовой долей растворенного вещества. Практиковаться в работе с химической посудой, в использовании весов с разновесами, в приготовлении растворов веществ. Планируемые результаты обучения. Уметь приготавливать раствор с определенной массовой долей растворенного вещества. Краткое содержание урока. В первой половине урока проводится опрос, учащиеся решают задачи на вычисление массовой доли и массы растворенного вещества, продолжают прослушивать сообщения учащихся («Применение воды в промышленности и быту», «Круговорот воды в природе»). Во второй половине урока учащиеся выполняют практическую работу (с. 88 учебника). Домашнее задание. Повторить темы «Кислород» и «Водород». УРОК 30 Вода. Анализ и синтез воды. Вода в природе и способы ее очистки Цель урока. Сформировать понятия об анализе и синтезе на примере изучения состава воды. Сформировать представления о способах очистки природной воды. Основные понятия. Анализ и синтез, перегонка (дистилляция), дистиллированная вода. Планируемые результаты обучения. Знать качественный и количественный состав воды. Уметь объяснять закон постоянства состава на примере воды. Знать способы очистки воды. Демонстрации. Перегонка воды. Краткое содержание урока. Данный урок можно провести в форме семинара. Достаточные сведения о воде учащиеся уже получили в рамках предмета «Окружающий мир» в младших классах и на уроках естественно-научных дисциплин в основной школе. Примерный план проведения семинара 1. Состав воды. Анализ и синтез воды. (Учащиеся должны уметь объяснять закон постоянства состава на примере воды. Анализ и синтез как методы познания состава вещества следует рассматривать во взаимосвязи.) 2. Выслушать и обсудить сообщение учащегося «Природная вода». 3. Очистка природной воды. (Учащиеся рассматривают схему водоочистительной станции (рис. 50 учебника), при этом необходимо вспомнить различные способы разделения смесей. Далее учитель разбирает получение дистиллированной воды и демонстрирует перегонку воды.) 4. Выслушать и обсудить сообщение учащегося «Охрана природных водоемов», используя урок 30 электронного пособия «Электронная библиотека „Просвещение“. Химия. 8 класс». 5. В качестве повторения проверить знание химических свойств кислорода и водорода. Домашнее задание. § 29 (с. 82—84), упр. 1—4 (с. 87), задача (с. 88). УРОК 31 Физические и химические свойства воды Цель урока. Изучить химические свойства воды. Начать формировать представления о важнейших классах неорганических соединений: кислотах и основаниях. Научить записывать уравнения реакций воды с активными металлами, оксидами металлов и неметаллов. Основные понятия. Гидроксиды металлов, основания, гидроксильная группа, кислоты, кислотный остаток. Планируемые результаты обучения. Уметь составлять уравнения реакций воды с некоторыми металлами и оксидами металлов и неметаллов. Демонстрации. Взаимодействие воды с натрием, магнием, оксидом кальция, оксидом фосфора(V). Краткое содержание урока. При изучении нового материала следует уделить особое внимание химическим свойствам воды. С физическими свойствами воды учащиеся уже знакомы. Можно выслушать сообщение «Три агрегатных состояния воды». Изучение химических свойств воды следует проводить экспериментально. Учитель демонстрирует опыты: 1) Взаимодействие воды с активными металлами (натрием). Учитель определяет продукты реакции, показывает, как записывать уравнения этой реакции (рекомендуем формулу воды записывать как Н—ОН, выделяя гидроксильную группу), вводит понятия «гидроксид металла», «основание». 2) Взаимодействие воды с менее активными металлами (магнием). 3) Взаимодействие воды с оксидами активных металлов (оксидом кальция). 4) Взаимодействие воды с оксидами неметаллов (оксидом фосфора(V)). В этом случае учитель вводит понятия «кислота», «кислотный остаток». Записывая уравнения химических реакций, учащиеся определяют типы реакций. Можно предложить учащимся оформить запись химических свойств воды в виде обобщающей таблицы.
Последним свойством можно записать уже известное уравнение реакции разложения воды электрическим током. Для закрепления знаний химических свойств воды в конце урока следует предложить учащимся следующие задания: Вариант I 1. Напишите три уравнения химических реакций, в которых вода была бы исходным веществом. 2. В эвдиометре взорвали смесь, состоящую из 6 мл водорода и 2 мл кислорода. Составьте уравнение проведенной реакции. Останется ли какой-либо газ в избытке и как это проверить? Вариант II 1. Напишите три уравнения химических реакций, в которых вода была бы продуктом реакции. 2. В эвдиометре взорвали смесь, состоящую из 2 мл водорода и 6 мл кислорода. Составьте уравнение этой химической реакции. Какой газ и в каком объеме останется в избытке? Как это проверить практически? Домашнее задание. § 29 (с. 84—87), упр. 5—7 (с. 87—88). УРОК 32 Контрольная работа по темам «Кислород», «Водород», «Растворы. Вода» Цель урока. Контроль знаний и умений по темам «Кислород», «Водород», «Растворы. Вода». Методические рекомендации. См. урок 18. Вариант I 1. Нарисуйте схему прибора, с помощью которого можно получить и собрать кислород в лаборатории методом вытеснения воды. 2. Перечислите области применения водорода. На каких физических или химических свойствах основано это применение? 3. Допишите уравнения химических реакций, укажите, какими из них можно воспользоваться для получения водорода. Назовите тип каждой реакции. а) СuО + Н2 б) Al + НСl в) Zn + ... 4. Допишите уравнения реакций, характеризующих химические свойства водорода: 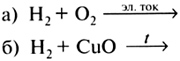 Укажите, окисляется или восстанавливается водород в этих реакциях. 5. Для засолки огурцов приготовили 5 кг 6%-ного раствора поваренной соли. Вычислите, какие массы соли и воды потребовались для приготовления этого раствора. Вариант II 1. Нарисуйте схему прибора, с помощью которого можно получить и собрать водород в лаборатории методом вытеснения воздуха. 2. В одном столбце приведенной ниже таблицы перечислены (под номерами 1—5) важнейшие области применения кислорода. Во втором столбце таблицы буквами А—Е обозначены свойства кислорода, лежащие в основе его применения. Приведите в соответствие записи таблицы.
|
