Учебник Г. Е. Рудзитиса, Ф. Г. Фельдмана Химия, 8
 Скачать 3.78 Mb. Скачать 3.78 Mb.
|
2. Очистить железные опилки от порошка серы можно
3. Правильно вложен фильтр в воронку для проведения опыта по разделению смеси на рисунке 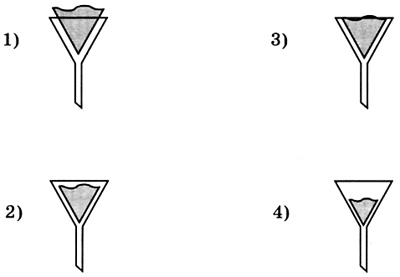 4. На приведенных ниже рисунках показан состав веществ, в которые могут входить химические элементы кислород, сера, углерод и железо. Один из рисунков не изображает состав сложного вещества — это 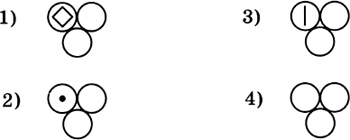 5. Только сложные вещества перечислены в ряду 1) воздух, вода, кислород 2) серная кислота, водород, озон 3) кислород, азот, хлор 4) поваренная соль, вода, сероводород 6. Какая запись обозначает, что молекула азота состоит из двух атомов? 1) 2N 2) N2 3) N2O 4) N2O3 7. В соединении с водородом валентность II всегда имеют химические элементы 1) S, N 2) О, S 3) О, С 4) S, Cl 8. Среди приведенных схем химических реакций к реакциям соединения относится 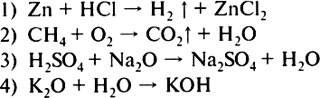 9. Массовая доля химического элемента фосфора в оксиде фосфора(V) равна 1) 19,2% 2) 36,4% 3) 43,7% 4) 100% 10. В результате окисления 3,2 г меди кислородом получен оксид меди(П) количеством вещества 1) 0,01 моль 2) 0,05 моль 3) 0,4 моль 4) 1,5 моль Вариант II 1. Покажите стрелкой вертикальной ( I
II
III
2. Фильтрованием можно разделить смесь 1) воды и сахара 2) воды и поваренной соли 3) воды и угольной пыли 4) воды и уксусной эссенции 3. Чтобы правильно погасить пламя спиртовки, нужно 1) подуть на пламя 2) надеть на пламя колпачок 3) накрыть пламя руками 4. На приведенных ниже рисунках показан состав веществ, в которые могут входить химические элементы железо, кислород, сера и медь. Состав простого вещества изображает рисунок  5. Только простые вещества перечислены в ряду 1) воздух, вода, кислород 2) серная кислота, водород, озон 3) кислород, азот, хлор 4) поваренная соль, вода, сероводород 6. Запись 2O2 обозначает 1) четыре атома кислорода 2) два атома кислорода 3) две молекулы кислорода 4) четыре молекулы кислорода 7. Валентность V азот имеет в каждом из веществ, указанных в ряду 1) N2O5, HNO3, HNO2 2) NH3, NO2, N2O5 3) KNO3, N2O5, HNO3 4) NH3, HNO3, NO 8. Среди приведенных схем химических реакций к реакциям разложения относится 1) Cu + Н2SO4 (конц.) 2) HgO 3) Н2 + O2 4) FеО + НСl 9. Массовая доля химического элемента натрия в сульфиде натрия равна 1) 0,28 2) 0,46 3) 0,59 4) 0,78 10. При полном сжигании алюминиевой фольги в 0,6 моль кислорода можно получить оксид алюминия количеством вещества 1) 0,4 моль 2) 1,2 моль 3) 3,5 моль 4) 4 моль ТЕМА 2 КИСЛОРОД (5 ч) УРОК 19 Кислород, его общая характеристика и нахождение в природе. Получение. Физические свойства кислорода Цель урока. Конкретизировать знания о химическом элементе и простом веществе. Повторить, какие свойства относятся к физическим, какие — к химическим. Сформировать представления о способах получения и собирания кислорода в лаборатории. Основные понятия. Химический элемент, простое вещество, физические свойства, катализаторы. Планируемые результаты обучения. Уметь различать понятия «химический элемент» и «простое вещество» на примере кислорода. Уметь характеризовать физические свойства кислорода и способы собирания кислорода. Демонстрации. Получение кислорода из перманганата калия, пероксида водорода. Собирание кислорода методом вытеснения воздуха и методом вытеснения воды. Краткое содержание урока. В начале урока необходимо провести анализ контрольной работы. Приступая к изучению новой темы, важно охарактеризовать кислород как один из важнейших для большинства живых организмов химических элементов. Этим и обусловлено то, что изучение простых веществ начинается с кислорода. Следует учесть, что многие вопросы уже изучены учащимися в курсах природоведения и биологии. Необходимо выяснить у учащихся, что им известно о кислороде. Изучение кислорода начинают с рассмотрения его как химического элемента и как простого вещества. Учитель дает план, в котором четко проявляется различие вышеупомянутых понятий. Этим планом необходимо пользоваться и в дальнейшем при изучении других химических элементов. План характеристики химического элемента 1. Химический знак. 2. Относительная атомная масса. 3. Валентность. 4. Распространенность элемента в природе. План характеристики простого вещества 1. Химическая формула. 2. Относительная молекулярная масса. 3. Физические свойства. 4. Химические свойства. 5. Применение. 6. Способы получения в лаборатории и в промышленности. 7. Нахождение в природе. Используя этот план, учащиеся самостоятельно характеризуют кислород как химический элемент. При характеристике кислорода как простого вещества надо знать его физические свойства. Для этого надо получить это вещество и наблюдать его физические свойства. Вначале необходимо дать историческую справку об открытии кислорода английским ученым Дж. Пристли, а затем получить кислород из перманганата калия и показать учащимся способы собирания кислорода, при этом обязательно надо обратить внимание на технику безопасности выполнения опытов и выяснить, на каких физических свойствах основаны способы собирания кислорода. Изучение понятия «катализатор» можно осуществить при обсуждении демонстрационного опыта — получения кислорода из пероксида водорода. Домашнее задание. § 18, 19, 20 (физические свойства кислорода), упр. 1—3, задача 1 (с. 59—60). УРОК 20 Химические свойства кислорода. Применение. Круговорот кислорода в природе Цель урока. Изучить химические свойства кислорода. Закрепить знания учащихся о реакциях соединения и отработать умения составлять соответствующие химические уравнения. Сформировать первые представления о реакциях окисления. Основные понятия. Химические свойства, реакция соединения, горение, окисление, оксиды. Планируемые результаты обучения. Знать химические свойства кислорода. Уметь различать физические и химические свойства, составлять уравнения реакций кислорода с фосфором, серой, углем и железом. Уметь объяснять круговорот кислорода в природе. Лабораторный опыт. Ознакомление с образцами оксидов. Демонстрации. Горение углерода, серы, фосфора, железа в кислороде. Краткое содержание урока. На этом уроке учащиеся впервые начинают знакомиться с химическими свойствами простого вещества — кислорода. Учитель должен показать отличие физических и химических свойств и что понимается под химическими свойствами (способность веществ превращаться в другие под воздействием определенных условий: при изменении температуры, давления и т. д.). Изучение химических свойств кислорода учитель проводит на основе демонстрационных опытов. Так как для опытов потребуется большое количество кислорода, то на демонстрационном столе должен находиться газометр, наполненный кислородом. Учитель обращает внимание учащихся на этот прибор, при этом необходимо задать вопрос: на каком свойстве кислорода основан способ его хранения? Далее учитель демонстрирует опыты горения угля, серы, фосфора, железа в кислороде, обращает внимание учащихся на условия и признаки химических реакций, отмечает, как эти вещества горят на воздухе и в чистом кислороде. На доске после каждого опыта один из учащихся записывает уравнения проделанных химических реакций. В конце демонстраций учащиеся приходят к выводу, что горение простых веществ в кислороде относится к реакциям соединения. В результате этих реакций образуются сложные вещества, которые состоят из двух элементов, одним из которых является кислород, т. е. образуются оксиды. Учащиеся получают первоначальные сведения об оксидах, выполняют лабораторный опыт 8 (с. 69 учебника). Затем дается понятие реакции окисления. Для закрепления нового материала можно предложить учащимся самостоятельно записать несколько уравнений реакций окисления простых веществ кислородом. Если позволяет время, то следует обратить внимание на горение сложных веществ в кислороде. В результате реакции образуются также оксиды, но тип реакции будет уже другой, его рассматривают позже. Если нет времени, то взаимодействие кислорода со сложными веществами можно рассмотреть на уроке «Горение и медленное окисление». Изучая применение кислорода, учитель прослеживает зависимость между свойствами кислорода и областями его применения. Домашнее задание. § 20, 21, упр. 4—12, задачи 2, 3 (с. 60). УРОК 21 Практическая работа 3 «Получение и свойства кислорода» Цель урока. Ознакомить с одним из способов получения кислорода в лаборатории и его химическим свойством — способностью поддерживать горение простых веществ. Научить собирать газ в сосуд вытеснением воздуха и воды. Совершенствовать умение работать с простейшими приборами при нагревании. Планируемые результаты обучения. Уметь собирать простейший прибор для получения газа, проверять его на герметичность, укреплять прибор в штативе, обращаться с нагревательными приборами. Уметь собирать газ вытеснением воды и воздуха. Краткое содержание урока. Этот урок очень важен для формирования практических умений. Учащиеся впервые самостоятельно проводят практическую работу. Учителю следует напоминать им, что после выполнения каждого опыта необходимо записывать в тетрадь наблюдения и выводы. Учащиеся оформляют отчет о работе в виде таблицы. Инструкция по выполнению данной работы дана в учебнике (с. 70). Домашнее задание. Повторить § 18—21. УРОК 22 Воздух и его состав. Защита атмосферного воздуха от загрязнений Цель урока. Сформировать понятие о воздухе как смеси, состоящей из простых и сложных веществ. Познакомить учащихся с экологическими проблемами, связанными с загрязнением воздуха, и показать необходимость охраны атмосферного воздуха. Основные понятия. Простые и сложные вещества, смеси. Планируемые результаты обучения. Знать состав воздуха как смеси, состоящей из простых и сложных веществ. Понимать проблемы, связанные с охраной атмосферного воздуха. Демонстрации. Определение состава воздуха (сжигание фосфора под колоколом). Краткое содержание урока. В начале урока следует актуализировать знания учащихся о физических и химических свойствах кислорода, о лабораторных способах его получения, о применении кислорода. Для этого учитель проводит фронтальную беседу, а отдельным учащимся дает индивидуальные задания. Объяснение нового материала следует начать с вопроса о составе воздуха. Этот вопрос был объектом исследований в течение многих веков. Лишь в конце XVIII века ученые-естествоиспытатели Дж. Пристли, А. Лавуазье и К. Шееле установили, что воздух — это смесь газов, из которых наиболее важными являются кислород и азот. Учитель рассматривает исторический опыт А. Лавуазье по определению состава воздуха (рис. 35, с. 61 учебника). Опыт А. Лавуазье позволил судить о составе воздуха как с качественной, так и с количественной стороны: в воздухе содержится примерно 4/5 азота и 1/5 кислорода (по объему). Затем учитель демонстрирует горение фосфора под колоколом. При этом вода в колоколе поднимается примерно на 1/5, так как при горении фосфора расходуется только кислород. Далее учитель рассказывает, что в конце XIX века ученым удалось уточнить состав воздуха. Кроме азота и кислорода, в состав воздуха входят благородные (инертные) газы, оксид углерода(IV) и водяные пары. Учащиеся рассматривают таблицу 6 (с. 61 учебника). Один из учащихся может выступить с заранее подготовленным сообщением о применении благородных газов (возможно использование видеофрагментов урока 9 электронного пособия «Электронная библиотека „Просвещение“. Химия. 8 класс»). Далее учитель отмечает, что процентное содержание углекислого газа в воздухе непостоянно. Оно может меняться в зависимости от конкретной местности. Учащиеся могут пояснить это высказывание. Здесь уместно рассказать о парниковом эффекте, используя фрагменты урока 12 вышеупомянутого пособия. Материал урока позволяет перейти к экологическим проблемам — охране атмосферного воздуха от загрязнений. Домашнее задание. § 22 (с. 60—62), § 24 (с. 68), упр. 1—4 (с. 69). Подготовить сообщение «Воздушная среда нашей местности». УРОК 23 Горение и медленное окисление. Тепловой эффект химических реакций Цель урока. Развивать знания учащихся о химических свойствах кислорода при рассмотрении процессов горения и медленного окисления, о значении этих процессов для природы и человека. Сформировать понятия о тепловом эффекте химических реакций, экзо- и эндотермических реакциях. Основные понятия. Горение, медленное окисление, тепловой эффект химических реакций, экзо- и эндотермические реакции. Планируемые результаты обучения. Уметь объяснять различие между горением и медленным окислением. Уметь записывать термохимическое уравнение реакции и вычислять количество теплоты по термохимическому уравнению реакции. Демонстрации. Горение спирта в фарфоровой чашке. Тушение пламени. Краткое содержание урока. В начале урока после проверки домашнего задания учитель рассматривает горение сложных веществ в кислороде (если этот вопрос еще не рассматривался). Изучение горения и медленного окисления можно организовать в форме самостоятельной работы по учебнику (с. 63—64). После прочтения этого материала учитель проводит обсуждение следующих вопросов: чем различается горение в кислороде и на воздухе? Каковы условия возникновения и прекращения горения, способы тушения горящих веществ (демонстрирует горение спирта и его тушение)? В чем сущность медленного окисления? Кроме этого, можно обсудить вопросы экологического характера, как вести себя в лесу, как разводить костры во время походов. В конце беседы учащимся предлагается составить таблицу «Сравнение горения и медленного окисления»
После этого учитель переходит к рассмотрению теплового эффекта химических реакций, экзо- и эндотермических реакций, обращает внимание на запись уравнений реакций. В термохимических уравнениях в отличие от обычных химических уравнений обязательно указывают агрегатное состояние вещества (твердое, жидкое, газообразное). Алгоритм решения расчетных задач по термохимическим уравнениям приведен в § 23 учебника. Домашнее задание. § 22 (с. 62—64), § 23, упр. 5—13, задачи 1, 2 (с. 69). ТЕМА 3 ВОДОРОД (3 ч) УРОК 24 Водород, его общая характеристика и нахождение в природе. Получение водорода в лаборатории и его физические свойства |
