Учебник Г. Е. Рудзитиса, Ф. Г. Фельдмана Химия, 8
 Скачать 3.78 Mb. Скачать 3.78 Mb.
|
В-10. Установите соответствие между исходными веществами (веществом) и продуктами химических реакций.
В-11. Вставьте в схемы уравнений химических реакций недостающие формулы веществ. 1) ... + KOH 2) ... + НСl 3) HNO3 + KOH 4) ... + ... В-12. Допишите уравнения химических реакций, протекающих при нагревании. 1) Mg(OH)2 2) Аl(ОН)3 3) Fe(OH)3 4) Cu(OH)2 С-13. С какими из перечисленных веществ: вода, оксид углерода(IV), азотная кислота, гидроксид кальция, поваренная соль — может вступать в реакцию: а) оксид кальция: б) оксид фосфора(V); в) оксид кремния(IV)? Запишите уравнения возможных химических реакций. С-14. В трех склянках без этикеток находятся оксиды: в одной — оксид кальция, в другой — оксид меди(II), в третьей — оксид фосфора(V). Как их можно распознать? С-15. Составьте уравнения химических реакций, соответствующих схеме 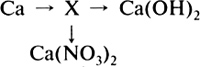 ТЕМА 6 ПЕРИОДИЧЕСКИЙ ЗАKOH И ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д. И. МЕНДЕЛЕЕВА. СТРОЕНИЕ АТОМА (8 ч) УРОК 42 Классификация химических элементов. Амфотерные соединения Цель урока. Сформировать понятие о классификации химических элементов на примерах естественных семейств щелочных металлов, галогенов, благородных газов. Научить доказывать амфотерный характер оксидов и гидроксидов. Основные понятия. Классификация, группы сходных элементов, амфотерность. Планируемые результаты обучения. Знать общие признаки классификации химических элементов на примере групп сходных элементов. Уметь характеризовать зависимость свойств щелочных металлов, галогенов и их соединений от относительной атомной массы. Знать определение амфотерности, уметь экспериментально доказывать амфотерность предложенного оксида и гидроксида. Демонстрации. Образцы щелочных металлов и галогенов. Лабораторный опыт. Взаимодействие гидроксида цинка с растворами кислот и щелочей. Краткое содержание урока. Рассматривая классификацию химических элементов, необходимо пояснить учащимся, что развитие любой науки проходит ряд этапов: изучение и накопление фактов, их классификацию, выявление связи между установленными фактами и на основании этого более полное их познание. В химии накопление знаний об элементах и их соединениях привело к необходимости их группировки по сходным признакам. В доступной для учащихся форме можно рассказать о классификациях химических элементов, предложенных разными учеными (И. Деберейнер, Дж. Ньюлендс, Л. Майер). Необходимо подробно остановиться на разделении всех элементов на металлы и неметаллы, ввести понятие амфотерности. Учащиеся должны выполнить лабораторный опыт 18 (с. 138 учебника), сделать вывод, что гидроксид цинка имеет двойственный характер, сформулировать определения амфотерных оксидов и гидроксидов. Можно продемонстрировать учащимся условную запись: Zn(OH)2 = H2ZnO2 Далее учителю необходимо сформировать понятие о группах сходных элементов (щелочные металлы, галогены, благородные металлы), рассмотреть их общие свойства по таблице 16 (с. 118 учебника). Учащиеся должны уметь описывать свойства трех семейств элементов. Уже на этом этапе можно начать формировать умение характеризовать зависимость свойств щелочных металлов, галогенов и их соединений от относительной атомной массы. Это очень важно для понимания периодического закона Д. И. Менделеева. Домашнее задание. § 34, упр. 1—3 (с. 122), подготовить 20 карточек к уроку 43. УРОК 43 Периодический закон Д. И. Менделеева Цель урока. Сформировать понятие о периодичности в изменении свойств химических элементов. Показать, что открытый Д. И. Менделеевым периодический закон является фундаментальным законом природы. Основные понятия. Порядковый номер элемента, периодичность. Планируемые результаты обучения. Знать формулировку периодического закона. Уметь приводить примеры периодического изменения свойств химических элементов и их соединений. Демонстрации. Взаимодействие оксидов Na, Mg, P, S с водой, исследования свойств полученных продуктов. Краткое содержание урока. Во время фронтальной беседы необходимо сконцентрировать внимание примерно на таких вопросах и заданиях: 1. Охарактеризуйте физические свойства натрия. К какому классу простых веществ его можно отнести? 2. Составьте формулы важнейших соединений натрия (оксид, гидроксид). Как можно опытным путем доказать их характер? 3. Охарактеризуйте физические свойства фосфора. К какому классу простых веществ его можно отнести? 4. Составьте формулы важнейших соединений фосфора (оксид, гидроксид). Как можно опытным путем доказать их характер? 5. Получите опытным путем гидроксид цинка и докажите его характер. 6. Первые попытки классификации химических элементов. После проверки домашнего задания учащихся следует подвести к открытию периодического закона Д. И. Менделеевым. Для этого необходимо подчеркнуть, что в основу классификации Д. И. Менделеев положил главную в то время известную величину — атомный вес (в настоящее время мы рассматриваем изменение свойств в зависимости от относительной атомной массы химического элемента). Учитель вводит понятие «порядковый (атомный) номер» химического элемента и вместе с учащимися анализирует таблицы 16 и 17 учебника, пользуясь текстом на с. 120—121. Возможен и другой вариант. Предварительно можно дать задание на дом: используя данные таблицы 16 (с. 118 учебника), подготовить набор карточек для 20 элементов по образцу: 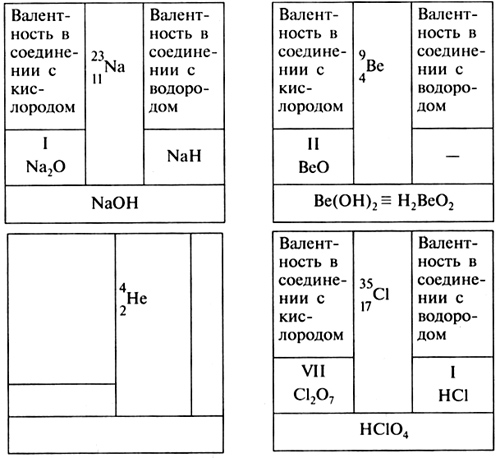 Если элемент имеет оксид и гидроксид основного характера, то нижняя полоска закрашивается синим цветом, если кислотного характера, то полоска закрашивается красным цветом. Амфотерный гидроксид — полоска закрашивается синим и красным. Используя эти карточки, можно проанализировать изменение свойств простых веществ и их соединений с увеличением относительной атомной массы химического элемента и подойти к понятию «периодичность». Важно обратить внимание учащихся на то, что Д. И. Менделеев в отличие от других ученых сравнивал несходные семейства элементов. Учитель приводит формулировку периодического закона и отмечает, что Д. И. Менделеев пришел к выводу: периодическое изменение свойств простых веществ, а также формы и свойства соединений элементов зависят не столько от относительной атомной массы, сколько от другой величины, которая в то время была неизвестна (с. 122 учебника). Домашнее задание. § 35, упр. 4, 5, задача (с. 122). УРОК 44 Периодическая таблица химических элементов Цель урока. Обобщить знания о структуре периодической системы химических элементов. Начать формирование умения характеризовать химический элемент по его положению в периодической таблице. Основные понятия. Малые и большие периоды, группа, подгруппы: главная (А-группа) и побочная (Б-группа). Планируемые результаты обучения. Знать определения периода, группы, главной и побочной подгрупп, тенденций изменения свойств простых веществ и соединений химических элементов в периодах, главных и побочных подгруппах периодической системы. Уметь характеризовать химический элемент по положению в периодической таблице. Краткое содержание урока. Урок рекомендуется начать с изучения нового материала. Учитель рассматривает структуру периодической таблицы химических элементов, учащиеся анализируют, как изменяются металлические и неметаллические свойства простых веществ и основные и кислотные свойства их соединений в периодах, главных подгруппах (А-группах). Затем учитель дает информацию о длинном варианте периодической таблицы. Подводя итог, учитель сообщает учащимся план характеристики химического элемента по его положению в периодической таблице элементов, который в дальнейшем будет расширяться и уточняться. План характеристики химического элемента по положению его в периодической таблице элементов 1. Название химического элемента. Химический знак этого элемента. 2. Положение в периодической таблице (порядковый номер, номер периода (малый, большой), номер группы, подгруппа (главная, побочная). 3. Металл или неметалл. 4. Высшая валентность в кислородных соединениях, формула высшего оксида, гидроксида и характер их свойств. 5. Валентность в водородном соединении, формула летучего водородного соединения (для неметаллов). Учащиеся на нескольких примерах закрепляют умение характеризовать химический элемент по положению в периодической таблице. Домашнее задание. § 36, упр. 1—4. УРОК 45 Строение атома. Изотопы. Химический элемент Цель урока. Обобщить знания учащихся о составе атома и атомного ядра. Раскрыть физический смысл порядкового номера химического элемента в периодической таблице. Сформировать понятия о химическом элементе и изотопах. Основные понятия. Порядковый номер, заряд ядра атома, электрон, протон, нейтрон, химический элемент, изотопы. Планируемые результаты обучения. Знать состав атомного ядра, определения изотопов, химического элемента как вида атомов с одинаковым зарядом ядра. Уметь находить число протонов, нейтронов, электронов указанного атома. Краткое содержание урока. В начале урока рекомендуется дать учащимся самостоятельную работу для проверки усвоения изученного материала. Вариант I 1. Даны химические элементы с порядковыми номерами 11, 14, 17. Какой из них образует простое вещество — металл? 2. Выпишите в строчку знаки химических элементов с порядковыми номерами 2—7. Подчеркните наиболее ярко выраженный неметалл. Составьте формулы типичных соединений для химических элементов с порядковыми номерами 3, 4 и 7. Отметьте характер их оксидов (основный, амфотерный или кислотный). 3. Назовите химический элемент, который образует водородное соединение типа H2R и находится в 3-м периоде периодической системы химических элементов Д. И. Менделеева. Укажите его порядковый номер. Составьте формулу его высшего оксида, отметьте характер его водного раствора. Вариант II 1. Даны химические элементы с порядковыми номерами 16, 17, 19. Какой из них образует простое вещество с наиболее выраженными неметаллическими свойствами? 2. Выпишите в строчку знаки химических элементов с порядковыми номерами 10—17. Назовите среди них наиболее типичный металл. Составьте формулы типичных соединений для химических элементов с порядковыми номерами 11, 13 и 16. Укажите характер их оксидов (основный, амфотерный или кислотный). 3. Химический элемент образует высший оксид R2O7 и находится в 3-м периоде периодической системы Д. И. Менделеева. Назовите этот химический элемент и его порядковый номер. Отметьте характер (основный или кислотный) его оксида, составьте формулу его летучего водородного соединения. При изучении нового материала следует использовать знания учащихся о строении атома, полученные на уроках физики. Учитель вводит понятия об элементарных частицах (электрон, протон, нейтрон), ядре атома, изотопах, раскрывает физический смысл порядкового номера. Необходимо обратить внимание учащихся на правильную форму обозначения изотопа (массовое число ставится слева от химического знака вверху, заряд ядра — слева внизу). Уточняется понятие «химический элемент». Следует дать учащимся несколько упражнений на нахождение числа протонов, нейтронов и электронов в атоме. Можно составить с учащимися обобщающую таблицу:
Знакомство с понятием «изотопы» дает возможность ответить на вопрос, почему в некоторых случаях (Ar и K, Со и Ni, Fe и I) надо было отступить от общего принципа и расположить эти элементы в периодической таблице не в порядке возрастания их относительных масс. Все перестановки элементов в периодической таблице объясняются разным соотношением легких и тяжелых изотопов. Затем учитель объясняет, почему относительная атомная масса большинства химических элементов выражается дробным числом. В конце урока можно кратко рассказать о ядерных реакциях. В проведении этого урока методическую помощь может оказать электронное пособие «Электронная библиотека „Просвещение“. Химия. 8 класс», уроки 18—20. Домашнее задание. § 37 (с. 125—129), упр. 1—3 (с. 138). Подготовить сообщения на темы: 1. Тяжелая вода. 2. Искусственная радиоактивность. 3. Использование радиоактивных элементов. УРОК 46 Строение электронных оболочек атомов Цель урока. Сформировать представления об электронном строении атомов на примере 20 химических элементов периодической таблицы. Основываясь на теории электронного строения атома, рассмотреть современную формулировку периодического закона. Основные понятия. Электронная оболочка, энергетический уровень (электронный слой), главное квантовое число, валентные электроны, завершенный электронный слой. Планируемые результаты обучения. Знать современную формулировку периодического закона, физический смысл номеров периода и группы, причину периодического изменения химических свойств первых 20 элементов. Уметь объяснять периодическое изменение свойств химических элементов в свете теории строения атомов, составлять схемы строения атомов первых 20 элементов. Краткое содержание урока. Содержание этого урока отличается высоким уровнем абстракции. При объяснении нового материала все время надо вовлекать учащихся в беседу, используя межпредметные связи. Можно воспользоваться содержанием урока 18 электронного пособия «Электронная библиотека „Просвещение“. Химия. 8 класс». Особое внимание надо уделить формированию умений составлять схемы строения атомов первых 20 химических элементов. Надо пояснить учащимся, что электроны в совокупности образуют электронную оболочку атома. Электронная оболочка атома состоит из электронных слоев. В каждом электронном слое находятся электроны с близкими значениями энергии, поэтому электронные слои называют энергетическими уровнями. Максимальное число электронов, находящихся на определенном энергетическом уровне, можно вычислить по формуле 2n2, где п — номер энергетического уровня. На основании электронной теории строения атома необходимо развить у учащихся представления о причинах и закономерностях изменения свойств химических элементов и их соединений. Объясняя учащимся закономерности заполнения электронами энергетических уровней (электронных слоев) атомов элементов, важно подчеркнуть, что количественные изменения переходят в качественные скачкообразно. Учащиеся должны проследить, как изменяются свойства простых веществ и их соединений (металличность и неметалличность, основные и кислотные свойства) по периоду и в главных подгруппах, а также должны объяснить причины этих изменений. В конце объяснения нового материала учитель подводит учащихся к мысли, что заряд ядра атома является главной характеристикой химического элемента, и дает современную формулировку периодического закона Д. И. Менделеева. Далее учитель дополняет план характеристики химического элемента по его положению в периодической таблице пунктами: 1. Состав ядра атома. 2. Электронное строение атома. Домашнее задание. § 37 (с. 129—132), упр. 4—6 (с. 138). УРОК 47 Состояние электронов в атомах Цель урока. Сформировать представления о состоянии электрона в атоме — электронной плотности, атомной орбитали. Научить составлять электронные формулы атомов. Основные понятия. Электронное облако, орбиталь, форма орбиталей, электронная формула атома. Планируемые результаты обучения. Иметь представления о двойственной природе электрона и состоянии электронов в атоме. Уметь составлять электронные формулы атомов. Демонстрации. Плакат «Формы электронных орбиталей». Краткое содержание урока. Данный урок является логическим продолжением предыдущего урока. Подробно этот материал будет изучаться в 10—11 классах. Поэтому можно дать краткую информацию о состоянии электронов в атоме: рассказать о двойственной природе электрона, ввести понятие «атомная орбиталь», рассмотреть формы орбиталей (s- и p-орбитали). Далее учитель учит учащихся составлять электронные формулы первых 20 элементов. Учащиеся делают выводы, что к главным подгруппам (А-группам) относят те элементы, у которых очередные электроны помещаются на s- и p-орбиталях. Такие элементы называют s- и p-элементами. К побочным подгруппам (Б-группам) относят элементы, очередные электроны которых помещаются на d-орбиталях. Это d-элементы. С изображением электронных формул атомов химических элементов с помощью квантовых ячеек в 8 классе знакомить учащихся необязательно. Домашнее задание. § 37 (с. 132—135). Нескольким учащимся подготовить сообщения о жизни и деятельности Д. И. Менделеева. УРОК 48 Значение периодического закона. Жизнь и деятельность Д. И. Менделеева Цель урока. Сформировать представления о научно-практическом значении периодического закона. Планируемые результаты обучения. Знать о роли периодического закона для обобщения и объяснения уже известных и предсказания новых фактов. Уметь показать его значение для развития науки и техники. Краткое содержание урока. После фронтальной проверки домашнего задания учитель переходит к новой теме. Учитель рассказывает, что периодический закон химических элементов Д. И. Менделеева — это один из наиболее общих законов природы, которому подчиняются все химические элементы. Важно подчеркнуть, что закон — объективная реальность, существующая в природе независимо от сознания человека. Для того чтобы учащиеся лучше осознали значение закона и поняли, почему периодический закон стал инструментом научного предвидения и целенаправленного поиска новых химических элементов и их соединений, следует рассказать им об истории открытия скандия, галлия и германия. Далее учитель рассказывает, что периодический закон сыграл большую роль в создании современной теории строения атомов, которая, в свою очередь, явилась его подтверждением. Здесь можно попросить учащихся, чтобы они прокомментировали это положение. В заключение урока учащиеся выслушивают сообщения своих одноклассников о жизни и деятельности Д. И. Менделеева. Если в кабинете есть кинофильм «Периодический закон Д. И. Менделеева», то желательно урок закончить просмотром этого фильма. Домашнее задание. § 38, 39, упр. 7 (с. 158). Повторить § 34—39, подготовиться к семинарскому занятию. УРОК 49 Повторение и обобщение по теме «Периодический закон и периодическая система химических элементов Д. И. Менделеева. Строение атома» |
