|
|
Учебное пособие Часть I самара Самарский государственный технический университет 2007
2. ЛАБОРАТОРНЫЙ ПРАКТИКУМ
2.1. Идентификация аминокислот и белков
2.1.1. Общие качественные реакции аминокислот
Термины «общие качественные реакции» и «специфические качественные реакции» приемлемы в отношении аминокислот. Общие реакции характерны для всех аминокислот, а специфические – только для отдельных. В то же время специфические реакции для аминокислот являются общими для многих, хотя и не для всех белков, потому что в их состав входит широкий круг аминокислот. Например, все белки, содержащие тирозин, можно определить специфической реакцией Фолина-Чиокалтеу на тирозин. Большинство белков содержит аминокислоты с ароматическими ядрами, поэтому практически все белки будут давать положительную ксантопротеиновую реакцию. В то же время общие реакции на белок являются специфическими в отношении других классов природных веществ – липидов, углеводов и т.д.
Опыт 1. Реакция с азотистой кислотой. В две пробирки помещают по 1 мл 1%-ных растворов глицина и альбумина. В каждую пробирку добавляют по 1 мл 5%-ного раствора нитрита натрия, затем по 0,5 мл уксусной кислоты и осторожно встряхивают. Объясните наблюдаемые явления.
Контрольные вопросы
1. Напишите уравнение реакции глицина с нитритом натрия и уксусной кислотой.
2. В основе какого метода количественного анализа аминокислот лежит эта реакция? Можно ли этот метод использовать для анализа белка?
3. Реагирует ли нитрит натрия с уксусной кислотой с выделением газа? Можно ли вместо уксусной кислоты использовать HCl или H2SO4?
4. Почему при действии нитрита натрия и уксусной кислоты на раствор белка той же концентрации, что и раствор аминокислоты, газовыделение гораздо меньше?
Опыт 2. Биуретовая реакция. В две пробирки помещают по
1 мл 1%-ных растворов глицина и альбумина. В каждую пробирку добавляют по 1 мл 10%-ного раствора едкого натра и по стенке добавляют 4-5 капель 2%-ного раствора сульфата меди. В пробирке с аминокислотой появляется синее окрашивание, а с белком – фиолетовое. Объясните наблюдаемые явления.
Контрольные вопросы
1. Напишите уравнения реакций глицина и биурета с сульфатом меди в щелочной среде.
2. В основе каких методов количественного анализа аминокислот и белков лежит биуретовая реакция?
3. Реагирует ли сульфат меди с едким натром в отсутствие аминокислоты или белка? Какое проявление при этом наблюдается?
4. Почему белки дают более глубокое окрашивание, чем аминокислоты, при реакции с солями меди?
5. Дают ли пептиды такое же окрашивание, что и белки?
6. Какова роль едкого натра в этой реакции? Реагируют ли аминокислоты и белки с CuSO4, CuСO3 без добавления едкого натра?
Опыт 3. Реакция с нингидрином. В три пробирки помещают по 1 мл 1%-ных растворов глицина, γ-аминомасляной кислоты (ГАМК) и альбумина. В каждую пробирку добавляют 2 капли 1%-ного водного раствора нингидрина. Пробирки нагревают почти до кипения в течение 1-2 мин. Во всех пробирках появляется окрашивание, но не везде одинаковое. Объясните наблюдаемые явления.
Контрольные вопросы
1. Напишите уравнения реакций глицина и ГАМК с нингидрином.
2. В основе каких методов количественного анализа аминокислот и белков лежит реакция с нингидрином?
3. В чем заключается химическая сущность работы аминокислотного анализатора?
4. Появится ли окраска при проведении реакции нингидрина с глицином в кислой или щелочной среде?
5. При попадании раствора нингидрина на кожу через некоторое время появляются несмываемые сине-фиолетовые пятна. Как это объяснить?
6. Все ли аминокислоты дают с нингидрином сине-фиолетовое окрашивание?
Опыт 4. Реакция с формальдегидом. В две пробирки помещают по 2 мл 1%-ных водных растворов глицина и альбумина, в третью пробирку помещают 4 мл формалина. В каждую из пробирок добавляют по одной капле раствора индикатора метилового красного. Во все пробирках появится желтое окрашивание. Затем желтый раствор формалина из третьей пробирки разделите поровну и каждую половину добавьте к желтым растворам глицина и альбумина. В пробирке с глицином смесь окрасится в красный цвет. Объясните наблюдаемые явления.
Контрольные вопросы
1. Напишите уравнение реакции глицина с формальдегидом.
2. Какими кислотно-основными свойствами обладает продукт реакции глицина с формальдегидом?
3. Почему окраска в пробирке с раствором альбумина практически не изменилась?
4. Можно ли эту реакцию использовать для количественного определения аминокислот алкалимитрическим методом в водной среде?
5. Чему равна молярная масса эквивалента глутаминовой кислоты при определении её методом формольного титрования по Сёренсену?
2.1.2. Специфические качественные реакции аминокислот
Опыт 5. Ксантопротеиновая реакция. В четыре пробирки помещают по 1 мл 1%-ных водных растворов глицина, фенилаланина и альбумина и 1%-ного раствора тирозина в 1М серной кислоте.
В каждую пробирку добавляют 4 капли концентрированной азотной кислоты и осторожно нагревают на кипящей водяной бане 1-2 мин до появления окрашивания. Охлаждают под струей водопроводной воды. Зарегистрируйте произошедшие на этом этапе изменения (появление окрашивания, осадка, отсутствие изменений). Сначала в пробирку с тирозином добавляют 10%-ный раствор едкого натра
1,5 мл до изменения окраски. Затем такой же объем щелочи добавляют в остальные пробирки. Зарегистрируйте произошедшие изменения и объясните наблюдаемые явления.
Контрольные вопросы
1. Напишите уравнения реакций тирозина и фенилаланина с азотной кислотой.
2. Напишите уравнение реакции нитротирозина с едким натром.
3. Будет ли ксантопротеиновая реакция положительной для таких пептидов, как глютатион и ангиотензин I?
4. Какие природные соединения мешают определению белка этим методом?
5. Почему при попадании азотной кислоты на кожу на ней появляются несмываемые желтые пятна?
6. Можно ли с помощью этого метода отличить фенилаланин от тирозина и тирозин от триптофана?
Опыт 6. Реакция Миллона. В три пробирки помещают по 1 мл 1%-ных водных растворов фенилаланина и альбумина и 0,05%-ного водного раствора тирозина. В каждую пробирку добавляют по 3 капли реактива Миллона и смесь медленно нагревают до начинающегося кипения. Охлаждают и через 10 мин регистрируют появившиеся изменения. Объясните наблюдаемые явления.
* Приготовление реактива Миллона. Растворяют 1 вес.ч. ртути в 2 вес. ч. Концентрированной азотной кислоты (ρ 1,42) сначала на холоду, затем при нагревании. Раствор разбавляют двукратным количеством воды и через несколько часов фильтруют.
Контрольные вопросы
1. Напишите уравнения реакций тирозина с компонентами реактива Миллона.
2. Можно ли с помощью этого метода отличить фенилаланин от тирозина?
3. Какие природные соединения мешают определению тирозина этим методом?
4. Предложите альтернативный способ приготовления реактива Миллона.
Опыт 7. Реакция с реактивом Эрлиха. В три пробирки помещают по 1 мл 1%-ных водных растворов глицина, триптофана и гидрохлорида анилина. В каждую пробирку добавляют по 0,5 мл 2%-ного раствора n-диметиламинобензальдегида в 5%-ной хлористоводородной кислоте и выдерживают при комнатной температуре несколько минут или слегка нагревают теплой водой до появления окрасок. Объясните наблюдаемые явления.
Контрольные вопросы
1. Напишите уравнения реакций глицина и анилина с n-диметиламинобен-зальдегидом.
2. Предложите объяснение возникновения более глубокой окраски при взаимодействии реактива Эрлиха с триптофаном по сравнению с другими аминокислотами.
3. Можно ли эту реакцию использовать для открытия остатка триптофана в белке?
Опыт 8. Реакция Сакагучи. В четыре пробирки помещают по
1 мл 1%-ных водных растворов глицина, стрептомицина сульфата, аргинина и альбумина В каждую пробирку добавляют по 0,5 мл свежеприготовленного 0,2%-ного раствора α-нафтола в 10%-ном растворе едкого натра, перемешивают и затем добавляют 1 мл раствора гипобромида натрия. В некоторых пробирках появляется оранжево-красное окрашивание. Объясните наблюдаемые явления.
Контрольные вопросы
1. Напишите уравнение реакции аргинина с α-нафтолом в присутствии едкого натра и гипобромида натрия.
2. Можно ли вместо α-нафтола в этой реакции использовать, например, 8-оксихинолин или другие фенолы?
3. Какая функциональная группа молекулы аргинина обуславливает реакцию Сакагучи?
4. Объясните, почему стрептомицина сульфат, не являющийся аминокислотой, дает положительную реакцию Сакагучи, а аминокислота глицин – нет.
5. Можно ли в реакции Сакагучи использовать другие окислители вместо гипобромида, и если можно, то какие?
Опыт 9. Реакция с нитропруссидом натрия. В две пробирки помещают по 10-20 мг цистина и цистеина и по 1 мл 1М раствора едкого натра, а в третью – 1 мл 1%-ного водного раствора альбумина. В каждую пробирку добавляют по 1 мл раствора нитропруссида натрия, перемешивают и наблюдают появление окрасок. Объясните наблюдаемые явления.
Контрольные вопросы
1. Напишите уравнение реакции цистеина с нитропруссидом натрия.
2. В связи с чем для создания щелочной среды в этой реакции используется аммиак, а не раствор едкого натра?
3. Можно ли с помощью этой реакции установить, в какой форме находится глютатион – окисленной или восстановленной?
4. Будет ли положительной нитропруссидная реакция на метионин и цистин, если их щелочные растворы предварительно прокипятить?
5. Какие вещества мешают определению цистеина с помощью этой реакции?
Опыт 10. Реакция Фоля. В пробирку помещают 0,5 мл 5%-ного раствора ацетата свинца и по каплям прибавляют 30%-ный раствор гидроксида натрия до растворения первоначально образующегося осадка. Затем к полученному раствору добавляют 0,5 мл исследуемого раствора белка с концентрацией 1-10 мг/мл и кипятят 1-2 мин. Появляется темное окрашивание или осадок. Объясните наблюдаемые явления.
Контрольные вопросы
1. Остатки каких аминокислот в молекуле белка обуславливают положительную реакцию Фоля?
2. Напишите уравнения реакций, происходящих при открытии белка по методу Фоля.
3. Можно ли в этой реакции использовать аммиак вместо едкого натра?
4. Можно ли с помощью реакции Фоля отличить цистеин от цистина и метионина?
Опыт 11. Реакция Паули. В две пробирки помещают по 1 мл 1%-ных водных растворов гистидина и альбумина и добавляют в каждую по 1 мл 1М раствора едкого натра. Затем в пробирки добавляют по 0,5 мл свежеприготовленного реактива Паули* и перемешивают. Сразу же появляется красная окраска. Объясните наблюдаемые явления.
* Приготовление раствора Паули. Готовят 1%-ный раствор сульфаниловой кислоты в 1М HCl и 5%-ный водный раствор нитрита натрия и выдерживают их в холодильнике. Равные объёмы этих растворов смешивают непосредственно перед применением (смешанный раствор – реактив Паули – годен лишь несколько часов даже при хранении в холодильнике).
Контрольные вопросы
1. Какое действующее вещество реактива Паули?
2. Реактив Паули нестоек. Что с ним происходит при хранении?
3. Напишите уравнение реакции гистидина с реактивом Паули.
4. На наличие остатков каких аминокислот в молекуле белка указывает положительная реакция Паули?
5. Дает ли тирозин положительную реакцию Паули?
6. Мешают ли определению гистидина катехоламины, например адреналин?
7. Можно ли с помощью реакции Паули отличить гистидин от гистамина?
Опыт 12. Реакция с резорцином на глутаминовую кислоту и глутамин. В небольшую фарфоровую чашечку помешают 10-15 мг глутаминовой кислоты (если исследуется раствор, то его упаривают в этой же чашечке) и 10-15 мг резорцина. К смеси добавляют 1 каплю концентрированной серной кислоты и, перемешивая стеклянной палочкой, осторожно нагревают до образования плава красного цвета (под тягой). Охлаждают и подщелачивают раствором аммиака. Плав растворяется, и раствор приобретает красно-фиолетовую окраску. Объясните наблюдаемые явления.
Контрольные вопросы
1. Напишите уравнения реакций, происходящих при сплавлении глутаминовой кислоты с резорцином в присутствии серной кислоты.
2. Почему при подщелачивании плава происходит углубление окраски? Можно ли вместо аммиака использовать для подщелачивания раствор едкого натра?
3. Дают ли такую же реакцию близкие по строению к глютаминовой кислоте и глютамину аспарагиновая кислота и аспарагин?
4. Можно ли с помощью этой реакции открыть глутаминовую кислоту, входящую в состав белка?
5. При нагревании α-аминокислот они образуют дикетопиперазины. А что происходит при нагревании глютаминовой кислоты?
2.1.3. Хроматографические методы разделения
и идентификации аминокислот и белков
Хроматография – один из современных методов разделения, очистки, выделения и идентификации аминокислот, пептидов и белков. Метод основан на различном распределении веществ между двумя фазами: неподвижной, которая может быть твердой или жидкой, и подвижной фазой – потоком жидкости или газа, несущим анализируемую смесь веществ. Хроматографические методы классифицируются по характеру взаимодействий, лежащих в основе разделения, по агрегатному состоянию фаз, по технике выполнения анализа и аппаратурному оформлению.
По принципу разделения хроматографические методы делятся на адсорбционные, распределительные, ионообменные и гель-фильтрацию.
В основе адсорбционных методов лежит явление адсорбции на поверхности твердых тел, и поэтому основными параметрами, определяющими эффективность разделения веществ, являются коэффициент адсорбции и в меньшей степени растворимость в подвижной фазе. В распределительных методах хроматографии фактором, определяющим эффективность разделения, является константа распределения вещества между фазами; в ионообменных – константа диссоциации вещества, заряд молекулы и ее ионный диаметр; в гель-фильтрации – эффективный диаметр молекулы.
По агрегатному состоянию фаз, технике анализа и его аппаратурному оформлению различают адсорбционную газовую, газожидкостную (ГЖГ), высокоэффективную жидкостную (ВЭЖХ), бумажную (БХ), тонкослойную (ТСХ), колоночную и другие виды хроматографии.
В анализе аминокислот и полипептидов, включая белки, наибольшее распространение получили методы БХ, ТСХ, ВЭЖХ и гель-фильтрации. Для анализа аминокислот и низкомолекулярных пептидов широко применяются БХ и ТСХ на стандартных пластинках «Silufol», вследствие достаточно высокой эффективности разделения, простоты аппаратурного оформления и анализа. Из приборных методов анализа аминокислот основным является метод ионообменной хроматографии, лежащий в основе работы аминокислотного анализатора. Для анализа белков и крупных пептидов широко используется гель-фильтрация.
Ионообменная хроматография. Основу этого метода составляет ионное взаимодействие между веществом и неподвижной фазой.
В качестве неподвижной фазы используются ионообменные смолы, нерастворимые в воде и органических растворителях. В зависимости от того, с какими ионами взаимодействует ионообменная смола, различают катиониты (взаимодействуют с катионами) и аниониты (взаимодействуют с анионами):
R -AnˉH+ + Na+ R-AnˉNa+ + H+ -AnˉH+ + Na+ R-AnˉNa+ + H+
Катионит
R -Kt+OHˉ + Clˉ R-Kt+Clˉ + OHˉ -Kt+OHˉ + Clˉ R-Kt+Clˉ + OHˉ
Анионит
Разделение вешеств происходит потому, что константы равновесия в указанных процессах для разных веществ разные.
Наиболее распространенными ионизированными группами катионитов являются сульфо– и карбоксильная группы. Аниониты в качестве ионизированной группы содержат первичную, вторичную, третичную или четвертичную аммонийные группы. Полимерным каркасом ионитов часто служат «сшитые» сополимеры стирола и дивинилбензола. В биохимической практике широко используются иониты на основе простых эфиров целлюлозы – карбоксиметилцеллюлоза (КМЦ) и диэтиламиноэтилцеллюлоза (ДЭАЭ-целлюлоза), в которых ионогенными группами являются –CH2COOH и -CH2CH2NH(C2H5)2+OHˉ группы соответственно.
Этот метод осуществляется обычно в колоночном варианте. Он прочно вошел в арсенал аналитических методов биохимии. Типичным примером использования метода является разделение сложных смесей аминокислот, получаемых в результате гидролиза белков, на катионитах. Аминокислоты, связанные с катионитом, элюируют (вымывают из колонки) хлористоводородной кислотой. При этом аминокислоты выходят из колонки в определенной последовательности в зависимости от их кислотно-основных свойств:
R -AnˉH+ + H2NCHRCOOH R-AnˉH3N+CHRCOOH -AnˉH+ + H2NCHRCOOH R-AnˉH3N+CHRCOOH
связывание аминокислоты с катионитом
R -AnˉH3N+CHRCOOH + H+ R-AnˉH+ + H3 N+CHRCOOH -AnˉH3N+CHRCOOH + H+ R-AnˉH+ + H3 N+CHRCOOH
элюирование аминокислоты
На этом принципе основана работа автоматического аминокислотного анализатора. Элюирование в этом приборе осуществляется растворами с изменяющимся по определенной программе значением рН, что позволяет разделить смеси всех белковых аминокислот на одной колонке за один раз.
На рис. 2.1 приведена хроматограмма продуктов гидролиза рибонуклеазы, полученная на аминокислотном анализаторе.
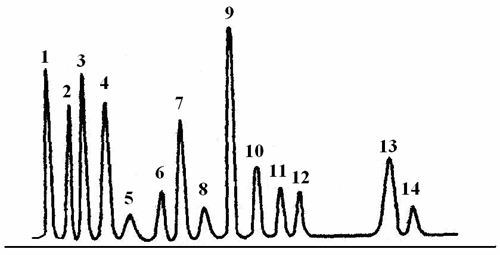
1 – Asp, 2 – Thr,
3 – Ser, 4 – Glu
5 – Pro, 6 – Gly,
7 – Ala, 8 – Cys,
9 – Val, 10 – Met,
11 – Ile, 12 – Leu,
13 – Tyr, 14 – Phe.
Время удерживания
Р и с.2.1. Хроматограмма продуктов гидролиза рибонуклеазы |
|
|
 Скачать 1.81 Mb.
Скачать 1.81 Mb.
