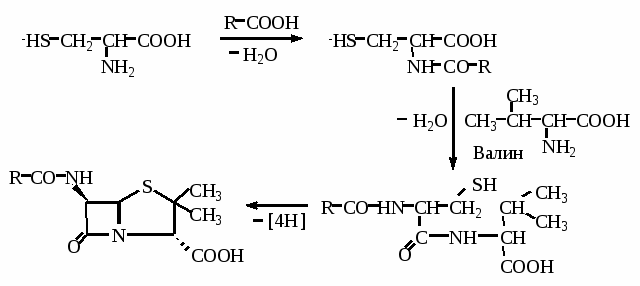Учебное пособие Часть I самара Самарский государственный технический университет 2007
 Скачать 1.81 Mb. Скачать 1.81 Mb.
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Аминокислоты и образующиеся из них биогенные амины | Формула биогенного амина | Функции биогенных аминов в организме |
| Серин Коламин Холин Ацетилхолин | HOCH2CH2NH2 HOCH2CH2N(CH3)3ОН CH3COOCH2CH2N(CH3)3ОН | Входит в состав кефалина Входит в состав лецитина Медиатор, нейромедиатор |
| Цистеин Цистеамин | HSCH2CH2NH2 | Структурный элемент КоА и пантетеина |
| Аспарагиновая кислота β-Аланин | H2NCH2CH2COOH | Структурный элемент КоА |
| Триптофан 5-Окситриптофан Серотонин |  | Медиатор, нейромедиатор |
| Гистидин Гистамин |  | Медиатор |
| Тирозин 3,4-Диоксифенил аланин (ДОФА) Дофамин Норадреналин Адреналин |   | Нейромедиатор Медиатор, нейромедиатор гормон Медиатор, нейромедиатор гормон |
| Треонин Аминопропанол | CH3CHOHCH2NH2 | Составная часть витамина В12 |
| Глутаминовая кислота (ГАМК) | H2NCH2CH2CH2COOH | Нейромедиатор |
| Аргинин Агматин Путресцин Спермидин Спермин |   | Компонент рибосом Компонент рибосом, трупный яд Компонент рибосом Компонент рибосом |
| Лизин Кадаверин | H2NCH2CH2CH2CH2CH2NH2 | Компонент рибосом, трупный яд |
Нейромедиаторы и медиаторы. Термином медиатор обозначают вещества, передающие нервное возбуждение через синаптическую щель от одной клетки периферической нервной системы к соседней. Нейромедиаторы – это вещества, воздействующие на постсинаптическую мембрану синапса центральной нервной системы и вызывающие ее деполяризацию (передача нервного импульса) или, напротив, гиперполяризацию (торможение передачи нервного импульса). К нейромедиаторам относятся некоторые аминокислоты, а также пептиды, белки и биогенные амины (см. табл. 1.2).
В связи с этим в клетках головного мозга идет активный метаболизм аминокислот. В головном мозге концентрация аминокислот, в особенности выполняющих функции нейромедиаторов, в 7-8 раз выше, чем в плазме крови. Наиболее высоким является уровень глутаминовой и аспарагиновой аминокислот (5-10 ммоль и 2-3 ммоль соответственно).
К аминокислотам, выполняющим функции нейромедиаторов, относятся глицин, аспарагиновая кислота, глутаминовая кислота, ГАМК и ДОФА.
Метаболиты. Углеродные скелеты 20 протеиногенных аминокислот превращаются в процессе метаболизма в семь различных продуктов деградации.
1. Пировиноградная кислота – глицин, аланин, серин, цистеин, треонин,
(пируват) триптофан, метионин.
2. Щавелево-уксусная кислота – аспарагин, аспарагиновая кислота.
(оксалоацетат)
3. Фумаровая кислота – фенилаланина, тирозин.
(фумарат)
4. Сукцинил-КоА – изолейцин, Валин.
5. 2-Оксоглутаровая кислота – глутаминовая кислота, глутамин,
(2-оксоглутарат) гистидин, аргинин, пролин.
6. Ацетил-КоА – лейцин, лизин; изолейцин.
7. Ацетоуксусная кислота – лейцин, лизин, фенилаланин, тирозин,
(ацетоацетат) триптофан.
Пять метаболитов (пируват, оксалоацетат, фумарат, сукцинил-КоА, 2-оксоглутарат) являются предшественниками в процессе синтеза глюкозы (глюконеогенез). Аминокислоты, деградация которых дает один из пяти указанных выше метаболитов, называются глюкогенными аминокислотами. За исключением лейцина и лизина все остальные 18 протеиногенных аминокислот являются глюкогенными.
Ацетил-КоА и ацетоацетат не могут включаться в глюконеогенез. Они используются организмами для синтеза жирных кислот, изопреноидов и кетоновых тел (ацетон, ацетоуксусная кислота, 3-гидроксимасляная кислота). Аминокислоты, которые образуют ацетил-КоА или ацетоацетат, называют кетогенными аминокислотами. Фактически только кетогенными являются лейцин и лизин, а такие аминокислоты, как изолейцин, фенилаланин, тирозин и триптофан, могут быть и глюкогенами и кетогенами.
1.1.3. Физико-химические свойства аминокислот
В кристаллическом состоянии аминокислоты находятся в виде биполярных ионов (цвиттерионов). Вследствие этого они имеют высокие температуры плавления и большинство из них растворимы в воде лучше, чем в спирте (табл.1.3).
В водном растворе аминокислоты также присутствуют, главным образом, в виде цвиттерионов, которые находятся в равновесии с неионизированной формой, например, для глицина соотношение равновесных концентраций неионизированной и цвиттерионной форм равно 1:260000:

Неионизированная форма Цвиттерионная форма
Дикарбоновые аминокислоты и диаминокарбоновые кислоты существуют в водных растворах в виде смесей неионизированных и различно заряженных форм. Например, аспарагиновая кислота существует в виде следующих форм с соотношением концентраций:

1 600 1 28 000
В случае лизина устанавливается следующее равновесие:
 16
16320 000 1 1 800 000
Аминокислоты гораздо лучше растворимы в водных растворах кислот и щелочей, чем в воде, что обусловлено их амфотерностью.
В кислой среде аминокислота ведет себя как основание с константой диссоциации сопряженной кислоты Ka (α-NH2) и заряжается положительно, а в щелочной – как кислота с константой диссоциации Ka (α-COOH) и заряжается отрицательно:

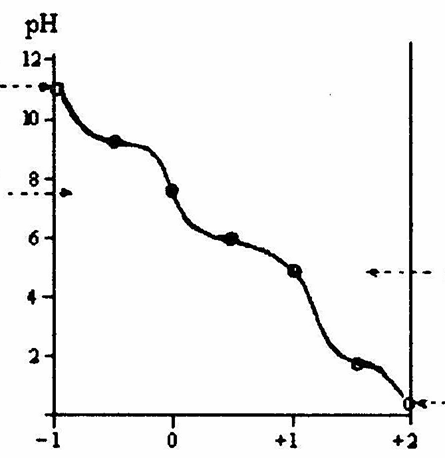
Поскольку в аминокислотах содержатся как минимум две ионогенные группы, суммарный заряд молекул зависит от pH среды. Проиллюстрируем зависимость заряда аминокислоты от рН на примере гистидина, содержащего три ионогенные группы. На рис. 1.4 приведена кривая титрования гистидина сильной кислотой и щелочью, на которой отмечаются три точки перегиба, соответствующие трем ионизирующимся группировкам (COOH, NH2, имидазольное кольцо).




Р и с.1.4. Кривая титрования гистидина сильной кислотой и щелочью
Таблица 1.3
Физические свойства L-аминокислот
| L-Аминокислота | Растворимость, г/100 мл, вода, 25ºС | [α]D25, вода | Тпл, (с разл.),ºС |
| Глицин | 24,99 | - | 232-236 |
| Аланин | 16,54 | +1,8º | 315-316 |
| Серин | 5,02 | −7,5 | 228 |
| Цистеин | - | −16,5 | 178** |
| Аспарагиновая кислота | 0,50 | +5,0 | 270 |
| Аспарагин | 3,11 | −5,6 | 233 |
| Фенилаланин | 2,97 | −34,5 | 283 |
| Тирозин | 0,05 | −10,0* | 290-295 |
| Триптофан | 1,14 | −33,7 | 293-295 |
| Гистидин | 4,29 | −38,5 | 287-288 |
| Валин | 8,85 | +5,6 | 315 |
| Треонин | 20,50 | −28,5 | 253 |
| Метионин | 3,35 | −9,8 | 280-282 |
| Глутаминовая кислота | 0,84 | +12,6 | 247-249 |
| Глутамин | 3,60 | +6,3 | 184 |
| Лейцин | 2,19 | −11,0 | 293-295 |
| Изолейцин | 4,12 | +12,4 | 285-286 |
| Аргинин | Очень хорошая | +12,5 | 244 |
| Лизин | Очень хорошая | +13,5 | 224 |
| Пролин | 162,30 | −86,2 | 220-222 |
Как видно из рис. 1.4, заряд молекулы гистидина изменяется при изменении рН от – 1 (рН >11,2) до +2 (рН < 0,2). Точка с рН 9,20 соответствует рКа α-аминогруппы, с рН 6,00 – рКа имидазольного кольца, с рН 1,77 – рКа карбоксильной группы (табл. 1.4). При рН 7,60 гистидин находится в растворе только в форме цвиттериона, и общий заряд каждой из молекул гистидина равен 0.
Значение рН, при котором аминокислота электронейтральна, называется изоэлектрической точкой (рI). При этом значении рН (его иногда обозначают рНi ) молекула аминокислоты представляет собой биполярный ион. Если через водный раствор аминокислоты пропустить постоянный электрический ток, то при значениях рН, более низких, чем рI, аминокислота будет двигаться к катоду, при более высоких рН – к аноду, и в изоэлектрической точке не будет перемещаться. Поскольку изоэлектрические точки различных аминокислот отличаются друг от друга (см. табл.1.4), то таким путем возможно осуществить разделение смеси аминокислот. На этих особенностях поведения аминокислот в постоянном электрическом поле основан метод электрофореза.
Как уже отмечалось выше, по величине рIможно судить о преобладании кислых или основных свойств у данной аминокислоты. Чем меньше величина рI, тем более кислыми свойствами она обладает, и наоборот, чем больше – тем более основными. Аминокислоты с величиной рIменьше 5 принято относить к кислым, больше 7 – к основным, в зоне 5-7 – к нейтральным.
Рассмотрим возможность использования физико-химических свойств аминокислот для их идентификации и количественного анализа.
α-Аминокислоты не имеют четких температур плавления или разложения, вследствие чего эти константы представляют ограниченную ценность для их идентификации. Это обусловлено тем, что при их нагревании происходят реакции конденсации с отщеплением воды и образованием смеси пептидов и 2,5-дикетопиперазинов:

2
 ,5-дикетопиперазины
,5-дикетопиперазиныВсе протеиногенные аминокислоты, за исключением глицина, оптически активны и могут быть идентифицированы по величине удельного вращения ([α]D25). Однако при этом следует иметь в виду, что величина удельного вращения и даже её знак сильно зависят от рН раствора. Например, сравните величины [α]D25 для аланина, фенилаланина и метионина, приведенные в табл. 1.3, с величинами [α]D25 для этих же аминокислот, измеренные в растворах хлористоводородной кислоты – +14,7 (1М HCl), -7,1 (5,4М HCl) и +21,2 (0,2М HCl) соответственно. В связи с этим этот метод приемлем лишь для идентификации индивидуальных аминокислот и неприемлем для анализа смесей аминокислот.
Таблица 1.4
Кислотно-основные свойства протеиногенных аминокислот
| L-Аминокислота | pKa | pI | ||
| α-СООН | α-NH2 | Другие группы | ||
| Глицин | 2,34 | 9,60 | - | 5,97 |
| Аланин | 2,34 | 9,60 | - | 6,00 |
| Серин | 2,21 | 9,15 | - | 5,68 |
| Цистеин | 1,71 | 8,33 | | 5,07 |
| Аспарагиновая кислота | 1,88 | 9,60 | 3,65 (β-COOH) | 2,77 |
| Аспарагин | 2,02 | 8,80 | - | 5,41 |
| Фенилаланин | 2,58 | 9,24 | - | 5,91 |
| Тирозин | 2,20 | 9,11 | | 5,63 |
| Триптофан | 2,38 | 9,39 | - | 5,89 |
| Гистидин | 1,77 | 9,20 | 6,00 (имидазол) | 7,60 |
| Валин | 2,32 | 9,69 | - | 5,96 |
| Треонин | 2,71 | 9,62 | - | 6,16 |
| Метионин | 2,28 | 9,21 | - | 5,74 |
| Глутаминовая кислота | 2,19 | 9,67 | 4,25 (γ-COOH) | 3,08 |
| Глутамин | 2,17 | 9,13 | - | 5,65 |
| Лейцин | 2,36 | 9,60 | - | 6,04 |
| Изолейцин | 2,32 | 9,76 | - | 6,02 |
| Аргинин | 2,18 | 9,08 | 13,2 (гуанидин) | 10,76 |
| Лизин | 2,18 | 8,95 | 10,5 (ε-NH2) | 9,74 |
| Пролин | 1,99 | 10,60 | - | 6,30 |
Существенный прогресс в идентификации и количественном анализе сложных смесей аминокислот, образующихся при гидролизе белков, достигнут благодаря работам Мура и Стайна. Разработанный ими аминокислотный анализатор, в основе которого лежит метод ионообменной хроматографии, позволяет легко проводить качественный и количественный анализ и инструментальное детектирование этих соединений. Химической основой работы аминокислотного анализатора является реакция аминокислот с нингидрином, которая будет описана в п. 1.4.. Для идентификации аминокислот очень удобны также распределительная хроматография фенилизотиоцианатных производных аминокислот, тонкослойная хроматография и хроматография на бумаге.
ИК-, ПМР-спектроскопия и масс-спектрометрия также могут быть использованы для идентификации индивидуальных аминокислот. Масс-спектральный анализ аминокислот ограничен их низкой летучестью, и их обычно переводят в более летучие производные (эфиры, ацетамиды и др.).
1.1.4. Химические свойства аминокислот
Химические свойства аминокислот определяются в первую очередь наличием в геминальном положении амино– и карбоксильной групп. Специфика бокового радикала аминокислоты (ароматические и гетероциклические циклы, дополнительные амино– и карбоксильные группы, OH– и SH-группы) определяет различия в реакционной способности при типичных превращениях, а также возможность осуществления специфических реакций. В связи с этим целесообразно химические свойства аминокислот классифицировать следующим образом: реакции с участием карбоксильной группы, с участием аминогруппы, с одновременным участием карбоксильной и аминогрупп, специфические реакции отдельных аминокислот.
1.1.4.1. РЕАКЦИИ С УЧАСТИЕМ КАРБОКСИЛЬНОЙ ГРУППЫ

 1-Аминоциклопропанкарбоновая кислота
1-Аминоциклопропанкарбоновая кислота  еленоцистеин (активный центр
еленоцистеин (активный центр