Лис - Пропедевтика внутренних болезней (1). Учебное пособие для студентов лечебного, педиатрического, медикопсихологического факультетов допущено Министерством образования
 Скачать 7.2 Mb. Скачать 7.2 Mb.
|
|
Клинические проявления острого лейкоза Независимо от формы ОЛ в его развитии можно выделить следующие «большие синдромы». 1. Гиперпластический, или синдром лейкемической пролиферации, обусловленный опухолевым ростом как в костном мозге, так и вне его за счет метастазирования. Клинически синдром проявляется увеличением селезенки, печени, лимфоузлов, поражением кожи в виде лейкозных инфильтратов (лейкемидов), мозговых оболочек и вещества головного мозга (нейролейкоз), почек, миокарда, легких. 2. Анемический синдром. 3. Геморрагический синдром, проявляющийся различными видами кровоточивости. 4. Интоксикационный синдром, проявляющийся снижением массы тела, лихорадкой, потливостью, выраженной общей слабостью. Начало заболевания разное: - в ½ случаев – острое, часто протекает под видом ангины, гриппа, ОРЗ; - у 10% заболевание дебютирует в виде профузных кровотечений; - в 20% случаев начало без конкретной симптоматики. При этом еще до обращения к врачу больные начинают отмечать нарастающую слабость, утомляемость, боли в костях, мышцах, суставах, появление «синяков» на коже; - в 52% случаев заболевание обнаруживается при случайном исследовании крови (медосмотр, диспансеризация и т.д.). В развернутую стадию заболевания И.А. Кассирский условно выделяет следующие клинические варианты острого лейкоза: 1. Септический. Характеризуется высокой температурой с большими суточными колебаниями, ознобами, проливными потами, выраженным сердцебиением, одышкой, геморрагическими высыпаниями на коже и слизистых, восковидно-желтым оттенком кожных покровов, увеличением печени и селезенки. Гипертермия объясняется, с одной стороны, присоединением вторичной инфекции, так как бластные клетки не выполняют защитной, фагоцитарной функции; а с другой стороны - образованием большого количества пирогенных веществ из быстро распадающихся лейкозных клеток. 2. Язвенно-некротический вариант. Проявляется изъязвлениями и некрозами слизистых оболочек ротовой полости, миндалин, глотки, пищевода, желудка и кишечника, иногда и половых путей у женщин. Начало этой формы проявляется обычной ангиной с болями в горле, затруднением глотания, повышением температуры тела и признаками интоксикации. Однако вскоре катаральный процесс переходит в язвенно-некротический, распространяется за пределы дужек на мягкое и твердое небо и заднюю стенку глотки. Аналогичные изменения могут выявляться и в других вышеуказанных местах. 3. Геморрагический вариант. Характеризуется появлением кровоизлияний в кожу и слизистые, а также повышенной кровоточивостью из носа, десен, мочеполовой сферы, желудочно-кишечного тракта и других органов и систем. Описаны неостанавливающиеся кровотечения после экстракции зуба, аборта, оперативных вмешательств. Чаще всего геморрагический синдром связан с тромбоцитопенией, развивающейся в результате подавления тромбоцитарного ростка кроветворения лейкозными клетками. Геморрагии при остром лейкозе могут проявляться петехиями (точечными кровоизлияниями на поверхности тела) или экхимозами (распространенными кровоподтеками различной формы и величины). Довольно часто кровоизлияния происходят в конъюктиву и сетчатку глаза, что проявляется прогрессирующим ухудшением или полной потерей зрения. При кровоизлиянии в яичники развивается клиника острого живота, в головной мозг – парезами и параличами. 4. Анемический вариант. Напрямую связан с геморрагическим синдромом, ибо развивающаяся анемия чаще связана с повторяющимися кровотечениями и по своему генезу является постгеморрагической. Причиной малокровия при ОЛ может быть также угнетение эритропоэза бластными клетками, а также повышенный гемолиз эритроцитов. Больные жалуются на общую слабость, головокружение, шум в ушах, потемнение в глазах, мелькание мушек перед глазами, потливость, похолодание конечностей, сердцебиение, обморочные состояния. При осмотре кожа и слизистые оболочки бледные с восковидным или желтушным оттенком. Пульс частый, нитевидный, артериальное давление снижено. На верхушке сердца, нередко и на основании выслушивается анемический шум, шум «волчка» на яремных венах. Железистая форма ОЛ. Чаще наблюдается в молодом возрасте при лимфобластном его варианте и характеризуется генерализованным увеличением подчелюстных, надключичных, подмышечных, паховых, мезентериальных, забрюшинных или медиастинальных лимфоузлов. Величина их от 2-3мм до нескольких сантиметров в диаметре, они единичные или, чаще, множественные в виде пакетов или конгломератов. При пальпации они плотноэластической консистенции, не спаяны с кожей и между собой и, чаще всего, безболезненные. Увеличение лимфоузлов, селезенки и печени при ОЛ фактически является одним из проявлений внекостномозговой локализации лейкемического процесса и отражает процесс его генерализации. Лейкемическая инфильтрация со временем может наблюдаться в коже и в других внутренних органах. Лейкемиды кожи представляют собой уплотнения кожи вследствие инфильтрации ее бластными элементами крови. Чаще всего они множественные, округлой или овальной формы, величиной от нескольких миллиметров до 2-3см в диаметре, несколько приподнимающиеся над поверхностью кожи, розоватого или светло-коричневого оттенка, безболезненные при ощупывании. Лейкемическое поражение легких проявляется сухим кашлем и одышкой. Перкуторно определяется расширение корня легких, при вовлечении плевры – притупление в заднее-нижних отделах грудной клетки. Аускультативно – жесткое дыхание с удлиненным выдохом, рассеянные сухие хрипы. В задненижних отделах легких дыхание ослабленное везикулярное, иногда выслушивается крепитация. Рентгенологически определяется усиление легочного рисунка, утолщение плевры или накопление жидкости в полости плевры. Лейкемическое поражение миокарда проявляется неприятными ощущениями в области сердца, колющими или ноющими болями, сердцебиением, перебоями в работе сердца, одышкой и отеками на ногах, характерными для развивающейся сердечной недостаточности. При осмотре больные бледные, акроцианоз; перкуторно определяется увеличение границ относительной тупости сердца влево; аускультативно - ослабление 1 тона на верхушке сердца. На ЭКГ – снижение вольтажа зубцов и особенно зубца Т, который часто становится отрицательным. Лейкемическое поражение головного мозга (нейролейкемия) проявляется чаще всего менингиальным синдромом. Больные жалуются на головные боли, нарушения болевой и тактильной чувствительности. Выявляются признаки корешкового синдрома, парапареза ног, расстройства дефекации и мочеиспускания. Нейролейкемия нередко сопровождается появлением тошноты и рвоты, ригидности затылочных мышц, снижением остроты зрения (вплоть до полной слепоты). Довольно характерным для острого лейкоза являются оссалгии – боли в зубах, челюстях, костях туловища и конечностей. Часто больные впервые обращаются к дантисту по поводу зубных болей. Удаление зуба при этом сопровождается неостанавливающимся кровотечением из лунки зуба. Выполняемый по этому поводу общий анализ крови позволяет констатировать гематологическую картину острого лейкоза. В течении острого лейкоза выделяют несколько стадий: 1. Начальная. Она оценивается чаще всего ретроспективно. 2. Развернутая: первая атака; ремиссия (полная или неполная); рецидив болезни; второй рецидив и т.д. 3. Терминальная. К полной ремиссии относят состояния, при которых после лечения в пунктате костного мозга обнаруживается не более 5% бластных клеток, количество лейкоцитов не менее 1500, а тромбоцитов – не менее 100000 в 1мл крови. Неполная ремиссия характеризуется исчезновением бластных клеток из крови при сохранении бластоза костного мозга. Выздоровлением от острого лейкоза считается полная ремиссия на протяжении 5 лет и более. Рецидивом болезни считается появление бластных клеток в пунктате костного мозга более 5% или возобновление внекостномозговой лейкемической инфильтрации любой локализации. Терминальная стадия острого лейкоза характеризуется отсутствием эффекта от цитостатической терапии, нарастанием угнетения других ростков кроветворения (тромбоцито- и эритропения), что сопровождается выраженной анемией, геморрагическими проявлениями и общими признаками несостоятельности органов дыхания, кровообращения и центральной нервной системы. Лабораторная диагностика ОЛ В периферической крови снижается количество эритроцитов и гемоглобина, развивается анемия. Количество лейкоцитов в начале процесса чаще всего снижено (лейкопения), однако, встречаются случаи и с лейкоцитозом. В мазке крови преобладают бластные клетки и зрелые формы лейкоцитов при отсутствии промежуточных форм созревающих клеток. Это явление обозначается как лейкемическое зияние, или провал (hyatus leucaemicus). СОЭ при ОЛ увеличена до 60-70 мм/час, количество тромбоцитов снижено. Последнее, наряду с уменьшением количества эритроцитов и лейкоцитов, объединяется в понятие «цитопенический синдром», а его клиническими проявлениями являются выраженная анемия, кровотечения и др. В пунктате костного мозга 80-90% лейкозных (бластных) клеток, вытеснивших другие клеточные элементы. Хронический миелолейкоз В 1845 году Р. Вирхов описал больную 55 лет, умершую от заболевания крови. На вскрытии он обнаружил резко увеличенную селезенку и наличие в сердце и сосудах желтовато-сероватой массы, напоминающей гной. Микроскопическое исследование последнего выявило в нем большое количество элементов белой крови, увеличение которых Вирхов связал с первичным поражением селезенки и назвал это заболевание белокровием (Leukemia). В 1870г. Neuman доказал, что первично при этом заболевании поражается не селезенка, а костный мозг. Болезнь получила название «миелоидная лейкемия». В настоящее время это заболевание обозначается как «миелоидный лейкоз». Хронический миелоидный лейкоз относится к миелопролиферативным опухолям кроветворной системы, возникающим из ранних клеток - предшественниц миелопоэза (нейтрофильного ряда), сохраняющих способность дифференцироваться до зрелых клеток. Основной клеточный субстрат хронического миелолейкоза составляют созревающие и зрелые клетки гранулоцитов, преимущественно нейтрофилы. Хронический миелолейкоз встречается преимущественно в возрасте от 20 до 60 лет чаще у мужчин. Этиология этого заболевания созвучна в целом с этиологией гемобластозов. Речь идет прежде всего о врожденных или приобретенных хромосомных дефектах. В 86-88% случаев при хроническом миелолейкозе во всех клетках костного мозга, за исключением лимфоцитов, обнаруживается Ph-хромосома, она вдвое меньше обычной. Впервые ее нашли при миелолейкозе Nowell и Hurigezford в 1969г. в Филадельфии, откуда и произошло ее название – Ph-хромосома (филадельфийская). Приобретенные хромосомные нарушения (транслокации, делеции и др.) возникают, как уже упоминалось ранее, под влиянием мутагенных факторов (радиация, химические факторы, лекарственные воздействия, вирусы). Мутировавшие клетки в последующем начинают усиленно делиться и весь кроветворный аппарат костного мозга переключается на продукцию одной какой-то клетки (процесс клонирования), которые подавляют другие ростки кроветворения. Клинические проявления хронического миелолейкоза В течении этого заболевания выделяют три стадии: 1 стадия – начальная. Характеризуется миелоидной пролиферацией только костного мозга и небольшими изменениями в периферической крови без явлений интоксикации. 2 стадия – развернутая. Проявляется выраженными клинико-гематологическими проявлениями (миелоидная пролиферация костного мозга и других внутренних органов, выраженные изменения в периферической крови, признаки интоксикации). 3 стадия – терминальная. Соответствует развитию поликлоновой опухоли. Характеризуется развитием абсолютной рефрактерности к проводимой цитостатической терапии, значительным увеличением печени и, особенно, селезенки, общим истощением, дистрофическими изменениям внутренних органов, подавлением других ростков кроветворения (выраженная анемия, тромбоцитопения, геморрагический синдром и др.). Начальная стадия заболевания протекает с маловыраженными клиническими признаками и сопровождается выраженным астеническим синдромом: немотивированная общая слабость, быстрая утомляемость, повышенная потливость, потеря аппетита, нарушение сна, по которым трудно заподозрить системное заболевание крови. Лимфоузлы, печень и селезенка не увеличены. Однако уже в эту стадию при проведении традиционного анализа крови, помимо зрелых форм нейтрофилов, могут выявляться миелоциты, метамиелоциты, промиелоциты и миелобласты, что может стать решающим фактором в диагностике хронического миелолейкоза. Анемия на раннем этапе развития заболевания не характерна. Замечено, что уже в начальную стадию хронического миелолейкоза выявляется базофильно-эозинофильная ассоциация, т.е. одновременное увеличение базофилов (более 2%) и эозинофилов (свыше 9%) в периферической крови. Развернутая стадия хронического миелолейкоза, наряду с клиническим признаками начального периода, характеризуется дальнейшим развитием миелопролиферативного синдрома, который выходит за рамки костного мозга и распространяется на лимфоузлы, печень, селезенку. Кроме того, очаги миелоидной пролиферации появляются в других внутренних органах. Нарастают признаки анемии и интоксикации. Больные жалуются на выраженную общую слабость, головокружение, шум в ушах, потемнение в глазах, обусловленные анемическим синдромом. Отмечается периодическое повышение температуры, обусловленное повышенным клеточным распадом, оссалгии, артралгии, боли в левом и правом подреберьях. П  ри общем осмотре в эту стадию отмечается бледность кожи и слизистых оболочек, довольно часто наблюдается лимфаденопатия, проявляющаяся увеличением и уплотнением шейных, подмышечных и паховых лимоузлов. Пункция или биопсия выявляют лейкемическую миелоидную инфильтрацию лимфоузлов миелобластами, промиелоцитами, миелоцитами и, даже, сегментоядерными нейтрофилами. ри общем осмотре в эту стадию отмечается бледность кожи и слизистых оболочек, довольно часто наблюдается лимфаденопатия, проявляющаяся увеличением и уплотнением шейных, подмышечных и паховых лимоузлов. Пункция или биопсия выявляют лейкемическую миелоидную инфильтрацию лимфоузлов миелобластами, промиелоцитами, миелоцитами и, даже, сегментоядерными нейтрофилами.Увеличение селезенки (спленомегалия) – наиболее характерный признак хронического миелолейкоза. Она иногда достигает очень больших размеров, занимая большую часть брюшной полости, достигая нижним полюсом малого таза. Селезенка плотная, что обусловлено, Рис.74. Увеличение печени и селезенки при хроническом миелолейкозе помимо лейкемической инфильтрации, фиброзом и рубцовыми изменениями в ее капсуле. Одновременно может увеличиваться и печень (рис.74). При отсеве очагов миелоидной гиперплазии в легкие и плевру появляется сухой кашель, одышка. При объективном обследовании могут выявляться признаки экссудативного плеврита. Лейкемическое поражение миокарда сопровождается колющими или ноющими болями в области сердца, сердцебиением, перебоями в работе сердца, одышкой, отеками на нижних конечностях. Отмечается акроцианоз, перкуторно – расширение границ относительной сердечной тупости влево, при аускультации – ослабление 1 тона на верхушке сердца. На ЭКГ – снижение вольтажа зубцов и особенно зубца Т, который довольно часто становится отрицательным. При анализе крови у большинства больных общее количество лейкоцитов увеличивается до 150-200х109/л, из них гранулоциты составляют 95% и больше со сдвигом лейкоцитарной формулы до промиелоцитов, наличием всех промежуточных форм созревающих лейкоцитов нейтрофильного ряда. В эту же стадию отмечается снижение эритроцитов и гемоглобина, СОЭ может увеличиваться до 50-60 мм/час. В костномозговом пунктате резко преобладают миелоидные клетки (миелобласты, промиелоциты, миелоциты). Терминальная стадия хронического миелолейкоза характеризуется прогрессирующим похуданием, общей адинамией в сочетании с усилением болей в костях, значительным подъемом температуры тела на фоне возникновения бластных кризов, свидетельствующих об озлокачествлении патологического кроветворения. Бластный криз характеризуется нарастанием бластов в костном мозге и крови (до 5-10%). Они представлены главным образом миелобластами, хотя возможны варианты с миеломонобластами, монобластами, эритробластами или мегакариобластами, что говорит о переходе процесса в поликлоновую стадию. Состояние больных резко ухудшается, нарастает интоксикация. Кожа серовато-воскового цвета, иногда с землистым оттенком, дряблая, нередко покрыта липким потом, особенно при повышении температуры тела. Иногда на коже лица и конечностей выявляются очаги некроза. Одно из проявлений терминальной стадии - появление лейкемидов в коже. Они выглядят слегка приподнимающимися над поверхностью папулами розовато-песочного или красновато-коричневого цвета, плотными наощупь, безболезненными. Очень важным признаком терминальной стадии хронического миелолейкоза является выявление в биоптате лимфоузла опухолевых клеток типа сарком, в которых есть Ph-хромосома. В ряде случаев начало терминальной стадии сопровождается довольно быстрым увеличением селезенки с развитием в ней инфарктов и перисплинита. Над ней выслушивается шум трения брюшины. Важным и довольно раним признаком терминальной стадии хронического миелолейкоза является развитие рефрактерности к проводимому лечению. Такими же признаками является нарастающая анемия, геморрагические проявления (петехии, экхимозы, кровотечения, которые довольно часто приводят к летальному исходу). Причинами смерти больных хроническим миелолейкозом могут стать также сердечная, печеночная или почечная недостаточности, нарастающая кахексия и различные инфекционные осложнения (гнойные пневмонии, плевриты, бронхиты, гнойные поражения кожи и подкожной клетчатки). Хронический лимфолейкоз (ХЛЛ) Это заболевание относится к лимфопролиферативным опухолям, происходящим из Т- и В-лимфоцитов, и представляет собой относительно доброкачественную опухоль, основной морфологический субстрат которой составляют зрелые и созревающие лимфоциты, но функционально не полноценные, так как не выполняют свою защитную функцию. В странах Европы и Северной Америки в 95-98% случаев субстратом опухоли являются В-лимфоциты, в азиатских странах (Япония и Китай) преобладает Т-клеточный хронический лимфолейкоз. Болезнь характеризуется лимфатической пролиферацией лимфоузлов, костного мозга, селезенки и печени, а также других органов и систем. Этиопатогенез хронического лимфолейкоза имеет некоторые отличительные особенности. 1. Большое значение имеет наследственно-семейная предрасположенность и нарушения иммунологической реактивности. ХЛЛ является самой частой формой лейкоза у кровных родственников. 2. Как правило отсутствует связь с мутагенными факторами, в частности с радиацией, химическими агентами, вирусом Эпштейна-Барр и др. В то же время, согласно данным VIII Международного рабочего совещания по ХЛЛ (1999г.), у 90% больных выявляются различные хромосомные аберрации: у 55% больных выявляются дефекты в хромосоме 13, у 18% - в хромосоме 11, у 7% - в хромосоме 17 и др. 3. Болезнь развивается в определенных этнических группах, чаще болеют пожилые мужчины. Около 70% пациентов заболевают между 50 и 70 годами. Средний возраст к началу заболевания составляет 55 лет. В странах Азии и Африки ХЛЛ является редким заболеванием. В Японии, например, на всю страну регистрируется не боле одного нового случая ХЛЛ в год. Если среди белого населения в Северной Америке на долю ХЛЛ приходится 9% от злокачественных заболеваний, то среди черного – только 0,7%. Отмечается повышенная его частота среди евреев. 4. В его течении, как правило, отсутствуют признаки опухолевой прогрессии, большая редкость развития бластного криза в терминальной стадии. 5. Нет врожденного морфологического атипизма опухолевых клеток или он встречается крайне редко при злокачественном волосатоклеточном лимфолейкозе. В течении хронического лимфолейкоза принято выделять начальный период, развернутый и терминальный. Есть и другие классификации стадий ХЛЛ. В 1981г. была разработана новая классификация стадий ХЛЛ (J. Binet с соавт), которую мы приводим ниже. Она широко распространена в Европе. Классификация стадий ХЛЛ по J. Benet
На раннем этапе развития хронического лимфолейкоза клинические симптомы могут отсутствовать, самочувствие больных чаще всего удовлетворительное и диагноз устанавливается на основании случайно произведенного анализа крови. Ретроспективно в течение многих лет в лейкоцитарной формуле отмечается лимфоцитоз порядка 40-50% при нормальном общем количестве лейкоцитов. Первым и основным клиническим признаком хронического лимфолейкоза является лимфаденопатия, характеризующаяся длительным небольшим увеличением шейных и подмышечных лимфоузлов (рис.75). Первоначально лимфатические узлы могут быть почти нормальных размеров, но они увеличиваются при различных инфекциях, например при ангине, патологии зубов, носоглотки, возвращаясь до исходной величины после ликвидации воспалительного процесса. Далее процесс характеризуется более стойким увеличением лимфатических узлов, которые приобретают повышенную плотность и тугоэластическую консистенцию. Большей частью они безболезненны, не спаянные с кожей, не сопровождаются изъязвлениями и нагнояниями. В отдельных случаях хронического лимфолейкоза, сопровождающихся лимфоретикулярной реакцией, лимфатические узлы бывают довольно плотными и болезненными при пальпации. 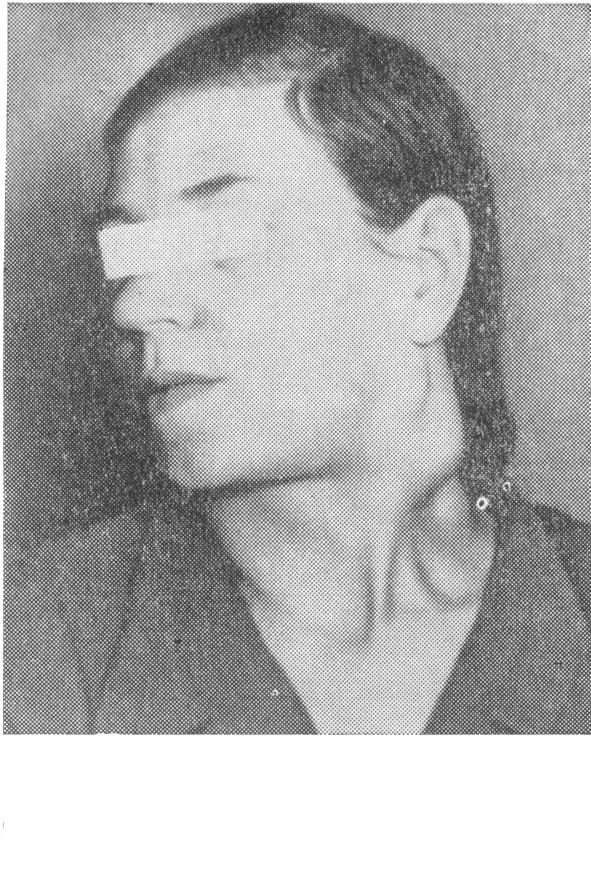 В начальной стадии хронического лимфолейкоза общее количество лейкоцитов в периферической крови первоначально находится на верхней границе нормы, но затем постепенно увеличивается, не превышая, однако, величин порядка 30-50х109/л. Главный морфологический признак хронического лимфолейкоза – лимфоцитоз и полуразрушенные лимфоциты (тени Боткина-Гумпрехта). Последние представляют слегка поврежденные ядра лимфоцитов, которые образуются в процессе приготовления мазка. Исследование костного мозга выявляет увеличение количества лимфоцитов в миелограмме более 30%. Рис.75. Лимфаденопатия при хроническом лимфолейкозе Развернутая стадия хронического лимфолейкоза характеризуется прогрессирующим увеличением лимфатических узлов с генерализацией процесса, когда захватываются более чем 2 группы узлов, появление лимфом в коже, а также присоединением рецидивирующих инфекций в различных органах и системах. Лимфомы кожи являются специфическим проявлением хронического лимфолейкоза, связанным с лимфоидной инфильтрацией кожи. Чаще всего это округлые, чувствительные при ощупывании, эластичной консистенции образования, различной величины и локализации. При появлении лимфом в коже шеи и лицевой части головы визуально создается впечатление формирования «львиного» лица (facies leolina) с складчатым утолщением кожи. Помимо лимфом кожи при хроническом лимфолейкозе нередко отмечается лейкемическая лимфодермия, при которой кожа приобретает красную окраску, которая держится почти постоянно. Кожа, как правило, сухая и шелушится. Больные при этом отмечают мучительный зуд. Из неспецифических поражений кожи при хроническом лимфолейкозе следует отметить также эксфолиативную эритродермию, генерализованную экзему, парапсориаз, пузырчатку и herpes zoster. Главным отличием данной патологии при хроническом лимфолейкозе от обычной кожной патологии является одновременное увеличение лимфатических узлов. В развернутую стадию в процесс вовлекаются другие органы и системы. В частности, отсев лимфопролиферативной ткани в миокард и легкие (плевру) может сопровождаться соответствующей симптоматикой. С другой стороны, дыхательная и сердечнососудистая система могут поражаться и банальным воспалительным процессом из-за функциональной неполноценности лимфоцитов и развитием иммунодефицита. Возникновение инфекционных осложнений – одна из характерных особенностей хронического лимфолейкоза. Они возникают на протяжении заболевания у 75-80% больных, имеют склонность к затяжному тяжелому течению и остаются главной непосредственной причиной смерти больных ХЛЛ, иногда даже в отсутствие признаков прогрессирования опухолевого роста. Наиболее часто возникают инфекции дыхательных путей (бронхиты, пневмонии, плевриты). Довольно часты также бактериальные и грибковые инфекции мочевыводящих путей, кожных покровов и мягких тканей с развитием абсцессов и флегмон, herpes zoster. Herpes zoster обусловлен недостатком интерферона, так как при ХЛЛ способность лимфоцитов к его выработке заметно снижена. Другим важным следствием иммунных нарушений при ХЛЛ является возникновение аутоиммунных осложнений. Наиболее часто развивается аутоимунная гемолитическая анемия, она выявляется у 20-35% больных. Аутоиммунная тромбоцитопения встречается примерно у 2-3% больных, однако она представляет большую опасность, так как резкое снижение тромбоцитов может привести к жизненно опасным кровотечениям. Из других органов в патологический процесс в первую очередь вовлекаются печень и селезенка. Инфильтрация их лимфоидными элементами отмечается почти всегда, однако увеличение их не бывает столь выраженным, как при хроническом миелолейкозе. В связи с их увеличением больные жалуются на боли и тяжесть в левом и правом подреберье. Увеличение медиастинальных лимфоузлов может сопровождаться признаками сдавления верхней полой вены («синдром верхней полой вены»): отек и цианоз лица, шеи («воротник Стокса»), верхней части туловища, переполнение яремных вен. Увеличение мезентериальных лимфоузлов, а также лимфоидная инфильтрация желудка и кишечника сопровождаются болями в животе, признаками желудочной и кишечной диспепсии. Все эти симптомы выявляются на фоне общих проявлений, обусловленных интоксикацией: лихорадка, потливость, боли в костях, кожный зуд, выраженная общая слабость. При лабораторном исследовании периферической крови в развитую стадию заболевания лейкоцитоз может достигать огромных цифр (500-1000 х109/л). При этом от 80 до 99% составляют лимфоциты. Преобладают зрелые формы, но, как правило, обнаруживается 5-10% пролимфоцитов и нередко 1-2% лимфобластов. Как отмечалось ранее, для ХЛЛ характерно наличие в мазке крови теней Гумпрехта-Боткина – полуразрушенных при приготовлении мазка размытых ядер лимфоцитов. При исследовании костномозгового пунктата больного ХЛЛ уже на ранних этапах болезни обнаруживается увеличение числа лимфоцитов до 40-50-60%. При выраженных проявлениях болезни число лимфоцитов нарастает до 70-90-99%. Терминальная стадия хронического лимфолейкоза характеризуется озлокачествлением патологического процесса, развитием цитопенического синдрома (тромбоцитопения, эритропения), который в свою очередь осложняется выраженной анемией, геморрагическими проявлениями. Развивается дистрофия внутренних органов, кахексия, тяжелая интоксикация и сепсис. В эту же стадию часто происходит трансформация лимфолейкоза в лимфосаркому. Саркомный рост лимфоузлов распознают по интенсивному их увеличению, появлению каменистой плотности, инфильтрации и сдавлению окружающих тканей. Он сопровождается повышением температуры и характерной гистологической картиной (выявляются саркомные клетки в биоптате лимфоузла). ЛЕЙКЕМОИДНЫЕ РЕАКЦИИ Лейкемоидные реакции (л.р.) – патологические реакции крови, сходные с лейкемическими изменениями крови, но отличающиеся от них по патогенезу. Для л.р. не свойствен закономерный для лейкоза прогрессирующий рост злокачественных кроветворных клеток, создающих субстрат опухоли, развивающейся как в кроветворной ткани, так и за ее пределами. Л.р. можно рассматривать как временно наступившие сдвиги в картине крови и исчезающие по мере выздоровления от основного заболевания (обратимые реакции) и как стойкие, глубокие реактивные изменения в кроветворении, сопровождающие тяжелые инкурабельные процессы (необратимые реакции). Лейкемоидные реакции представляют собой реактивные, в известной мере функциональные состояния кроветворного аппарата. Различают несколько фаз в течении л.р.: I - выраженная л.р.; II - фаза спада л.р.; III - фаза нормализации со следовыми реакциями. Л.р. классифицируют в зависимости от морфологического состава периферической крови, т.е. появления в ней в избыточном количестве тех или иных клеток крови. При этом общее количество лейкоцитов увеличивается до 20-50´109/л, а при лимфоцитарных л.р. до 50-100´109/л. Различают лейкемоидные реакции миелоидного типа, напоминающие острый лейкоз; лимфатические; эозинофильные; моноцитарные реакции; вторичные эритроцитозы; реактивные тромбоцитозы. Приведем этиологические факторы наиболее часто встречающихся лейкемоидных реакций: 1. Причинами л.р. миелоидного типа с картиной крови, соответствующей хроническому миелолейкозу, являются: инфекции – сепсис, скарлатина, рожа, гнойные процессы, дифтерия, крупозная пневмония, туберкулез, дизентерия, острая дистрофия печени и др.; ионизирующая радиация; нервный, раневой, операционный шок, травмы черепа; интоксикации (сульфаниламидами, угарным газом, при уремии); лимфогранулематоз; метастазы в костный мозг злокачественных опухолей. 2. Лейкемоидные реакции эозинофильного типа наблюдаются при: паразитарных заболеваниях (аскаридозе, лямблиозе, трихинеллезе, фасциолезе, амебиазе и др.). Такие же л.р. возможны при лимфогранулематозе, злокачественных новообразованиях, - при миокардитах, бронхиальной астме, коллагенозах, экземе и различных аллергических дерматитах, легочных эозинофильных инфильтратах. Описывается семейно-конституциональный эозинофилез как проявление аллергии у практически здоровых членов одной семьи. 3. Лимфатические реакции при: малосимптомном инфекционном лимфоцитозе (специфический лимфотропный вирус); детских инфекциях: краснухе, коклюше, ветряной оспе, скарлатине. туберкулезе, коллагенозах. 4. Моноцитарные л.р. при: туберкулезе, саркоидозе, ревматизме, у больных дизентерией. 5. Вторичные эритроцитозы при: хронических легочных процессах, легочно-сердечной недостаточности, врожденных пороках сердца; сосудистых опухолях, стенозе почечных артерий разного генеза; контузиях, стрессовых ситуациях; язвах двенадцатиперстной кишки. 6. Реактивные тромбоцитозы при: злокачественных новообразованиях; после спленэктомии; гемолитических анемиях; у некоторых больных ревматическим артритом, хроническим гепатитом, нефритом. Подчеркнем, что больные лейкемоидными реакциями любого типа должны быть тщательно обследованы в специализированных отделениях с целью исключения прежде всего лейкозов. Дифференциальная диагностика л.р. будет рассмотрена на старших курсах медицинского ВУЗа. Система гемостаза Диагностика нарушений гемостаза Геморрагические диатезы Система гемостаза – это совокупность функционально-морфологических и биохимических механизмов, обеспечивающих остановку кровотечения и, вместе с тем, поддерживающих кровь в жидком состоянии преимущественно внутри сосудов. Функционально-морфологическими и биохимическими компонентами системы гемостаза являются: сосудистая стенка; тромбоциты; система свертывания крови, включающая свертывающую и противосвертывающую системы. Каждый компонент гемостаза выполняет свою специфическую роль, которая не может быть заменена функцией других элементов этой системы. С другой стороны, некоторые функции отдельных компонентов гемостаза в значительной степени взаимозаменяемы. Например, у некоторых больных врожденной афибриногенемией и гемофилией долго нет клинических признаков нарушения гемостаза вследствие того, что полноценная сосудистая стенка и тромбоциты в значительной степени компенсируют тяжелые дефекты в свертывающей системе крови. Однако, если к коагуляционному дефекту присоединяется нарушение целостности сосудистой стенки (оперативное вмешательство, травма, сопровождающаяся разрывом сосудов), начинаются длитеьные и массивные кровотечения, не останавливающиеся без специальных воздействий на гемокоагуляцию и тромбоциты. Вот почему для полной оценки надежности гемостаза необходимо иметь информацию о состоянии всех его трех компонентов и учитывать конкретную клиническую ситуацию. Разберем, хотя бы кратко, роль каждого из трех компонентов гемостаза. Сосудисто-тромбоцитарный (первичный гемостаз) Стенка капилляра образована эндотелием, базальной мембраной и адвентицией. Базальная мембрана капилляра состоит из аморфного вещества, представленного в основном гиалуроновой кислотой и коллагеновыми волокнами. В синтезе гиалуроновой кислоты принимают активное участие катехоламины (адреналин, норадреналин), витамины С, Р, ионы Са++, глюкокортикоиды. При достаточном количестве этих веществ создается структурно и функционально полноценная сосудистая стенка. В ответ на травму такая стенка реагирует мощным сокращением. Это – первая и самая быстрая первичная реакция гемостатической системы. Сосудистый спазм длится 2-3 минуты, затем наступает дилятация поврежденного сосуда. Однако кровотечение не усиливается, так как сосудистый компонент гемостаза подкрепляется тромбоцитарным. Уже в первые секунды после травмы происходит адгезия (прилипание) тромбоцитов к краям поврежденного эндотелия и колагеновым волокнам. Под влиянием АДФ (аденазиндифосфата), которая выделяется из поврежденного сосуда и при гемолизе эритроцитов, тромбоциты склеиваются друг с другом (агрегация тромбоцитов) как у места поврежденного сосуда, так и в кровотоке. В результате агрегации тромбоцитов из них выделяется серотонин, адреналин, которые еще больше усиливают сокращение поврежденной сосудистой стенки. В конечном итоге формируется белый тромбоцитарный, или первичный, тромб. Он надежен для остановки кровотечения на микроциркуляторном уровне. При повреждении же крупных сосудов для надежного гемостаза включается система свертывания крови, в результате осуществляется вторичный гемостаз с образованием красного тромба. Велика роль самого эндотелия в гемостазе. Клетки его продуцируют: А. антикоагулянтные факторы – простациклин – сильнейший антиагрегирущий и сосудистый фактор; антитромбин III – основной ингибитор тромбина и других активированных факторов коагуляции, тканевый активатор фибринолиза. Б. прокоагулянтные факторы: тканевый тромбопластин (фактор III); фактор Виллебранда – кофактор адгезии и агрегации тромбоцитов; активатор плазминогена; фибронектин. Система свертывания крови. Вторичный гемостаз. Единая система свертывания крови, являясь компонентом гемостаза, делится на две функциональные системы: свертывающую и противосвертывающую. Свертывающая система включает около 15 факторов свертывания плазмы, 11 факторов тромбоцитов и других тканей. Главная функция свертывающей системы – образование красного кровяного тромба. Противосвертывающая система крови поддерживает кровь в жидком состоянии, препятствуя превышению нормального функционирования свертывающей системы, растворяя образующиеся фибриновые и кровяные тромбы, которые нарушают гемодинамику и тканевый метаболизм. Эта функция выполняется антикоалянтной и фибринолитической (плазминовой) системами. Фазы свертывания крови. Основы современной ферментативной теории свертывания крови были заложены отечественным ученым, профессором Тартусского университета А.А. Шмидтом в его работах 1861-1895гг., дополнены П. Моравитцем (1904) и суммированы в двухфазной схеме гемокоагуляции: Тромбокиназа ↓ Са ++ 1 фаза протромбин → тромбин ↓ 2 фаза фибриноген → фибрин В последующем теория свертывания крови была расширена в результате раскрытия механизма образования тромбокиназы (впоследствии переименована в тромбопластин, а в настоящее время - в протромбиназу). Оказалось, что протромбиназы, как активного коагуляционного фактора, нет ни в крови, ни в тканях. Последняя появляется вследствие взаимодействия плазменных и тромбоцитарных факторов (внутренний путь образования протромбиназы) или в результате реакции тканевого тромбопластина, ионов Са2+ и VIIа фактора свертывания (внешний путь образования протромбиназы). Эти данные о новом этапе коагуляции (образование активного тромбопластина-протромбиназы) позволили рассматривать свертываемость крови как четырехфазный процесс: 1 фаза – протромбиназообразование; II – тромбинообразование (протромбиназа →тромбин →тромбин ↑ Va + VIIa+ Xa + Ca; III – фибринообразование (тромбин → фибриноген → фибрин); IV – посткоагуляционная (образование гемостатически полноценного сгустка с процессом ретракции). Самая долгая фаза I – образование протромбиназы – она длится от 4′50″ до 6 мин 50′′. Общая длительность свертывания 5- мин. В ее образовании принимают участие около 11 факторов (фактор Хагемана – ХII, антигемофильный фактор С – ХI, антигемофильный фактор В (Кристмас-фактор) – IХ, фактор Стюарта-Прауэр – Х, антигемофильный фактор А – VIII, Са2+, прекалликреин (фактор Флетчера), кининоген). При отсутствии любого из этих факторов полноценного образования протромбиназы не происходит и будут кровотечения. Именно из-за неполноценности I фазы свертывания возникают такие тяжелые наследственные коагулопатии как гемофилия А, В, С и др. |
