|
|
Биохим_15. Учебное пособие Хабаровск 2015 методические указания составили поступаев валерий Васильевич, д м. н., профессор
Вопросы, изученные ранее и необходимые для данного занятия:
| Вопросы |
Где изучались
|
1.
| Молекулярная масса полимеров и методы ее определения |
Кафедра общей химии
|
2.
|
Химический состав белка
|
Кафедра биохимии,
предыдущая тема
|
Содержание обучения
Граф логической структуры темы
Физико-химические свойства белков
|
Растворимость
|
Свойства
растворов:
диализ,
вязкость,
светорассеяние
|
Адсорбция:
физическая,
химическая,
специфическая
|
Осаждаемость:
высаливание,
денатурация
|
    Этапы выделения Этапы выделения
и очистки белков
|
Гомогенизация
Экстракция
Фракционирование
Кристаллизация
Проверка биологической активности
|
   Методы Методы
фракционирования
|
Высаливание
|
Центрифу-
гирование
|
Хромато-
г рафия рафия
|
Электро-
форез
|
Типы
хроматографии
|
ионообменная адсорбционная аффинная гель-фильтрация
|
Вопросы и задания для самоподготовки
Изучите основные физико-химические свойства простых белков.
Рассмотрите методы определения молекулярной массы белков.
Рассмотрите, чем определяются амфотерные свойства простых белков.
Изучите, как формируется заряд белковой молекулы при растворении белков в воде.
Выясните факторы стабилизации белков в растворе, свойства белковых растворов.
Выясните, на каких свойствах белков основаны методы их разделения на фракции путем высаливания, электрофореза, хроматографии.
Выясните, какие существуют методы хроматографического анализа, на чем они основаны, для чего используются.
Рассмотрите возможность обратимости осаждения белка солями щелочных и щелочно-земельных металлов, приведите примеры использования этого метода.
Выясните, что обозначает понятие «изоэлектрическая точка белка», как влияет химический состав белка на изоэлектрическую точку.
Зарисуйте схему «Классификация методов разделения белков» (рис. 1).
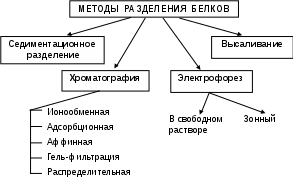
Рис. 1. Классификация методов разделения белков
Ориентировочная карта действия
№
| Вопросы, подлежащие изучению |
Последовательность работы
и способ оформления результатов
|
1.
| Определение изоэлектрической точки казеина. |
Принцип: При определённом рН среды молекула белка несёт суммарный электрический заряд, равный нулю. Такое значение рН раствора называется изоэлектрической точкой (pI). Растворы белков в pI наименее устойчивы и белки легко выпадают в осадок. Вследствие этого определение pI белка может быть сведено к определению рН раствора, при котором наблюдается наибольшее помутнение раствора белка.
Ход работы: Для приготовления буферных растворов с определённым значением рН наливают последовательно в 6 сухих пробирок реактивы в количествах, указанных в таблице:
|
№
пробы
|
Состав пробы (в каплях)
|
рН смеси
|
Степень помутнения
|
СН3СООН
0,2 моль/л
|
Н2О
|
раствор казеина в растворе СН3СООNa
|
1
|
16
|
4
|
5
|
3,8
|
|
2
|
8
|
12
|
5
|
4,1
|
|
3
|
4
|
16
|
5
|
4,4
|
|
4
|
2
|
18
|
5
|
4,7
|
|
5
|
1
|
19
|
5
|
5,0
|
|
6
|
1
|
20
|
5
|
5,3
|
|
|
|
|
Растворы тщательно перемешивают. Через 15-20 минут наблюдают помутнение растворов. Наибольшее выпадение осадка будет наблюдаться в той пробирке, где рН соответствует pI казеина.
Результаты работы оформляют в виде таблицы. Делают выводы из полученных результатов и записывают их в тетрадь.
Отсутствие помутнения обозначают знаком «-», появление мути – знаком «+», значительное появление мути – несколькими знаками «+».
|
2.
|
Разделение альбуминов и глобулинов яичного белка методом высаливания.
|
Принцип: Белки как вещества высокомолекулярные образуют коллоидные растворы. Воздействия, влияющие на гидратацию, заряд или форму белковых молекул, изменяют и растворимость. К числу таких воздействий относится, в частности, добавление в раствор солей.
С помощью солей белки осаждаются из раствора – высаливание. Разные белки осаждаются при разной концентрации соли, поэтому метод используется для фракционирования белков. Для высаливания чаще всего используют сульфат аммония, отличающийся очень высокой растворимостью в воде (75,4 г в 100 мл).
Ход работы:
В пробирку № 1 налить 40 капель 3% раствора белка и 40 капель насыщенного раствора сульфата аммония - (NH4)2SO4. Таким образом, получен раствор, насыщенный сульфатом аммония на 50%. При таком насыщении раствора в осадок выпадают глобулины. Отфильтровать содержимое в чистую пробирку (№ 2). При этом на фильтровальной бумаге останутся белки, выпавшие в осадок – глобулины (бумагу не выбрасывать!). В раствор, полученный в результате фильтрования, добавить кристаллический (NH4)2SO4 до полного насыщения раствора сульфатом аммония (пока соль не прекратит растворяться при помешивании). При 100% насыщении раствора в осадок выпадают альбумины. Отфильтровать содержимое в чистую пробирку (№ 3), используя новый фильтр. Отрезать по кусочку от фильтров № 1 и № 2, поместить части фильтров в сухие пробирки, добавить несколько капель биуретового реактива. Добавить биуретовый реактив в пробирку № 3. Оценить результаты биуретовой реакции.
В тетрадь кратко записать последовательность действий при выполнении работы. В выводе сравнить устойчивость альбуминов и глобулинов в растворе, объяснить различия в устойчивости этих белков. Оценить результаты биуретовой реакции.
|
3.
|
Обессоливание белкового раствора методом
гель-фильтрации
|
Принцип метода: Разделение веществ основано на различии в размерах молекул. Хроматографическую колонку заполняют гелем полисахарида декстрана (коммерческое название - сефадекс), набухшим в воде. Крупные молекулы не проникают в поры гранул геля и выходят из колонки в первую очередь, в то время как небольшие молекулы попадают через поры в гранулы, вследствие этого задерживаются на колонке и движутся с меньшей скоростью.
Ход работы: 1. Приготовление геля.
4 г порошка сефадекса суспендируют в 200 мл дистиллированной воды в химическом стакане. После отстаивания основной массы порошка воду с мелкими частицами осторожно сливают. Эту процедуру повторяют до тех пор, пока надосадочная жидкость не станет прозрачной. При комнатной температуре весь процесс полного набухания геля занимает 3 ч. Если нагреть суспензию на водяной бане до 100 ºС, то это время сокращается до 1 ч.
2. Подготовка колонки.
В колонку с закрытым краном наливают небольшое количество дистиллированной воды. На дно колонки помещают кусочек стеклянной ваты. Очень важно при этом избежать попадания пузырьков воздуха. Затем в колонку через воронку вливают густую суспензию геля сефадекса. Колонку устанавливают в штативе строго вертикально.
3. Нанесение раствора белка.
Перед нанесением раствора открывают кран на колонке и наблюдают за уменьшением столбика воды над слоем сефадекса. Как только над поверхностью геля остаётся слой жидкости толщиной 1-2 мм, кран закрывают и пипеткой аккуратно наносят на гель 1 мл белкового раствора, в который предварительно добавляют 5 мг К2CrO4. Кран открывают и следят за проникновением раствора в гель. Снова закрывают кран, стенки колонки ополаскивают 1 мл дистиллированной воды, открывают кран и позволяют жидкости впитаться в гель. Затем кран закрывают и, стараясь не взмучивать гель, добавляют пипеткой аккуратно по стенке 4-6 мл дистиллированной воды.
4. Сбор фракций.
В 10 пробирок отмеривают по 1 мл биуретового реактива. К колонке присоединяют делительную воронку с водой и открывают кран. Собирают фракции с воронки по 20 капель (1 мл) в пробирки, содержащие биуретовый реактив. Наблюдают изменение окраски в порциях элюата, содержащего белок.
Выход хромата калия отмечают по появлению жёлтого окрашивания раствора в очередной пробирке.
Гель в колонке отмывают водой до полного удаления К2CrO4. После этого колонка снова готова к употреблению.
Описать принцип метода; схематически изобразить стадии разделения на рисунках; результаты опыта занести в таблицу:
|
№ пробирки
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
Белок
|
|
|
|
|
|
|
|
|
|
|
К2CrO4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 Скачать 2.47 Mb.
Скачать 2.47 Mb.


 рафия
рафия