качество и безопасность продуктов питания. КАЧЕСТВО И БЕЗОПАСНОСТЬ ПРОДУКТОВ ПИТАНИЯ (1). Учебное пособие Минск 2008 Авторы З. В. Ловкис, докт техн наук, профессор
 Скачать 7.39 Mb. Скачать 7.39 Mb.
|
|
• информация о государственной регистрации. Несомненно, регламентация продажи модифицрованных продуктов необходима и полезна, однако в принятом Европарламентом законе имеется ряд нюансов. Так, на упаковках нерафинированного масла и попкорна из генетически измененной кукурузы должна быть соответствующая маркировка, а на упаковке с крахмалом или полученном из него глюкозным сиропом подобная маркировка не требуется. Маркировка не требуется на упаковке с рафинированным маслом или приготовленном на его основе майонезе. Полученный из гететически модифицированного яблока мусс или яблочный сок должны нести соответствующую маркировку, а яблочный уксус – нет. Не фиксируется факт использования генетически измененного сырья при изготовлении лецитина и получении с его помощью шоколада и крема. Должны иметь соответствующую маркировку соевый шрот, белок, полученный из него, и готовые супы с данным белком. Корма для животных, полученные из шрота генетически измененной сои не маркируются. В Республике Беларусь не установлены минимально допустимые содержания ГМИ. Белорусское законодательство очень жесткое: даже если в продукте есть одна молекула ДНК, содержащая трансген, нужно наносить маркировку. Объективные причины существования реальных и (или) потенциальных биологических рисков ГМО и полученных из них продуктов следуют, прежде всего, из несовершенства самих генно-инженерных технологий и слабой изученности структуры и функционирования генетического аппарата растений, в который и вставляется чужеродный ген. Так, например, генный инженер в настоящее время не умеет встраивать чужеродный фрагмент ДНК в данное конкретное место генома. Это означает, что встраивание трансгена носит непредсказуемый характер и может сопровождаться нарушением работы конкретных генов, а, следовательно, и клеточного метаболизма с возможным образованием веществ с негативными биологическими эффектами. Случайно встроенный чужеродный ген может влиять на работу соседних генов, то есть оказывать «плейотропный эффект», последствия которого предсказать никто не может. Генный инженер, создавая ГМО, нарушает один из основных запретов эволюции – запрет на обмен генетической информацией между далеко отстоящими видами (например, между растением и человеком, между растением и рыбой или медузой). Цена подобной «вольности» может быть весьма высока. Она может выражаться в нарушении стабильности генома или встроенного в него чужеродного фрагмента ДНК, в проявлении возможных аллергических или токсических эффектов чужеродного белка, в изменении «работы» генетического аппарата и клеточного метаболизма с непредсказуемыми биологическими последствиями. Одним из основных недостатков современных генных технологий является наличие во встроенном фрагменте ДНК помимо так называемого «целевого гена», изменяющего то или иное свойство организма, «технологического мусора», в том числе генов устойчивости к антибиотикам и вирусных промоторов, которые небезопасны для природы и человека. Но это не означает, что надо свернуть генно-инженерные работы. Наоборот, необходимы широкие исследования результатов использования ГМ-продуктов, действенный контроль за их применением, усовершенствование генно-инженерных технологий, переход к созданию более безопасных трансгенных растений. А на вопрос, возникающий практически у любого человека: есть или не есть продукты, на этикетке которых указано присутсвие модифицированных компонентов, каждому придется отвечать самостоятельно и самому делать свой выбор. Контрольные вопросы: Что такое генетически модифицированные продукты питания? Какие способы получения генетически модифицированных организмов вы знаете? В чем состоят преимущества и недостатки ГМИ? Характеризуйте методы определения и оценки ГМИ? В чем заключается опасность генетически модифицированных продуктов для организма человека? Какие основные продукты получают с использованием ГМИ? Глава 4 ЛАБОРАТОРНЫЙ ПРАКТИКУМ § 4.1. Оценка органолептических свойств нативного крахмала Принцип метода. Нативный крахмал – природный полимер, в котором мономеры (остатки α-D-глюкопиранозы) связаны α-(1→4)- и α-(1→6)-гликозидными связями, образуя амилозу (полисахарид линейного строения) и амилопектин (полисахарид разветвленного строения): 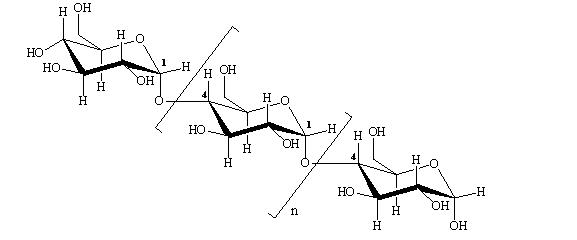 Амилоза 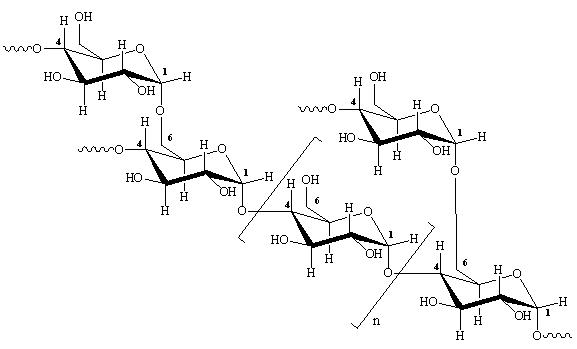 Амилопектин Крахмальные фракции (амилоза и амилопекти компактно упакованы в в крахмальные зерна (или гранулы). Органолептические сойства нативного крахмала определяются при помощи органов чувст человека (зрения, слуха, обоняния и осязания). Цель: провести органолептическую оценку нативного крахмала. Задачи: Определить цвет и блеск крахмала; Определить запах крахмала; Определить хруст кулинарной пробы; Определить количество крапин. Приборы и материалы: Доска или большой лист бумаги; Покровные стекла; Линейка. Порядок работы: 1.Определение цвета и блеска. Для определения цвета пробу крахмала нужно рассыпать равномерным слоем на доске или бумаге и, пригладив поверхность, рассматривать при дневном свете. Цвет исследуемой пробы следует сравнивать с эталонами. Блеск (люстр) определяется аналогично. 2.Определение запаха. Запах можно определить двумя способами: насыпать крахмал на ладонь, согреть его дыханием, а затем определять запах; поместить крахмал в стакан и облить теплой водой (с температурой 50ºС), через 30 с воду слить и определять запах. 3.Определение хруста кулинарной пробы. Определение хруста производят в клейстере, приготовленном из исследуемого крахмала. В 40 мл питьевой воды размешивают 12 г крахмала. Параллельно в стакан на 400–500 мл наливают 160 мл воды и нагревают до кипения. В кипящую воду при постоянном помешивании вливают крахмальную суспензию. С появлением первых пузырьков нагревание прекращают. Полученный клейстер охлаждают до комнатной температуры и производят вкусовую пробу. Хруст свидетельствует о содержании в крахмале песка или других минеральных примесей. Приборы. Доска или большой лист бумаги; покровные стекла; линейка. 4.Определение содержания крапин. Около 100 г крахмала (можно не взвешивать) высыпать на доску или лист белой бумаги и при помощи какого-либо предмета (стекла, картона, полированной доски) выровнять его на поверхности. Покровное стекло осторожно поместить на гладкую поверхность крахмала и подсчитать количество крапин на единицу площади. Крахмал перемешать, выровнять поверхность и вновь подсчитать количество крапин. Произвести не менее четырех таких подсчетов (в соответствии с требованиями стандарта). Расчет. Для определения числа крапин, приходящихся на 1 см2, суммируют количество крапин, найденное при отдельных подсчетах; полученную сумму делят на число подсчетов и на площадь стекла. §4.2. Выделение и идентификация белка Принцип метода. Выделение казеина. В молоке казеин находится в виде растворимой кальциевой соли, т.е. в виде анионов. Свободный же казеиноген в форме электронейтральных молекул отличается весьма малой устойчивостью в воде. Поэтому при подкислении молока до рН 4,7 (изоэлектрическая точка казеиногена) казеиноген выпадает в осадок, т.е. молоко свертывается. Биуретова реакция. В щелочной среде в присутствии солей меди растворы белка приобретают фиолетовый цвет с красным или синим оттенком, зависящим от количества пептидных связей в молекуле белка. Такую реакцию дают все белки, а также продукты их неполного гидролиза – пептоны и полипептиды, содержащие не менее двух пептидных связей. Биуретовая реакция обусловлена наличием в белке пептидных связей, которые в щелочной среде образуют с сернокислой медью окрашенные комплексы. Группа, образующая пептидную связь (-СО-NH-), в щелочной среде присутствует в своей таутомерной енольной форме:  При избытке щелочи происходит диссоциация ОН-группы, появляется отрицательный заряд, с помощью которого кислород взаимодействует с медью, возникает солеобразная связь; кроме того, медь образует дополнительные координационные связи с атомами азота, участвующими в пептидной связи, путем использования их неподеленных электронных пар. Возникающий таким образом комплекс очень стабилен. Схематически реакцию можно представить так:  Полипептид  Енольная форма полипептида  Биуретовый комплекс Биуретовый комплексИнтенсивность окраски комплекса зависит от концентрации белка и количества медной соли в растворе. Реакция Миллона. При добавлении к раствору белка реактива Миллона (раствор ртути в азотной кислоте, содержащей азотистую кислоту) белок выпадает в осадок, который при нагревании приобретает красно-коричневый цвет. Реакция обусловлена наличием в белке аминокислоты тирозина, имеющей фенольное ядро, которое при взаимодействии с реактивом Миллона образует окрашенную соль своего нитропроизводного:  Тирозин Ртутная соль нитротирозина (красно-коричневого цвета) Рекцию Миллона дают все белки, за исключением тех, молекулы которых не содержат тирозина (желатин, клупеин и др.). Свободный тирозин реагирует с реактивом Миллона аналогично, но при этом не образует осадка, а раствор приобретает красный цвет. Реакция Фоля. При добавлении к раствору белка крепкой едкой щелочи, уксуснокислого свинца и последующем кипячении раствор начинает темнеть. Реакция обусловлена присутствием в белке серусодержащих аминокислот: цистина, цистеина и метионина. Эти аминокислоты при нагревании в присутствии крепкой щелочи разрушаются, образуя сернистый натрий:  Цистеин Серин Уксуснокислый свинец реагирует со щелочью с образованием плюмбита натрия: (СН3СОО)2Рb + 2NaOH → Pb(ONa)2 + 2CH3COOH Сернистый натрий при взаимодействии с плюмбитом образует черный осадок сернистого свинца: Na2S + Pb(ONa)2 + 2H2O → PbS↓ + 4NaOH. Черный осадок Нингидриновая реакция. Белки, полипептиды, а также свободные α-аминокислоты дают синее или фиолетовое окрашивание с нингидрином (трикетогидриндегидратом). Реакция характерна для аминогрупп в α-положении и обусловлена наличием α-аминокислот в молекуле белка. При нагревании белка с водным раствором нингидрина аминокислоты окисляются и распадаются, образуя двуокись углерода, аммиак и соответствующий альдегид:  Аминокислота Нингидрин Альдегид Восстановленный нингидрин Восстановленый нингидрин конденсируется с аммиаком и окисленной молекулой нингидрина, образуя краситель типа мурексида фиолетово-синего цвета:  Окисленный Восстановленный Окрашеный продукт конденсации нингидрин нингидрин (фиолетово-синего цвета) Ксантопротеиновая реакция. При добавлении к раствору белка концентрированной азотной кислоты белок сничала выпадает в осадок, а затем при нагревании растворяется и жидкость окрашивается в желтый цвет. Эта реакция указывает на присутствие в белке ароматических аминокислот (фенилаланина, тирозина, триптофана) и основана на образовании нитропроизводных этих аминокислот. Реакция характерна для бензольного ядра циклических аминокислот, которые при обработке концентрированной азотной кислотой подвергаются нитрованию:  Тирозин Динитротирозин (желтого цвета) Нитропроизводные аминокислот в щелочной среде образуют соли хиноидной структуры, окращенные в оранжевый цвет.  Динитротирозин Аммонийная соль динитротирозина (оранжевого цвета) Аналогично протекает реакция нитрования триптофана и фенилаланина (поледняя нитруется труднее). Ксантопротеиновую реакцию дают почти все белки; исключение составляют клупеин и сальмин (из группы протаминов) и желатин, в молекуле которых почти полностью отсутствуют ароматические аминокислоты. Реакция Сакагучи. Белки в присутствии щелочи дают красное окрашивание с гипобромитом и α-нафтолом. Реакция обусловлена наличием в белке аминокислоты аргинина, имеющей в своем составе гуанидиновую группировку. Вероятно, гуанидиновая группировка окисляется гипобромидом и окисленный аргинин, соединяясь с α-нафтолом, образует продукт конденсации красного цвета:  Аргинин α-Нафтол Продукт конденсации α-нафтола с окисленным аргинином (красного цвета) Реакция Адамкевича. При добавлении к раствору белка незначительных количеств глиоксиловой кислоты в присутствии крепкой серной кислоты получается красно-фиолетовое окрашивание. Эта реакция связана с присутствием в молекуле белка аминокислоты триптофана и основана на способности триптофана в кислой среде вступать в реакцию с альдегидами, образуя при этом окрашенные продукты конденсации. Глиоксиловая кислота всегда присутствует в небольших количествах в ледяной уксусной кислоте, поэтому последнюю используют как источник глиокиловой кислоты:  Триптофан Глиоксиловая кислота  Продукт конденсации триптофана с глиоксловой кислотой (красного цвета) Цель: овладеть методикой выделения белка и освоить качественные реакции на белки. Задачи: Овладеть методикой выделения белка; Освоить качественные реакции на белки: биуретову реакцию; рекцию Миллона; рекцию Фоля; нингидриновую реакцию; ксантопротеиновую реакцию; реакцию Сакагучи; реакцию Адамкевича. Реактивы и растворы: Молоко свежее; Куриное яйцо; Уксусная кислота, ч.д.а., 10% раствор; Натр едкий, ч.д.а., 10% раствор; Меди сульфат, ч.д.а., 1% раствор; Нингидрин, 0,5% раствор; Азотная кислота, ч.д.а., концентрированная; Аммиак, ч.д.а. концентрированный; Натр едкий, ч.д.а., 30% раствор; Реактив Миллона: 100 г ртути растворяют в 143 мл концентрированной азотной кислоты (относительная плотность 1,4) сначала при комнатной температуре, затем на водяной бане; раствор разводят двумя объемами воды с небольшим количеством 1% раствора KNO2 или NaNO2; через некоторое время жидкость сливают с отстоявшегося осадка; при длительном хранении реактив окисляется; -Нафтол, 0,1% спиртовой раствор; 0,1 г нафтола растворяют в 100 мл 70% этилового спирта; Натрий бромоватистокислый (натрия гипобромит), 2% раствор; 2 г брома (0,65 мл) растворяют в 100 мл 5% раствора едкого натра при охлаждении льдом (относительная плотность брома 3,12) ; растворение производят под тягой; Уксусная кислота, ч.д.а., ледяная; Серная кислота, ч.д.а., концентрированная; Свинецуксуснокислый, ч.д.а., 5% растор. Порядок работы: 1.Выделение белка. 1.1.Выделение казеина из молока. К 2 мл молока добавляют 2 мл дистиллированной воды и 2 капли 10% уксусной кислоты. Образуется осадок казеина, который отфильтровывают. Фильтрат отбрасывают, а осадок казеина остородно снимают с фильтра стеклянной палочной и помещают в чистые пробирки. 1.2.Выделение яичного белка. У куриного яйца отделяют белок от желтка. Белок куриного яйца фильтруют через марлю. Профильтрованный белок разбавляют дистиллированной водой в соотношении 1:10. 2.Качественные реакции на белок. 2.1. Реакция Миллона. К 10 каплям 1% раствора белка добавляют 1 – 2 кали реактива Миллона и осторожно нагревают. Появляется красновато-коричневая окраска. 2.2.Реакция Фоли. К 5 каплям 1% раствора белка добавляют 5 капель 30% раствора едкого натра и 1 каплю 5% раствора уксуснокислого свинца. При интенсивном кипячении жидкость темнеет, образуя черный осадок сернистого свинца. 2.3.Биуретовая реакция. К 5 каплям 1% раствора белка добавляют 10 капель 10% раствора едкого натра и 1 каплю 1% раствора сульфата меди. Появляется красно-фиолетовое (или сине-фиолетовое) окрашивание. 2.4.Нингидриновая реакция. К 5 каплям 1% раствора белка добавляют 3 капли 0,5% раствора нингидрина и нагревают до кипения. Через 2–3 мин появляется розовое, красное, а затем сине-фиолетовое окрашивание. 2.5.Ксантопротеиновая реакция. К 5 каплям 1% раствора белкадобавляют 3 капли концентрированной азотной кислоты и (осторожно!) нагревают. Появляется желтое окрашивание. После охлаждения осторожно добавляют 10 капель канцентрированного раствора аммиака или 30% раствор едкого натра. Желтая окраска переходит в оранжевую. 2.6.Реакция Сакагучи. К 5 каплям 1% раствора белка добавляют 5 капель 10% раствора едкого натра, 3 капли 0,1 спиртового раствора нафтола и по каплям (всего 1–5 капель) 2% раствора гипобромата натрия. Жидкость становиться красного цвета. 2.7.Реакция Адамкевича. К 5 каплям 1% раствора белкадобавляют 5 капель концентрированной уксусной кислоты. Раствор сначала слегка нагревают, затем охлаждают и по осторожно, чтобы жидкости не смешались (подслаивание), приливают 10 капель концентрированной серной кислоты. На границе двух слоев жидкости наблюдается красно-фиолетовое окрашивание в виде кольца. Появление окраски можно ускорить нагреванием. § 4.3. Определение белкового азота в мясе и мясных продуктах Принцип метода. Методика основана на минерализации мяса или мясного продукта методом Кьельдаля с образованием соли аммония, которую определяют с использованием реактива Несслера по реакции: NH4+ +2[HgI4]2– + 4OH– → [Hg2ONH2]+I–↓ + 7I– + 3H2O Цель: овладеть методикой определения белкового азота в мясных продуктах. Задачи: Минерализовать пробу мясного фарша; Определить содержание белкового азота в предложенном образце мясного фарша. Реактивы и растворы: Йодид ртути, ч.д.а.; Йодид калия, ч.д.а.; Натрия гидроокись, х.ч., 6 М раствор; Сульфат аммония, ч.д.а.; Сульфат натрия или калия безводный, ч.д.а.; Оксид ртути, ч.д.а.; Этанол, препарат с концентрацией 96%; Кислота серная концентрированная, плотность 1,84 г/мл; Гидрокид натрия, х.ч. Порядок работы: 1.Подготовка к проведению анализа. 1.1.Приготовление реактива Несслера. В конической колбе вместимостью 200 мл в небольшом объеме дистиллированной воды растворяют 11,5 г йодида ртути и 8 г йодида калия, разбавляют дистиллированной водой примерно до 50 мл, добавляют 50 мл раствора гидроксида натрия, через сутки с образовавшегося осадка декантируют прозрачную жидкость. 1.2.Построение градуировочного графика. Предварительно готовят стандартный раствор сульфата аммония: в мерную колбу вместимостью 500 мл помещают 0,2360±0,0002 г сульфата аммония, растворяют в дистиллированной воде и доводят водой до метки, перемешивают; 1 мл приготовленного раствора содержит 0,1 мг азота. Для построения градуировочного графика в 6 мерных колб объемом 50 мл последовательно вносят 0; 0,25; 0,5; 1,0; 1,5; 2,0 мл стандартного раствора сульфата аммония, в каждую колбу добавляют по 30 мл дистиллированной воды и 4 мл реактива Несслера, доводят дистиллированной водой до метки и перемешивают. Через 30 мин измеряют оптическую плотность желто-оранжевых растворов, содержащих в 50 мл соответственно 0; 0,025; 0,05; 0,1; 0,15; 0,2 мг азота, на фотоэлектроколориметре при длине волны 440 нм. Контрольный раствор содержит все реактивы, кроме сульфата аммония. Градуировочный график строят в координатах: содержание азота, мг/50мл – оптическая плотность раствора. 2.Минерализаци пробы. Для минерализации анализируемого мясного продукта в колбу Кьельдаля помещают 0,5–1 г продукта, 15 мл серной кислоты и примерно 0,1 г оксида ртути (катализатор). Для ускорения минерализации в колбу добавляют 10 г сульфата калия или натрия, кусочки пемзы или керамики и осторожно нагревают на плитке. Если жидкость вспенивается, нагревание прекращают, перемешивают, капилляром добавляют 5–6 капель этанола, снова нагревают и кипятят до получения бесцветного и прозрачного раствора минерализата. 3.Проведение определения. В мерную колбу на 100 мл помещают 40–50 мл дистиллированной воды и весь минерализат. Колбу Кьельдаля промывают водой, промывные воды собирают в ту же мерную колбу, доводят до метки и перемешивают (раствор А). В мерную колбу на 50 мл помещают 1 мл раствора А, 30 мл дистиллированной воды, 4 мл реактива Несслера, доводят водой до метки и перемешивают (раствор Б). Через 30 мин измеряют оптическую плотность раствора Б. 4.Расчет содержания белкового азота. Содержание белкового азота в анализируемом мясном продукте рассчитывается по формуле:
Для пересчета на белки найденное количество азота умножают на эмпирический коэффициент 6,25. |
