Практикум Люта. В. Л. Люта о. В. Кононов в а. Люта о. В. Кононов
 Скачать 1.23 Mb. Скачать 1.23 Mb.
|
|
Контрольні запитання
9. Які методи використовують під час мікробіологічних досліджень? Тести Метод дослідження, нід час якого проводять посів патологічного матеріалу на поживне середовище: а) мікроскопічний; б) бактеріологічний; в) біологічний; г) імунологічний. На мікробіологічне дослідження відбирають матеріал: а) у хворої людини; б) у здорової людини; в) із навколишнього середовища; г) всі відповіді правильні. Відбір матеріалу проводять: а) до початку лікування антибактеріальними препаратами; б) у процесі лікування; в) не має значення. Час, протягом якого матеріал транспортують до лабораторії: а) 1 год; б) 2 год; в) 1 доба, г) 3—5 год. Імерсійну систему в мікроскопі використовують для: а) збільшення зображення об'єкта; б) посилення чіткості зображення; в) всі відповіді правильні. Експрес-методи діагностики є найбільш: а) точними; о) швидкими; в) досконалими; г) всі відповіді правильні. Ситуаційні задачі 1. Під час мікроскопії препарату, виготовленого з культури бактерій, використали об'єктив х40. Які були допущені помилки?
Домашнє завдання Підготуйтесь до практичного заняття 2. Рекомендації щодо самопідготовки до практичного заняття 2
Практичне заняття 2 ПРОСТІ ТА СКЛАДНІ МЕТОДИ ФАРБУВАННЯ ПРЕПАРАТІВ Мета заняття:
Оснащення: світловий мікроскоп, імерсійне масло, в'язкий матеріал (мокротиння або гній), кров, бульйонна культура ешерихій, агарова культура стафілокока, ізотонічний розчин натрію хлориду, предметні стекла, пінцет, бактеріологічна петля, спиртівка, сірники, маркер, банка з ватою, посудина для фарбування, вода для промивання препаратів, барвники (фуксин Пфейффера, метиленовий синій, папірці, пофарбовані за Синьовим, розчин Люголя), 96 % етиловий спирт, фільтрувальний папір для висушування препаратів, пуста чашка Пе-трі, гумові рукавички. План
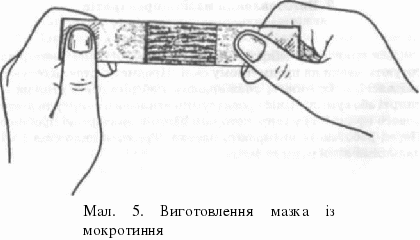
Хід заняття 1. Матеріал для мікроскопічного дослідження Виявлення патогенних мікроорганізмів в патологічному матеріалі за допомогою мікроскопа називається мікроскопічним методом лабораторної діагностики. Для мікроскопії використовують мокротиння, гній, кров, осад спинномозкової рідини і сечі, мазки зі слизових оболонок, зскрібок з уражених ділянок шкіри, уражене волосся, нігті, а також відбитки уражених органів. 2. Поняття про тинкторіальні властивості мікроорганізмів Мікроорганізми мають настільки малі розміри, що вивчати їх у незабарвленому вигляді під світловим мікроскопом неможливо, до того ж вони прозорі. Тому частіше їх вивчають у забарвленому стані. Вивчення мікроорганізмів у пофарбованому препараті дає змогу не тільки вивчити їх форму, розміщення, а й виявити деталі структури клітини (спору, капсулу), а також хімічний склад, через те, що різні хімічні речовини проявляють різну спорідненість до барвників і після фарбування мають різний колір або різну інтенсивність забарвлення. Здатність мікроорганізмів сприймати барвники називають тинкторіальною (від лат. НпсШга — настоянка) властивістю. 3. Виготовлення мазків-препаратів із патологічного матеріалу Для виявлення мікроорганізмів у патологічному матеріалі готують мазки на предметному склі. Предметні стекла готують заздалегідь. їх миють, знежирюють і зберігають в етиловому спирті або суміші Нікіфорова (суміш етилового спирту та діетилового ефіру 1:1) у широкогорлій банці з притертою пробкою. Перед роботою їх витирають насухо. Тримати скло слід І і II пальцями лівої руки за ребра. Завдання 1. Виготовте мазок із в'язкого матеріалу (мокротиння або гною). Увага! Під час роботи з патологічним матеріалом дотримуйтесь техніки безпеки. Алгоритм "Виготовлення мазка із в'язкого матеріалу":
Завдаїшя 2. Виготовте мазок із крові. Алгоритм "Виготовлення мазка із крові":
Увага! Правильно виготовлений мазок повинен мати світло-рожеве забарвлення і бути рівномірним за товщиною. Завдання 3. Виготовте препарат "товста крапля". Алгоритм "Виготовлення препарату "товста крапля":
Завдання 4. Ознайомтеся з методикою виготовлення мазків із слизу, взятого ізротоглотки (зіва), мазків-відбитків з органів і тканин, сечі, спинномозкової рідини. 1. Виготовлення мазка із слизу, взятого з ротоглотки. Мазок із ротоглотки беруть стерильним тампоном з мигдаликів, роблять мазок на предметному склі, висушують на повітрі, фіксують хімічним способом. 2. Виготовлення мазків-відбитків з органів і тканин секцій- ного матеріалу. 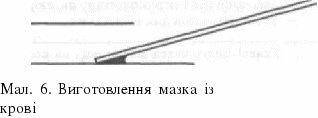 Поверхню органа припалюють пагрітими бланшами пінцета або нагрітим скальпелем. Зрізають поверхневий шар. З глибини вирізають невеликий шматочок тканини, беруть її пінцетом і прикладають поверхнею зрізу до предметного скла декілька разів. Отримують послідовиий ряд мазків-відбитків. Мазки фіксують хімічним способом. 3. Виготовлення мазків із сечі, ліквору (від лат. ^иог — спинномозкова рідина). Маленьку краплю рідини (сечі чи ліквору) бактеріологічною петлею наносять на предметне скло і розмазують до розміру монети вартістю 1 копійка. Висушують на повітрі, фіксують хімічним методом. Увага! Мазки, виготовлені з в'язкого матеріалу і крові, після перевірки викладачем опустіть у дезінфекційний розчин. 4. Виготовлення мазків із культури мікроорганізмів Мазки з культури мікроорганізмів виготовляють для вивчення їх морфології та тинкторіальних властивостей. Увага! Під час роботи з живими культурами ретельно дотримуйтесь правил техніки безпеки. Завдання 5. Виготовте мазок із бульйонної культури. Алгоритм "Виготовлення мазка із бульйонної культури":
Увага! Висушувати мазки слід на повітрі. Під впливом високої температури структура мікробної клітини порушується. Завдання 6. Виготовте мазок з агарової культури. Алгоритм "Виготовлення мазка з агарової культури":
Увага! Слід брати колонію мікроорганізмів, а не агар!
Увага! Мазок має бути тонким, прозорим, рівномірним, невеликим. Фіксування мазків. Мазки фіксують для: закріплення матеріалу на склі, знезараження, кращого фарбування (вбиті мікроби краще поглинають барвник). Для фіксації мазків використовують два способи: фізичний і хімічний. Фізичний спосіб. Фіксацію проводять у полум'ї спиртівки протягом 6 с. Для цього скло беруть піпцетом або І і II пальцями правої руки і проводять тричі повільно через верхню частину полум'я мазком догори. Правильність фіксації перевіряють, торкаючись нижньою поверхнею скла тильної сторони лівої руки. Мазок повинен бути гарячим, але не обпікати руку. Цим методом фіксують мазки, виготовлені з культури мікроорганізмів, за умови, що під час нагрівання не змінюється структура мікробної клітини. Хімічний спосіб. Для фіксації використовують хімічні речовини: безводний метиловий спирт — фіксують протягом 5 хв, спирт етиловий 96 % — 10—15 хв, суміш Нікіфорова — 10— 15 хв, ацетон — 5 хв, суміш парів хлоридної кислоти і формаліну — декілька секунд. Хімічним способом фіксують мазки, виготовлені із патологічного матеріалу, а також з культури в тому разі, коли під час нагрівання може порушитися структура бактеріальної клітини (кансульні форми бактерій, спірохети). Зафіксований мазок називається препаратом. Завдання 7. Зафіксуйте мазки, виготовлені з агарової і бульйонної культури, фізичним способом. Алгоритм "Фіксація мазка фізичним способом":
Увага ! Забороняється залишати на відкритих місцях або в неопечатаних сховищах незафіксовані мазки після закінчення роботи! 5. Фарбування препаратів простим методом і за Грамом Під час простого методу фарбування використовують один барвник — частіше це фуксин Пфейффера або метиленовий синій. Цей метод ще називається орієнтовним, оскільки його використовують тільки для виявлення мікробів у патологічному матеріалі, визначення їх кількості, форми, взаємного розташування. Завдання 8. Пофарбуйте препарат, виготовлений з бульйонної культури, фуксином Пфейффера, та препарат, виготовлений із агарової культури, метиленовим синім. Увага! Принцип фарбування однаковий. Алгоритм "Фарбування препарату простим методом":
Метод фарбування мазків-препаратів за Грамом належить до складних методів, тому що на мазок наносять два барвники, один з яких є основним, а інший — додатковим. Ці методи називають ще диференціальними, оскільки вони дають змогу розрізнити окремі групи бактерій, а також виявити хімічний склад і структуру бактеріальної клітини. Завдання 9. Виготовте два мазки: перший — з культури ешерихій, другий — з культури стафілокока. Зафіксуйте їх фізичним способом і пофарбуйте препарати за Грамом. Під час фарбування за Грамом бактерії поділяють на 2 групи: грампозитивні (забарвлюються в фіолетовий колір) та грам-негативні (забарвлюються в червоний колір). Різний колір забарвлення пояснюється різною будовою їх клітинної стінки. Основну частину клітинної стінки грампозитивних бактерій складає пептидоглікан — понад 90 %. Він має форму сітки. У грампозитивних бактерій він утворює 5—6, інколи до 40 шарів. Коли бактерії фарбують генціановим фіолетовим, а потім розчином Люголя, то утворюється нерозчинний у спирті і воді комплекс йоду з барвником. Цей комплекс не вимивається спиртом ;і водою через слабку проникність клітинної стінки (пеитидоглі-кану). Грампозитивні бактерії залишаються забарвленими у фіолетовий колір. Дофарбовування препарату фуксином Пфейф-фера не змінює фіолетового кольору клітин мікрооганізмів. У грамнегативних бактерій пептидоглікан утворює переважно один шар, зрідка — два. Тому комплекс генціанового фіолетового з йодом легко вимивається спиртом і водою, вна слідок чого бактерії знебарвлюються. Знебарвлені бактерії забарвлюються фуксином Пфсйффера у червоний колір. Алгоритм "Фарбування за Грамом":
Завдання 10. Підготуйте мікроскоп, розгляньте препарат, визначте форму, розміщення та колір бактеріальних клітин. 6. Ознайомлення з методикою фарбування препаратів для виявлення капсул, кислото-, спирто- та лугостійких бактерій, спор, включень Для виявлення капсул, кислото-, спирто- та лугостійких бактерій, спор і включень використовують складні методи фарбування. Для виявлення капсул препарат фарбують за Буррі—Гінсом. Для цього на предметному склі культуру змішують із краплею чорної туші, потім роблять мазок іншим предметним склом (як мазок із крові), висушують на повітрі, фіксують хімічним способом і, після промивання водою, наносять фуксин Пфейффера. Потім знову промивають водою і висушують на повітрі. Капсули містять понад 98 % води, тому погано утримують барвник. На темному фоні препарату капсули залишаються безбарвними, клітини бактерій набувають червоного кольору. Для виявлення кислотостійких мікобактерій туберкульозу, лепри, а також деяких актиноміцетів застосовують фарбування препарату за Цілем—Нільсеном. У цих мікроорганізмів у клітинній стінці міститься багато (понад 40 %) ліпідів, воску, оксикислот, що зумовлює їх стійкість до кислот, лугів, спиртів. Вона також малоироникна для розведених барвників, тому для фарбуваїшя використовують концентрований барвник (фуксии Ціля), що містить протраву (5 % фенолу). Фарбування проводять при нагріванні (в кии'ячому шарі). За таких умов всі елементи препарату (клітини макроорганізму, стороння мікрофлора і кислотостійкі мікобактерії) набувають червоного кольору. Після оброблення препарату сульфатною кислотою і водою кислотостійкі мікобактерії залишаються червоного кольору, всі інші елементи препарату знебарвлюються. Другим барвником, розведеним метиленовим синім, фарбують без підігрівання, тому він всередину клітини кислотостійких мікобактерій не проникає і вони не змінюють червоного забарвлення. Всі інші знебарвлені елементи препарату набувають синього кольору. При мікроскопії' па синьому фоні видно кислотостійкі мікобактерії червоного кольору. Для виявлення спор препарат фарбують за Ожешко. Щоб барвник проник всередину спори, перед фарбуванням мазок обробляють кислотою для розпушування оболонки спори. Після промивання водою його фіксують і фарбують за Цілем— Нільсеном. Вегетативні клітини набувають синього кольору, спора — червоного. Для виявлення включень препарат фарбують за Нейссером. Для цього на препарат наносять синьку Нейссера, потім розчин Люголя, після промивання водою па препарат наносять барвник везувін і знову промивають водою. Вегетативна клітина набуває жовтого кольору, зерна волютину —- темно-коричневого. Цей метод фарбування використовують для виявлення зерен волютину (у коринебактерій дифтерії). Завдання 11. Оформіть щоденник. Замалюйте в щоденнику кольоровими олівцями вигляд мікроорганізмів під мікроскопом. |