Практикум Люта. В. Л. Люта о. В. Кононов в а. Люта о. В. Кононов
 Скачать 1.23 Mb. Скачать 1.23 Mb.
|
|
Контрольні запитання
6. Як підписати чашку Петрі після посіву?
Тести 1. Номер аналізу підписують: а) на кришці чашки Петрі; б) на дні чашки Петрі; в) не має значення. 2. Чашки Петрі з посівом ставлять у термостат: а) догори кришкою; б) догори дном; в) не має значення. 3. Мікроби, що обов'язково ростуть за наявності кисню: а) мікроаерофіли; б) облігатні анаероби; в) облігатні аероби; г) факультативні аероби. 4. Фактор, що не потрібен для культивування мікробів: а) оптимальна температура; б) вологість; в) повітря; г) світло. 5. Середовища, найбільш сприятливі для певного виду мікробів: а) спеціальні; б) елективні; в) селективні; г) основні. 6. Ферменти, що розщеплюють білки: а) протеолітичні; б) сахаролітичні; в) уреаза; г) гіалуронідаза. Ситуаційні задачі
Домашнє завдання Підготуйтесь до практичного заняття 4. Рекомендації щодо самопідготовки до практичного заняття 4
Практичне заняття 4 ДЕЗІНФЕКЦІЯ. СТЕРИЛІЗАЦІЯ Мета заняття:
Оснащення: апаратура для стерилізації: стерилізатор паровий (автоклав), сухожарова шафа, інактиватор, апарат для зсідання й інактивації сироватки; тести для перевірки якості роботи стерилізаторів: максимальний і немаксимальний ртутні термометри, хімічні тести, біологічні тести, індикатори стерилізації; пінцет, вата, дезінфекційні засоби: 0,1 % розчин дезак-тину, стериліум. План
Хід заняття 1. Поняття про асептику та аптисептику Хімічні речовини, які згубно діють на мікроорганізми, але не впливають негативно на макроорганізм, та які застосовують для лікування інфекційних хвороб, називають антисептиками. Антисептика — це комплекс заходів, спрямованих на знищення мікроорганізмів або пригнічення їх росту на об'єкті (рана, організм). З цією мстою застосовують бактерицидні хімічні речовини. Асептика — система профілактичних заходів (дезінфекція, стерилізація), спрямована на запобігання мікробному забрудненню рани, операційного поля, культури мікроорганізмів та іи. Для проведення дезінфекції і стерилізації використовують різні методи залежно від того, який режим стерилізації вони забезпечують. 2. Дезіпфекція Завдання 1. Ознайомтеся з основними видами дезінфекції. Дезінфекція — це повне знищення вегетативних і спорових форм патогенних та умовно-патогенних мікроорганізмів у навколишньому середовищі (у приміщенні: підлога, стіни, ручки дверей; на поверхні меблів, апаратів, приладів; на посуді, білизні; у патологічному матеріалі, отриманому від хворих, тощо). Таблиця 2. Методи дезінфекції
Метою дезінфекції є запобігання передачі збудників від інфікованого організму до нсінфікованого через об'єкти навколишнього середовища. Методи проведення дезінфекції наведено у табл. 2. Дезінфекція буває поточною і заключною. Поточну дезінфекцію проводять багаторазово протягом дня в лікувально-профілактичних та інших закладах. Заключну проводять одноразово наприкінці робочого дня, або в осередку інфекції після госпіталізації хворого, переведення хворого в іншу палату, або після смерті пацієнта. Для дезінфекції використовують багато (понад 250) різних хімічних препаратів. Більшість із них випускають готовими для використання у вигляді концентрованої рідини, розчинів, таблеток, емульсій, суспензій, аерозолів. Дезінфекційні засоби, зареєстровані в Україні, застосовують відповідно до режимів, які регламентовані методичними вказівками і в установленому порядку затверджені головним державним санітарним лікарем України. Останнім часом в Україні зареєстровані ефективні дезінфекційні препарати для проведення поточної і заключної дезінфекції: МедіДес, Тетралін, КвікДсс, Сентамін та ін. їх можна використовувати для знезараження поверхні приміщень, твердих меблів, медичних приладів і апаратури, предметів догляду за хворими, лабораторного посуду, забрудненого виділеннями хворих, білизни, прибирального інвентарю, а таколс кухонного посуду. Для гігієнічного оброблення шкіри рук медичного персоналу рекомендовано препарати БактеріоСол, Октенісепт, Стериліум та ін. Дезінфекційні засоби можуть негативно впливати на макроорганізм, тому під час виготовлення дезінфекційних розчинів слід дотримуватися правил техніки безпеки (працювати в гумових рукавичках, герметичних окулярах, надягати чотиришарову марлеву пов'язку). 3. Стерилізація. Методи стерилізації медичного інструментарію, перев'язувального матеріалу, лабораторного посуду, поживних середовищ. Контроль якості роботи стерилізаторів і якості стерилізації Завдання 2. Ознайомтеся з методами стерилізації медичного інструментарію, перев'язувального матеріалу, лабораторного посуду, поживних середовищ. Стерилізація — це повне знезараження об'єктів навколишнього середовища (знищення вегетативних і спорових форм мікробів). Стерилізація дає змогу запобігти занесенню мікробів в організм людини під час медичних втручань; обсіменінню сторонньою мікрофлорою патологічного матеріалу, культур мікроорганізмів, які досліджують, а також поживних середовищ, лікарських і діагностичних препаратів. Способи стерилізації подані на схемі 1. Фізичний спосіб. Застосовують термічну, механічну та променеву стерилізацію. Термічні способи стерилізації наведено у табл. 3. 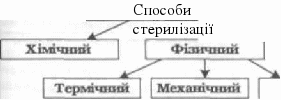 Е Біологічіпгіі Променсвиіі  Схема 1. Способи стерилізації
Стерилізація кип'ятінням є неповною, оскільки спори бактерій та деякі віруси не знищуються. Тому цей вид стерилізації часто відносять до дезінфекції. Під час пастеризації гинуть переважно молочнокислі бактерії. Дріжджі, спори та деякі вегетативні форми бактерій не гинуть. Завдання 3. Ознайомтеся з апаратурою для термічної стерилізації та тестами контролю якості роботи стерилізаторів. Стерилізацію паром під тиском проводять у паровому стерилізаторі (автоклаві), основними частинами якого є стерилізаційна камера, парогенератор, система трубопроводів, крани керування, манометр електроконтактний та мановакуумметр (манометр). Матеріал вміщують у стерилізаційну камеру, температура в якій залежить від тиску пари: при 0 атм — 100 °С, 0,5 атм — 112 °С, 1 атм — 120 °С, 1,5 атм — 126 °С, 2 атм — 132 °С. Температура і термін стерилізації визначаються якістю матеріалу і властивостями мікроорганізмів, якими він забруднений. Сухожарова шафа використовується для висушування лабораторного посуду за температури 100—105 °С, а також для стерилізації медичного інструментарію за 160 С протягом 150 хв або за180°С —60 хв. Інактиватор використовують для інактивації сироватки крові (комплемент сироватки крові переходить у неактивний стан за температури 56 °С протягом ЗО хв), а також для багаторазової стерилізації — тиндалізації. Апарат для зсідання, інактивації сироватки крові, зсідання яєчних і сироваткових поживних середовищ використовуюють одночасно і для їх стерилізації за температури 90 °С по 60 хв 2 доби поспіль. Контроль температури в стерилізаційній камері проводять за допомогою трьох видів тестів: фізичного, хімічного та біологічного. Фізичний метод полягає у використанні максимального термометра в паровому стерилізаторі (автоклаві) і звичайного ртутного термометра в сухоясаровій шафі та інактиваторах. Хімічний метод — використання кристалічних хімічних речовин з певною температурою плавлення: бензонафтол — 110 °С, антипірин — 113 °С, резорцин, сірка — 119 °С, бензойна кислота, бета-нафтол — 120 °С, сечовина, фенацетин, манноза — 132 С, саліцилова кислота, стрептоцид — 160 С, тіосечови-на, альбуцид — 180 °С. Одну з цих речовин змішують із невеликою кількістю барвника (фуксину або метиленового синього) і вміщують у трубочку, яку потім запаюють. Ці трубочки вміщують у стерилізаційні коробки разом із матеріалом, що стерилізується. Якщо температура в стерилізаційній камері сягає певного рівня, то хімічна речовина в трубочці розплавляється, змішується з барвником і забарвлюється в його колір. Нині випускають паперові індикатори стерилізації, які змінюють забарвлення за певної температури: 1С — 120, 1С — 132 °С та ін. Біологічний метод — використання біотестів (від грец. bios — життя і англ. test— проба, дослідження). Біотести виготовляють відповідно до методичних рекомендацій "Лабораторный контроль качества дезинфекционных мероприятий в ЛПУ" (Харків, 1988). Для їх виготовлення використовують тест-культуру (мікроорганізми з групи аптракоїдів, які витримують кип'ятіння протягом 25—30 хв і вплив текучої пари температурою 100 °С протягом 4—6 хв) або зразки ґрунту, що містять спори термостабільних сапрофітів (витримують температуру 120 °С протягом 2—3 хв). У стерилізатор вміщують щонайменше 5 біотестів (у різних його місцях) та 1 (контрольний тест) залишають за кімнатної температури. Після стерилізації змиви з біотестів засівають на поживні середовища. У змивах з тих біотестів, що перебували в стерилізаторах, росту культури не повинно бути, у змивах з контрольного тесту — рясний ріст культури. Якщо з'являється ріст культури у змивах, взятих із тестів, що перебували в стерилізаторі, перевіряють технічний стан апарата. Здебільшого біотести використовують у парових стерилізаторах і дезінфекційних камерах. З метою профілактики внутрішньолікарняних інфекцій контролюють не тільки режим роботи стерилізаторів, а й якість стерилізації. Для цього стерильний матеріал відбирають в асептичних умовах. Від великих об'єктів (бинти, простирадла, шовний матеріал) відрізають стерильними ножицями шматочки; серед дрібних предметів — відбирають по декілька штук стерильним пінцетом з різних місць біксу; з хірургічного інструментарію, іншого обладнання роблять змиви стерильними серветками, змоченими стерильним ізотонічним розчином натрію хлориду. Дослідження проводять у стерильному боксі в асептичних умовах. Змиви з усіх відібраних об'єктів засівають на поживні середовища, дрібні об'єкти занурюють у поживне середовище. З мстою самоконтролю посів проводять на одне поживне середовище у дві паралельні пробірки. Для виявлення анаеробів використовують тіогліколеве середовище, яке інкубують за 32 °С протягом 8 діб. Для виявлення грибів використовують середовище Сабуро, яке інкубують за 22 °С протягом 8 діб. Матеріал вважають стерильним, якщо в усіх посівах відсутні ознаки росту мікроорганізмів. Механічна стерилізація (холодна стерилізація) проводиться методом фільтрації через бактеріальні фільтри (мембранні, каолінові та ін.). Використовують для стерилізації розчинів, що не витримують нагрівання (поживне середовище, що містить розчинений білок, сироватку крові, антибіотик). Ця стерилізація неповна, оскільки у фільтраті зберігаються віруси, тому її використовують також для відокремлення вірусів від бактерій, у тому числі і фагів. Променева стерилізація. Використовують ультрафіолетове випромінювання (бактерицидні лампи). Цим методом зпезаражують повітря, поверхні приміщень (операційної, пологових залів, боксів), предметів, обладнання, воду, харчові продукти. Радіаційне випромінювання використовують для знезараження шприців, систем для переливання крові, посуду та інших предметів одноразового використання. Хімічний спосіб. Хімічну допоміжну стерилізацію застосовують тоді, коли неможливо використати термічну (табл. 4). Таблиця 4. Хімічні способи стерилізації
Біологічний спосіб. Біостерилізація ґрунтується на застосуванні антибіотиків. її використовують під час культивування вірусів і деяких видів бактерій (бордетел, менінгококів). |
