В. Н. Сайтаниди Рецензент членкорреспондент расхн в. Ф. Красота Петухов В. Л. и др. П31 Ветеринарная генетика В. Л. Петухов, А. И. Жигачев, Г. А. Назарова. 2е изд., перераб и доп. М. Колос, 1996. 384 с ил. Учебники
 Скачать 5.3 Mb. Скачать 5.3 Mb.
|
|
Теории иммунитета. В регуляции иммунитета на внутриклеточном уровне принимают участие Ir-гены. На межклеточном уровне в регуляции участвуют различные вещества, выделяемые Т-лимфоцитами и в меньшей мере В-лимфоцитами. Антитела также выполняют регуляторные функции. На уровне организма регуляция осуществляется нейрогуморальной системой. Из многих теорий иммунитета наибольшее признание получи-лаклональнО'Селекционная теория Ф. Бернета (1959). Она основана на четырех основных принципах: 1) в организме имеется большое число лимфоидных клеток; 2) популяция лимфоидных клеток гетерогенна, и в результате интенсивного деления клеток образуется большое число клонов (популяция клеток, происходящая от одного предшественника); 3) небольшое количество антигена стимулирует клон клеток к размножению; 4) большое количество антигена элиминирует соответствующий клон. Согласно этой теории антиген, взаимодействуя с Антиген . 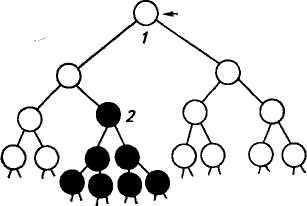 рецептором клетки (В-клетки), вызывает ее интенсивную про- рецептором клетки (В-клетки), вызывает ее интенсивную про-,Ь лиферацию (деление), в резуль- |: тате чего образуется клон, син- * тезирующий антитела одной 'Специфичности. Все клетки клона имеют один и тот же ге- '. нотип. При соматических мутациях одного клона могут возникать новые клоны (рис. 55). Рис. 55. Клон В-клеток (/) и новый клон клеток, возникший в результате мутации (2) 241 Сетевую теорию регуляции иммунитета предложил Н. Ерне (1974). Согласно этой теории антитела не только узнают антиген, но и сами являются антигенами. Такая ситуация возникает потому, что в период диф-ференцировки организм с антителами не встречался, поэтому они выступают в роли антигена, на который вырабатываются антиантитела. Полагают, что антигенные детерминанты антител (идио-типы) — важный фактор регуляции системы иммунитета. Во время иммунологической реакции повышение концентрации идиотипов стимулирует антиидиотипическую активность. Анти-идиотипические реакции осуществляют ауторегуляцию иммунного ответа. Нарушение регуляции иммунного ответа приводит ко многим болезням, и прежде всего аллергическим, предрасположенность к которым зависит и от генотипа организма. ГЛАВНЫЙ КОМПЛЕКС ГИСТОСОВМЕСТИМОСТИ (МНС) При первой пересадке сердца человека, сделанной в 1967 г. К. Барнардом, и сотнях последующих хирурги столкнулись с проблемой отторжения трансплантата. Оказалось, что главная трудность заключается не в технике операции, которая сейчас разработана достаточно хорошо, а в несовместимости тканей, обусловленной иммунологическими механизмами. Так, у человека выживание трансплантатов реципиентов, взятых от случайного донора, составляет 10,5 дня, тогда как трансплантаты, обмененные между однояйцовыми близнецами (изотрансплантаты), приживаются. Это происходит благодаря наличию на поверхности клеток антигенов, называемых трансплантационными антигенами или антигенами гистосовместимости. Большинство трансплантационных антигенов расположены на лейкоцитах, но они имеются и на всех других ядросодержащих клетках (клетках кожи, легких, печени, почек, кишечника, сердца и т. д.). Гены, кодирующие эти антигены, называются генами тканевой совместимости. Система генов, контролирующая трансплантационные антигены лейкоцитов, названа главным комплексом гистосовместимости (англ. Major Histocompatibility complex — МНС). Гены гистосовместимости кодоминантны. Эффективность трансплантации зависит не только от лейкоцитарных и эритроцитарных антигенов, но и от минорной системы гистосовместимости. Трансплантаты между монозиготными близнецами приживаются. Однако у братьев и сестер при совпадении по МНС-гаплотипам, но несовпадении по минорным системам гистосовместимости происходит отторжение трансплантатов кожи. После иммуноглобулинов и рецепторов Т-клеток белки главного комплекса гистосовместимости самые разнообразные из всех белков. Различают два класса белков МНС. Белки класса I находятся на поверхности почти всех клеток. Молекула белка состоит из двух полипептидных цепей: большой и малой. Белки 242 МНС класса II имеются на поверхности некоторых клеток (В-' лимфоциты, макрофаги, специализированные эпителиальные ., клетки), а их молекула состоит из примерно равных полипептид-* ных цепей. Белки МНС имеют некоторое сходство с иммуноглобулинами. Основная роль белков МНС состоит не в отторжении чужой ткани, а в направлении реакции Т-клеток на антиген. Цитотоксические Т-клетки могут узнавать антиген, если он расположен вместе с белками МНС класса I на поверхности одной клетки. Т-хелперы узнают антиген в комбинации с белками МНС класса П. Такое двойное стимулирование называется МНС-о граничением. Впервые главную систему тканевой совместимости мыши Н-2 открыл П. Горер в 1936 г. Кроме Н-2 найдено много локусов тканевой совместимости, расположенных во всех хромосомах. В 1980 г. Д. Снелл, Ж. Доссе и Б. Бенацерафф получили Нобелевскую премию за «различные аспекты исследования, приведшего к современному пониманию системы генов гистосовместимости человека». Д. Снелл сформулировал основные генетические законы совместимости тканей и получил данные о тонком строении локуса Н-2 у мышей. Система Н-2 довольно хорошо изучена, поэтому она служит хорошей моделью для исследования МНС у других видов животных. Комплекс Н-2 включает несколько тесно сцепленных локусов длиной 0,35 сМ, расположенных в 17-й хромосоме. Комплекс Н-2 разделен на пять областей: К, I, S, G, D (рис. 56). ПсМ 11 Хромосома/7 SsSlp Лонусы Субобпасти Области я О в 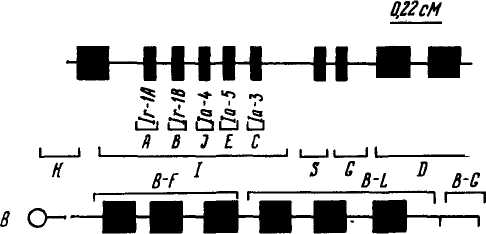 ;зсм ;зсмlr CAT la fffcM6сМ 0,05см 0,5 сМ С , c S  U UРис. 56. Схема сцепления локусов главного комплекса гистосовместимости: А—Н-2 у мыши; В— В у кур; С— SLA у свиней (по Hruban, 1981) 243 Трансплантационные антигены кодируются локусами Н-2К и H-2D и называются серологически выявляемыми или SD (Se-rologically Defined). Эти локусы относятся к классу I. Область I относится к классу II и включает пять субобластей, в которой расположены гены иммунного ответа (Ir-гены) и гены, кодирующие la-антигены (англ. Immune associated). la-антигены играют основную роль при взаимодействии В-, Т-лимфоцитов и макрофагов, а также принимают участие в действии Т-супрессоров. Область G относится к III классу, ее гены контролируют синтез С4 компонента комплемента. В комплексе Н-2 есть антигены, выявляемые не серологически, а определяемые в смешанной культуре лимфоцитов (англ. Mixed lymphocyte culture — MLC, Mixed lymphocyte reaction — MLR), которые называют LD (Lymphocyte Defined). Почти все локусы комплекса Н-2 имеют многочисленные аллельные формы. ^.Главный комплекс гистосовместимости открыт у многих видов (табл. 37). У человека он обозначен HLA (Human leycocyte antigen — антиген лейкоцитов человека), у крупного рогатого скота — BoLA (Bovine leycocyte antigen), у свиней — SLA (Susscrofa leycocyte antigen), у овец — OLA (Ovine leycocyte antigen), у коз — GLA, у лошадей — ELA (Equine leycocyte antigen), у кур — В (этот локус контролирует и систему групп крови В), у кроликов — Н-1. 37. МНС у домашних животных, в том числе птицы
244 Главный комплекс гистосовместимости крупного рогатого скота BoLA контролируется кодоминант-ными аллелями классов I (SD) и II (LD) локусов. В классе I выявлено 17 антигенов (W1 — 10 и т. д.), в классе II — 11 антигенов. Открыты также la-антигены, а в классе II идентифицированы Ir-гены. Установлено, что BoLA сцеплен с М-системой групп крови, между которыми частота рекомбинации равна 0,04. В нашей стране впервые исследования МНС BoLA были проведены под руководством академика В. П. Шишкова. МНС свиней SLA состоит из четырех тесно сцепленных локусов (см. рис. 56). Три локуса (А, В, С) контролируют класс трансплантационных 1-антигенов. Продукты этих генов сходны с теми, которые детерминируются субобластями А, В, С у человека И Н-2К и H-2D у мышей. Четвертый локус (D) включает гены, которые кодируют серологически определяемые молекулы класса II и реакцию смешанных лимфоцитов. Гены иммунного ответа (1г) сцеплены с главным комплексом гистосовместимости. В настоящее время ряд исследователей картировали главный комплекс гистосовместимости на 7-й хромосоме. Предполагают, что гены класса I находятся на 7-й хромосоме в районе р12 ql2. Установлены высокодостоверные межпородные различия по антигенам SLA. Так, частота гашютипа d у свиней породы дюрок равна 0,92, а у ландрасов — 0,11. Система О L А овец включает три тесно сцепленных локуса: А, В, С. Частота рекомбинаций между локусами А и В составляет 0,6 %. Описано 16 антигенов OLA: OLA-A1, А2, А4, А8, А10, А13; OLA-B3, В6, В7, В9, В12; OLA-C14, С15, С17; антигены 8L и 16L еще не картированы. Всего идентифицировано 26 гаплотипов комплекса OLA. Кроме того, имеется два, минорных лимфоцитарных антигена, не входящих в OLA. Этб локусы OL-X и OL. Система ELA лошадей классов I и II контролируется двумя локусами. Не установлено, что антигенные специфичности ELA W1-W10 и Lex8 наследуются аллогруппами. Выявлены межпородные различия по частоте антигенов. В одном исследовании у чистокровных лошадей наблюдали«эксцесс животных с антигенами W5 и Lex8 и недостаток у кобыл с W2 и W3. Главный комплекс гистосовместимости кур (В) состоит из трех сублокусов BG, BF, BL, расположенных на одной хромосоме. Между локусами BG и BF/BL рекомбинации встречаются очень редко (1/2000), но не наблюдались между BF и BL. Область BF кодирует антигены на эритроцитах, лейкоцитах и клетках других тканей. Область BL кодирует антигены на макрофагах и В-лимфоцитах, которые у кур являются la-антигенами. Ir-гены детерминируют иммунный ответ к различным антигенам, включая, возможно, и некоторые антигены опухолей. Область BG контролирует антигены только на эритроцитах. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
