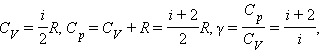Вопросы к экзамену. Вопросы к экзамену (зачету)
 Скачать 2.73 Mb. Скачать 2.73 Mb.
|
|
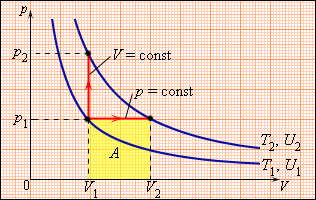
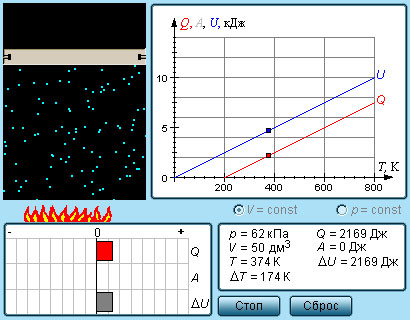
Количество теплоты – это одна из форм изменения внутренней энергии в результате микропроцессов, т.е. процессов, происходящих с отдельными частицами. Термодинамическая работа – это одна из форм изменения внутренней энергии в результате макропроцессов, т. е. процессов, происходящих над всей системой. Величины, изменение которых не зависит от формы процессов, а определяется только начальными и конечными параметрами состояния, называется функциями состояния. Пример – внутренняя энергия. В противном случае (если зависит от формы процесса) – функциями процесса. Пример – термодинамическая работа и количество теплоты. DU = A¢ + Q A¢ - работа, совершаемая над системой внешними силами A = -A¢ - работа, совершаемая системой над внешними телами. Первое начало термодинамики (ПНТ). Количество теплоты, сообщаемое системе, затрачивается на приращение внутренней энергии системы и совершение системой работы над внешними телами: 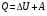 ПНТ в интегральной форме: ПНТ в интегральной форме: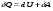 ПНТ в дифференциальной форме: ПНТ в дифференциальной форме: Первое начало термодинамики – это следствие закона сохранения энергии, поэтому ПНТ носит универсальный характер. Вторая формулировка ПНТ: Невозможно построить вечный двигатель первого рода, т.е. такой периодически действующий тепловой двигатель, который бы работал без затрат энергии извне. Q = 0, DU = A¢ Запас внутренней энергии у тела не безграничен, следовательно, по исчерпании этого запаса такой двигатель должен остановиться. 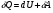 Все физические величины входящие в ПНТ: Все физические величины входящие в ПНТ:могут быть как положительными, так и отрицательными. Возможны случаи когда δQ, δА или dU равны нулю. Например: dU = 0 – изотермический процесс; δА = 0 – изохорный процесс; δQ = 0 – адиабатический процесс. Если к системе подводиться теплота, то δQ>0; если отводиться, то δQ<0. Если температура термодинамической системы увеличивается, то изменение внутренней энергии считается положительным (dU>0), если температура уменьшается, то изменение внутренней энергии считается отрицательным (dU<0). Работа газа при изменении объема. Найдем работу, которую совершает ИГ при расширении или сжатии, заключенного в сосуде с подвижным поршнем площадью S (рис. 1). 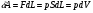 Если газ расширяясь, передвигает поршень на бесконечно малое расстояние dL, то производит над ним работу Если газ расширяясь, передвигает поршень на бесконечно малое расстояние dL, то производит над ним работу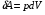 где S– площадь поршня; SdL=dV – изменение объема системы; р – давление, которое производит газ на поршень. 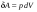 Термодинамическая работа для малого равновесного процесса: Термодинамическая работа для малого равновесного процесса: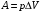 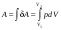 В общем случае или , где р = const. Давление р газа всегда положительно. Поэтому при расширении газа (dV>0), газ совершает положительную работу (δА>0). Если газ сжимается, то dV<0 и δА<0. В этом случае положительную работу над газом совершают силы внешнего давления. Произведенную при том или ином процессе работу можно изобразить графически, с помощью кривой в координатах pV. Пусть изменение давления газа при его расширении изображается кривой (рис. 2). При увеличении объема на dV совершаемая газом работа равна pdV, т.е. определяется площадью плоскости с основанием dV, тонированной на рисунке. Поэтому полная работа, совершаемая газом при расширении от объема V1 до V2, определяется площадью, ограниченной осью абсцисс, кривой p=f(V) и прямыми V1 и V2. Графически можно изображать только равновесные процессы – процессы, состоящие из последовательности равновесных состояний. Они протекают так, что изменение термодинамических параметров за конечный промежуток времени бесконечно мало. Всереальные процессынеравновесны (они протекают с конечной скоростью), но в ряде случаев неравновесностью реальных процессов можно пренебречь (чем медленнее протекает процесс, тем он ближе к равновесному). Недостатки первого начала термодинамики. Первое начало термодинамики (ПНТ) устанавливает количественное соотношение между теплотой, работой и изменением внутренней энергии тела. ПНТ не определяет направление термодинамического процесса. Недостатки первого начала термодинамики Во-первых. Согласно ПНТ возможны такие самопроизвольные процессы, которые в природе не существуют. Например: процесс самопроизвольной передачи тепла от холодного тела к горячему не противоречит ПНТ. Во-вторых. ПНТ не исключает возможности такого процесса, единственным результатом которого было бы превращение всего тепла, полученного от какого-либо тела, в эквивалентную работу. В-третьих. ПНТ не исключает возможности построить вечный двигатель второго рода. Вечный двигатель второго рода – это такой периодически действующий двигатель, который совершал бы работу за счет самопроизвольного охлаждение тел до температур более низких, чем температура окружающих тел. 32. Теплоемкость идеальных газов. Теплоёмкость идеальных газов. Если в результате теплообмена телу передается некоторое количество теплоты, то внутренняя энергия тела и его температура изменяются. Количество теплоты Q, необходимое для нагревания 1 кг вещества на 1 К называют удельной теплоемкостью вещества c. c = Q / (mΔT). Во многих случаях удобно использовать молярную теплоемкость C: C = M · c, где M – молярная масса вещества. Определенная таким образом теплоемкость не является однозначной характеристикой вещества. Согласно первому закону термодинамики изменение внутренней энергии тела зависит не только от полученного количества теплоты, но и от работы, совершенной телом. В зависимости от условий, при которых осуществлялся процесс теплопередачи, тело могло совершать различную работу. Поэтому одинаковое количество теплоты, переданное телу, могло вызвать различные изменения его внутренней энергии и, следовательно, температуры. Такая неоднозначность определения теплоемкости характерна только для газообразного вещества. При нагревании жидких и твердых тел их объем практически не изменяется, и работа расширения оказывается равной нулю. Поэтому все количество теплоты, полученное телом, идет на изменение его внутренней энергии. В отличие от жидкостей и твердых тел, газ в процессе теплопередачи может сильно изменять свой объем и совершать работу. Поэтому теплоемкость газообразного вещества зависит от характера термодинамического процесса. Обычно рассматриваются два значения теплоемкости газов: CV – молярная теплоемкость в изохорном процессе (V = const) и Cp – молярная теплоемкость в изобарном процессе(p = const). В процессе при постоянном объеме газ работы не совершает: A = 0. Из первого закона термодинамики для 1 моля газа следует
Изменение ΔU внутренней энергии газа прямо пропорционально изменению ΔT его температуры. Для процесса при постоянном давлении первый закон термодинамики дает:
где ΔV – изменение объема 1 моля идеального газа при изменении его температуры на ΔT. Отсюда следует:
Отношение ΔV / ΔT может быть найдено из уравнения состояния идеального газа, записанного для 1 моля:
где R – универсальная газовая постоянная. При p = const
Таким образом, соотношение, выражающее связь между молярными теплоемкостями Cp и CV, имеет вид (формула Майера):
Молярная теплоемкость Cp газа в процессе с постоянным давлением всегда больше молярной теплоемкости CV в процессе с постоянным объемом (рис. 3.10.1).
Отношение теплоемкостей в процессах с постоянным давлением и постоянным объемом играет важную роль в термодинамике. Оно обозначается греческой буквой γ.
В частности, это отношение входит в формулу для адиабатического процесса Между двумя изотермами с температурами T1 и T2 на диаграмме (p, V) возможны различные пути перехода. Поскольку для всех таких переходов изменение температуры ΔT = T2 – T1 одинаково, следовательно, одинаково изменение ΔU внутренней энергии. Однако, совершенные при этом работы Aи полученные в результате теплообмена количества теплоты Q окажутся различными для разных путей перехода. Отсюда следует, что у газа имеется бесчисленное количество теплоемкостей. Cp и CV – это лишь частные (и очень важные для теории газов) значения теплоемкостей.
Термодинамические процессы, в которых теплоемкость газа остается неизменной, называются политропическими. Все изопроцессы являются политропическими. В случае изотермического процесса ΔT = 0, поэтому CT = ∞. В адиабатическом процессе ΔQ = 0, следовательно, Cад = 0. Следует отметить, что «теплоемкость», как и «количество теплоты» – крайне неудачные термины. Они достались современной науке в наследство от теории теплорода, господствовавшей в XVIII веке. Эта теория рассматривала теплоту как особое невесомое вещество, содержащееся в телах. Считалось, что оно не может быть ни создано, ни уничтожено. Нагревание тел объяснялось увеличением, а охлаждение – уменьшением содержащегося внутри них теплорода. Теория теплорода несостоятельна. Она не может объяснить, почему одно и то же изменение внутренней энергии тела можно получить, передавая ему разное количество теплоты в зависимости от работы, которую совершает тело. Поэтому лишено физического смысла утверждение, что «в данном теле содержится такой-то запас теплоты». В молекулярно-кинетической теории устанавливается следующее соотношение между средней кинетической энергией поступательного движениямолекул и абсолютной температурой T:
Внутренняя энергия 1 моля идеального газа равна произведению на число Авогадро NА:
При изменении температуры на ΔT внутренняя энергия изменяется на величину
Коэффициент пропорциональности между ΔU и ΔT равен теплоемкости CV при постоянном давлении:
Это соотношение хорошо подтверждается в экспериментах с газами, состоящими из одноатомных молекул (гелий, неон, аргон). Однако, для двухатомных (водород, азот) и многоатомных (углекислый газ) газов это соотношение не согласуется с экспериментальными данными. Причина такого расхождения состоит в том, что для двух- и многоатомных молекул средняя кинетическая энергия должна включать энергию не только поступательного, но и вращательного движения молекул.
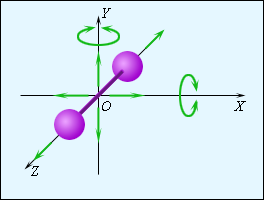
На рис. 3.10.2 изображена модель двухатомной молекулы. Молекула может совершать пять независимых движений: три поступательных движения вдоль осей X, Y, Z и два вращения относительно осей X и Y. Опыт показывает, что вращение относительно оси Z, на которой лежат центры обоих атомов, может быть возбуждено только при очень высоких температурах. При обычных температурах вращение около оси Z не происходит, так же как не вращается одноатомная молекула. Каждое независимое движение называется степенью свободы. Таким образом, одноатомная молекула имеет 3 поступательные степени свободы, «жесткая» двухатомная молекула имеет 5 степеней (3 поступательные и 2 вращательные), а многоатомная молекула – 6 степеней свободы (3 поступательные и 3 вращательные). В классической статистической физике доказывается так называемая теорема о равномерном распределении энергии по степеням свободы: Если система молекул находится в тепловом равновесии при температуре T, то средняя кинетическая энергия равномерно распределена между всеми степенями свободы и для каждой степени свободы молекулы она равна Из этой теоремы следует, что молярные теплоемкости газа Cp и CV и их отношение γ могут быть записаны в виде
где i – число степеней свободы газа. Для газа, состоящего из одноатомных молекул (i = 3)
Для газа, состоящего из двухатомных молекул (i = 5)
Для газа, состоящего из многоатомных молекул (i = 6)
Экспериментально измеренные теплоемкости многих газов при обычных условиях достаточно хорошо согласуются с приведенными выражениями. Однако, в целом классическая теория теплоемкости газов не может считаться вполне удовлетворительной. Существует много примеров значительных расхождений между теорией и экспериментом. Это объясняется тем, что классическая теория не в состоянии полностью учесть энергию, связанную с внутренними движениями в молекуле. Теорему о равномерном распределении энергии по степеням свободы можно применить и к тепловому движению частиц в твердом теле. Атомы, входящие в состав кристаллической решетки, совершают колебания около положений равновесия. Энергия этих колебаний и представляет собой внутреннюю энергию твердого тела. Каждый атом в кристаллической решетке может колебаться в трех взаимно перпендикулярных направлениях. Следовательно, каждый атом имеет 3 колебательные степени свободы. При гармонических колебаниях средняя кинетическая энергия равна средней потенциальной энергии. Поэтому в соответствии с теоремой о равномерном распределении на каждую колебательную степень свободы приходится средняя энергия kT, а на один атом – 3kT. Внутренняя энергия1 моля твердого вещества равна:
Поэтому молярная теплоемкость вещества в твердом состоянии равна:
Это соотношение называется законом Дюлонга–Пти. Для твердых тел практически не существует различия между Cp и CV из-за ничтожно малой работы при расширении или сжатии. Опыт показывает, что у многих твердых тел (химических элементов) молярная теплоемкость при обычных температурах действительно близка к 3R. Однако, при низких температурах наблюдаются значительные расхождения между теорией и экспериментом. Это показывает, что гипотеза о равномерном распределении энергии по степеням свободы является приближением. Наблюдаемая на опыте зависимость теплоемкости от температуры может быть объяснена только на основе квантовых представлений. |