Вопросы к зачётуэкзамену по патологической физиологии
 Скачать 1.35 Mb. Скачать 1.35 Mb.
|
|
Излучение лазера. Лазер способен излучить монохроматические пучки света с малым углом расхождения. Лучи действуют на ткань очень короткий промежуток времени (стотысячные доли секунды), поглощаются они пигментированными тканями, эритроцитами, меланомами и пр. Лучи лазера разрушают живые ткани, особенно чувствительны к ним опухоли. Повреждение биологического объекта происходит в результате термического действия луча на ткани и поглощения ими тепловой энергии. В тканях и клетках одновременно образуются токсические вещества и изменяется действие тканевых ферментов. Кроме того, возможно механическое действие вследствие мгновенного перехода твердых и жидких веществ в газообразное состояние и повышения внутриклеточного давления (до нескольких десятков и сотен атмосфер). Болезнетворные воздействия химических факторов. Химические вещества в зависимости от их дозировки и состава нередко являются причиной самых различных заболеваний (чаще всего это отравления животных). Ядовитые химические вещества бывают органического и неорганического происхождения. К неорганическим ядам относят кислоты, щелочи, соли тяжелых металлов и др.; к органическим — эфир, хлороформ, фенольные и цианистые соединения. Органические яды, в свою очередь, подразделяют на растительные (алкалоиды, глюкозиды) и животные (продукты гниения, брожения, змеиный яд и др.). В зависимости от преимущественного» действия ядов на те или иные клетки и ткани организма различают: энтеротропные яды — вызывают поражение органов пищеварения и печени; это соли тяжелых металлов (железа, серебра, ртути, цинка, свинца, меди, висмута), металлоиды (мышьяк, фосфор, соединения бария), некоторые растительные яды (морфий, сапонины и др.); нейротоксические яды — действуют в основном на почечную ткань (соли тяжелых металлов, фосфор, мышьяк, эфирные масла, кантаридин и др.); нервные яды (стрихнин, мышьяк); сердечные яды (наперстянка, дифтерийный яд); кровяные яды (пирогалол, окись углерода); сосудистые яды (бария хлорид, мышьяк); костные яды (ртуть, фосфор); протоплазматические яды (хлор, цианистые соединения) наркотики. Различают отравления, возникающие в результате поступления химических веществ извне (экзогенные яды) и отравления, вызываемые образовавшимися в организме токсическими продуктами (эндотоксинами). Все перечисленные выше ядовитые вещества являются экзотоксинами. К эндотоксинам относят преимущественно продукты обмена веществ и распада тканей. Отравление организма, вызванное эндотоксинами, называются аутоинтоксикацией. Защитно-приспособительные процессы в клетке при действии повреждающих факторов. Действие на клетку патогенных факторов сопровождается активацией (или включением) различных реакций и процессов, направленных на устранение либо уменьшение степени повреждения и его последствий, а также обеспечивающих устойчивость клеток к повреждению. Комплекс этих реакций направлен на приспособление (адаптацию) клетки к изменившимся условиям ее жизнедеятельности, без которых полноценное функционирование клеток невозможно. К числу основных приспособительных механизмов в условиях повреждения относят реакции компенсации — восстановления и замещения утраченных или поврежденных структур и нарушенных функций, а также регуляторное снижение их функциональной активности. Их можно разделить на две группы: внутриклеточные и внеклеточные (межклеточные). К внутриклеточным механизмам компенсации при повреждении клетки относятся: ‒ компенсация нарушений энергетического обеспечения клеток; ‒ защита мембран и ферментов клеток; ‒ уменьшение степени или устранение дисбаланса ионов и жидкости в клетках; ‒ устранение нарушений в генетической программе клеток; ‒ компенсация расстройств механизмов регуляции внутриклеточных процессов; ‒ снижение функциональной активности клеток; ‒ регенерация; ‒ гипертрофия; ‒ гиперплазия. Компенсация нарушений процесса энергетического обеспечения клеток. Одним из способов компенсации нарушений энергетического обмена вследствие поражения митохондрий является интенсификация процесса гликолиза. Защита мембран и ферментов клеток. Одним из механизмов защиты мембран и ферментов клеток является ограничение свободнорадикальных и перекисных реакций ферментами антиоксидантной защиты (супероксиддисмутазой, каталазой, глютатионпероксидазой). Другим механизмом защиты мембран и энзимов от повреждающего действия, в частности ферментов лизосом, может быть активация буферных систем клетки. Компенсация дисбаланса ионов и жидкости. Уменьшить или устранить дисбаланс содержания ионов в клетке можно путем активации механизмов энергетического обеспечения ионных насосов, а также защиты мембран и ферментов, принимающих участие в транспорте ионов.. Устранение нарушений в генетической программе клеток и механизмах ее реализации. Повреждения участка ДНК могут быть обнаружены и устранены с участием ферментов репаративного синтеза ДНК. Компенсация расстройств механизмов регуляции внутриклеточных процессов. К такого рода реакциям относятся: изменение количества рецепторов гормонов, нейромедиаторов и других физиологически активных веществ на поверхности клетки, а также чувствительности рецепторов к этим веществам Снижение функциональной активности клеток. В результате снижения функциональной активности клеток уменьшается расходование энергии и субстратов, необходимых для осуществления функций и реализации пластических процессов. Регенерация (regeneratio — возрождение, восстановление) означает восстановление числа клеток и/или их отдельных структурных элементов взамен погибших, поврежденных или закончивших свой жизненный цикл. Гипертрофия (hyper — чрезмерно, увеличение, trophe — питаю) представляет собой увеличение объема и массы структурных элементов, в частности клеток. Гипертрофия неповрежденных органелл клетки компенсирует нарушение или недостаточность функций ее поврежденных элементов. Гиперплазия (hyper — чрезмерно, plaseo — образую) характеризуется увеличением числа клеток или структурных элементов, в частности органелл в клетке. Межклеточные механизмы.В пределах тканей и органов клетки не разобщены. Они взаимодействуют друг с другом путем обмена метаболитами, физиологически активными веществами, ионами. В свою очередь взаимодействие клеток тканей и органов в организме в целом обеспечивается функционированием систем лимфо- и кровообращения, эндокринными, нервными и иммунными влияниями. Характерной чертой межклеточных (внеклеточных) механизмов адаптации и компенсации является то, что они реализуются в основном при участии клеток, которые не подвергались непосредственному действию патогенного фактора (например, гиперфункция кардиомиоцитов за пределами зоны некроза при инфаркте миокарда). По уровню и масштабу такие реакции при повреждении клеток можно разделить на -1. органно-тканевые (например,активация функции неповрежденных клеток печени или почки при повреждении клеток части органа) -2.внутрисистемные (например, расширение артериол при снижении работы сердца (при инфаркте миокарда), что обеспечивает работоспособность и предотвращает (или уменьшает степень) повреждение кардиомиоцитов.) -3.межсистемные. (при общей гипоксии. При этом активируется работа систем дыхания, кровообращения, крови и тканевого метаболизма, что снижает недостаток кислорода и субстратов метаболизма в тканях, повышает их утилизацию и уменьшает благодаря этому степень повреждения их клеток.) Механизмы адаптации предотвращают гибель клеток, обеспечивают выполнение ими функций и способствуют ликвидации последствий действия патогенного фактора. В этом случае говорят об обратимых изменениях в клетках. Если сила патогенного агента велика и/или защитно-приспособительные реакции недостаточны, развивается необратимое повреждение клеток и они погибают. Специфические и неспецифические повреждения клетки: причины, механизмы развития, проявления. Любое повреждение клетки вызывает в ней комплекс специфических и неспецифических изменений. Под специфическими понимают изменения свойств клеток, характерные для данного фактора при действии его на различные клетки либо свойственные лишь данному виду клеток при воздействии на них повреждающих агентов различного характера. Так, действие на любую клетку механических факторов сопровождается нарушением целостности ее мембран. Под влиянием разобщителей процесса окисления и фосфорилирования снижается или блокируется сопряжение этих процессов. Высокая концентрация в крови одного из гормонов коры надпочечников — альдостерона — обусловливает накопление в различных клетках избытка ионов натрия. С другой стороны, действие повреждающих агентов на определенные виды клеток вызывает специфические для них изменения. Например, влияние различных патогенных факторов на мышечные клетки сопровождается развитием контрактуры миофибрилл, на нейроны — формированием так называемого потенциала повреждения, на эритроциты — гемолизом и выходом из них гемоглобина. Повреждение всегда сопровождается комплексом и неспецифических, стереотипных изменений в клетках. Они наблюдаются в различных видах клеток при действии на них разнообразных агентов. К числу часто встречающихся неспецифических проявлений альтераций клеток относятся ацидоз, чрезмерная активация свободнорадикальных и перекисных реакций, денатурация молекул белка, повышение проницаемости клеточных мембран, повышение сорбционных свойств клеток. Выявление комплекса специфических и неспецифических изменений в клетках органов и тканей дает возможность судить о характере и силе действия патогенного фактора, о степени повреждения, а также об эффективности применяемых с целью лечения медикаментозных и немедикаментозных средств. Сходство и различие шока и коллапса.  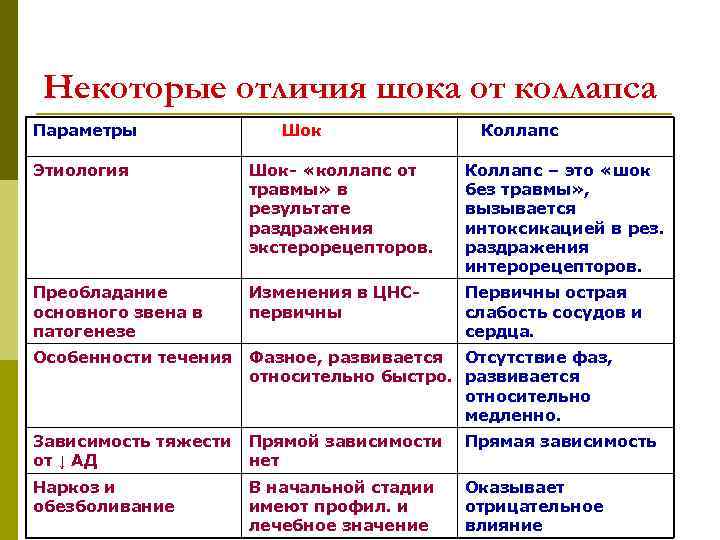 Шок. Это тяжелое общее состояние животного, наиболее близкое к терминальному, характеризующееся кратковременным резким возбуждением, переходящим в глубокое угнетение нервной системы и всех функций организма. Понятие «шок» (англ. shock - удар, потрясение) ввел в начале XVIII в. французский врач ЛеДран, он же предложил тогда простейшие методы лечения шока: согревание, покой, алкоголь и опий, а также описавший его основные симптомы. Н. И. Пирогов первый в мире достаточно правильно представил патогенез шока, описал его и наметил способы профилактики и лечения. Затем было предложено значительное количество теорий, однако все они неполно раскрывают патогенез шока. В ветеринарной медицине шок – это удар по организму больного животного в целом, приводящий не только к каким-то конкретным нарушениям в функциях отдельных органов, а сопровождающийся общими расстройствами вне зависимости от приложения повреждающего фактора. Шок нужно отличать от обморока и коллапса. Существуют две основные классификации шока: в зависимости от этиологии шока - этиологическая и в зависимости от его патогенеза - патогенетическая. В зависимости от причин, вызвавших шок, различают травматический шок, возникающий после случайных травм; операционный, возникший во время и после хирургических или гинекологических операций, проводимых при недостаточном обезболивании или без него; гемотрансфузионный - вследствие белковой несовместимости, гемолиза или коагуляции при переливании несовместимой крови и анафилактический шок, наблюдаемый на фоне предварительной сенсибилизации животных чужеродным белком или бактерийными токсинами.Травматический шок наблюдается наиболее часто. Коллапс (от лат. collapsus - упавший, ослабевший), острая сосудистая недостаточность, характеризующаяся угнетением центральной нервной системы, резким снижением кровяного давления, уменьшением массы циркулирующей крови и нарушением обмена веществ. Такая сосудистая недостаточность приводит к гипоксии всех органов и тканей, и в первую очередь головного мозга. К. развивается при различных отравлениях, острых инфекционных болезнях, травмах, кровопотере, ожогах и др. При колапсе наблюдают снижение температуры тела при одновременном учащении работы сердца, едва ощутимый пульс, поверхностное слабое дыхание, ослабление мышечного тонуса, резко подавленное общее состояние животного. Тяжёлый колапс может быть причиной смерти. Лечение: срочное применение средств, тонизирующих центральную нервную систему, сосудодвигательные и дыхательные центры, сердечные средства, переливание крови, введение кровезаменителей. Сходство и различие приобретенных, врождённых и наследственных заболеваний. Форма наследственной патологии.   Классификация форм наследственной патологии. Причинами аномалий могут быть наследственные нарушения и влияние среды. В зависимости от этого все формы болезней разделяют на четыре группы. 1) Наследственные болезни, на которые влияют генетические факторы. Эти болезни возникают в результате мутаций обычно одного или двух генов, и для которых характерно простое наследование. Среда в этом случае может только усилить или ослабить проявление болезни. К этой группе болезней относятся: гемофилия, атрезия ануса, а также хромосомные болезни. 2) Наследственные болезни, на которые влияют вредные гены. Для проявления подобных генов требуются определенные условия (серповидно-клеточная анемия). 3) Наследственно-средовые болезни, при которых основным этиологическим фактором является условие среды, однако проявление болезни обусловлено и генетическими факторами (мастит, туберкулез, лейкоз, язва желудка, болезни сердца и т. д.). Для разных болезней этой группы может быть характерна слабая, средняя и высокая степень наследственного предрасположения, и обусловлены, как правило, полигенами. 4) Средовые (экзогенные) болезни обусловлены факторами среды (травмы, ожоги, обморожение и т. д.). Наследственные факторы могут влиять ли на течение болезни и на ее исход.  _________________________________________________________________________ Реактивность организма: определение понятия, виды и степени реактивности, значение в патологии. Организм обладает фундаментальным свойством – реактивностью, под которой понимают способность организма определенным образом реагировать на воздействие факторов среды. В процессе эволюции вместе с усложнением организации живых существ усложнялись формы и механизмы реактивности. Чем проще организованно животное и чем менее развита у него нервная система, тем соответственно проще форма его реактивности. Реактивность простейших и многих беспозвоночных животных ограничивается изменениями обмена веществ, позволяющими животному существовать в неблагоприятных для него условиях внешней среды. Особенность реактивности низших животных, связанная со способностью изменять интенсивность процессов обмена веществ, позволяет им легче переносить значительное понижение и повышение температуры окружающей среды, снижение содержания кислорода в воздухе. Болезнь справедливо считается реакцией организма на действие неблагоприятных факторов внешней среды; отсюда ясно, что в возникновении, развитии и исходе заболевания реактивность организма играет первостепенную роль. Таким образом, изучение реактивности приобретает особое значение для понимания патогенеза заболеваний, для организации рациональной патогенетической терапии и профилактики болезней. Реактивность является интегральной характеристикой целого организма, определяющей возможность и характер развития заболевания и претерпевающей изменения в процессе болезни. Можно говорить о: местной (локальной) реактивности; общей реактивности, определяющей целостную реакцию организма на воздействие. Следует различать: нормальную реактивность организма (когда реакция адекватна раздражителю) патологически измененную реактивность (например, формирование повышенной чувствительности к аллергену при сенсибилизации). О реактивности организма судят обычно по раздражимости, возбудимости, функциональной подвижности (лабильности), хроноксии, чувствительности. Раздражимость – важнейшее свойство каждой живой клетки отвечать определенным образом на изменения окружающей среды. Раздражимость является наиболее элементарным свойством протоплазмы живой клетки. Различные состояния раздражимости клеток, и, прежде всего нервных, в сложном многоклеточном организме у высших животных формируют механизмы реактивности. Возбудимость – понятие весьма близкое к раздражимости. Оно возникло из потребности физиологов количественно оценить состояние раздражимости в живых тканях. Величина или степень, возбудимости может быть охарактеризована по силе раздражителя, вызывающего возбуждение, и по времени действия этого раздражителя. Для перехода живых клеток из состояния покоя в со- 5 стоянии возбуждения необходимо, чтобы сила действующего раздражителя достигла критической, т.е. пороговой величины. Порогом возбудимости называется минимальная сила раздражителя (механического, электрического, химического), которая способна перевести ткань из состояния покоя в деятельное состояние. Возбудимость является только одним из показателей реактивности. Возможны состояния организма, при которых на фоне высокой реактивности возбудимость может снижаться и наоборот. Реактивность организма может быть повышенная и пониженная. Изменения реактивности могут пойти на пользу организму или во вред. Если изменения реактивности в ту или другую сторону (то есть в сторону повышения или понижения) способствуют включению или мобилизации защитно-приспособительных реакций организма, то такие изменения реактивности улучшают резистентность, ускоряют выздоровление, а нередко даже предотвращают развитие болезни. И наоборот, если изменения реактивности таковы, что ограничивают защитно-компенсаторные приспособления, то это понижает резистентность, задерживают выздоровление приводит к развитию заболеваний. Существует несколько классификаций реактивности. Наиболее общей формой реактивности здорового и больного организма является биологическая или видовая реактивность. Биологической реактивностью называют изменение жизнедеятельности организма, которая возникает под влиянием обычных для каждого животного воздействий (раздражений) окружающей среды. Эту реактивность иногда называют первичной. Она направлена на сохранение как вида в целом, так и каждой особи в отдельности. Биологическая реактивность определяется наследственностью и ее изменчивостью в пределах каждого данного вида. На основе видовой реактивности формируется индивидуальная реактивность. В качестве примеров видовой реактивности можно назвать сезонные миграции (передвижения, перемены) рыб, птиц. Сезонные изменения жизнедеятельности животных (анабиоз, зимняя и летняя спячка). При сезонных и прочих формах изменения видовой реактивности у каждого индивидуума внутри этого вида возникают существенные изменения обмена веществ, изменение функций нервной и эндокринной системы, других органов и систем. Весной, когда у лягушек усиленно функционируют половые железы, раздражение блуждающего нерва вызывает извращенный («симпатоподобный») эффект на сердце. Видовые особенности реактивности определяют видовой иммунитет животных к инфекционным заболеваниям. Индивидуальная реактивность зависит от наследственности, возраста, пола данного животного, кормления, содержания, эксплуатации, температуры окружающей среды, содержания кислорода во вдыхае- 7 мом воздухе и других факторов среды, в которой обитает организм. Индивидуальная реактивность хорошо проявляется при проведении массовых прививок животным. У части иммунизированных животных наблюдается активная выработка антител, у других она уменьшена, у третьих наблюдается резкая температурная и воспалительная реакция. Как показывает изучение эпизоотий одной и той же болезнью одни животные болеют тяжело, другие легко, а третьи совсем не болеют, хотя возбудитель находится в их организме, что объясняется индивидуальной реактивностью. В зависимости от возраста у животных можно выделить несколько стадий изменений реактивности. В период внутриутробного развития реактивность плода целиком зависит от реактивности материнского организма. У молодняка в самом раннем возрасте обычно наблюдают пониженную реактивность. Пониженная реактивность в период новорожденности (этот период еще иногда называют периодом роста и развития) обусловлена недоразвитием барьерных систем, желез внутренней секреции и высшей нервной деятельности. Период полового созревания сопровождается развитием нервной и эндокринной систем, совершенствованием барьерных систем организма (кожа, слизтистые оболочки, лимфатические узлы и другие), повышается способность вырабатывать антитела, появляются другие защитные приспособления и этот период характеризуется повышенной реактивностью. В старческом возрасте реактивность организма понижается, так как идет угасание всех жизненных функций организма, нервная и эндокринная системы истощены, защитные и компенсаторные приспособления включаются слабо, снижается способность вырабатывать антитела, слабее выражена фагоцитарная активность клеток системы мононуклеарных фагоцитов. Старые животные более восприимчивы ко многим инфекциям, у них часто возникают пневмонии, гнойничковые заболевания кожи, слизистых оболочек, отмечается предрасположенность к некоторым вирусным заболеваниям. В практической ветеринарии и медицине термин реактивность организма широко применяется с целью общей, чаще всего количественной оценки состояния организма больного. Так, состояние повышенной реактивности называется гиперергией (от греческого hyper – больше, erqon – действую). При этом на слабый или умеренной силы раздражитель наблюдается бурная ответная реакция. Гиперергическими формами называют болезни с более быстрым, бурным течением, сопровождающиеся значительным повышением температуры. К гипоергическим относят заболевания с вялым течением, с неясными, стертыми признаками, когда на слабый или умеренной силы раздражитель отмечается слабая ответная реакция, заболевания протекают долго, легко переходят в хроническую форму. Методичка с подробным материалом по этой теме: https://www.vsavm.by/wp-content/uploads/2013/11/Obschaya-reaktivnost-i-rezist-t.pdf Нарушения иммуногенной реактивности организма, их формы, причины и механизмы развития. 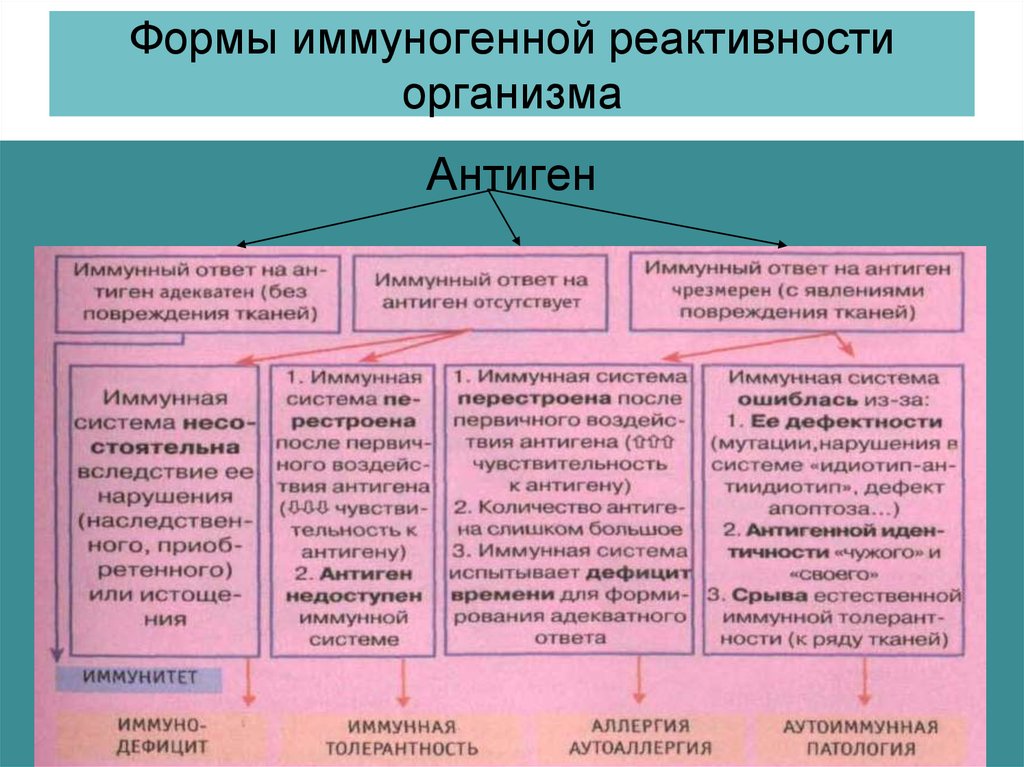 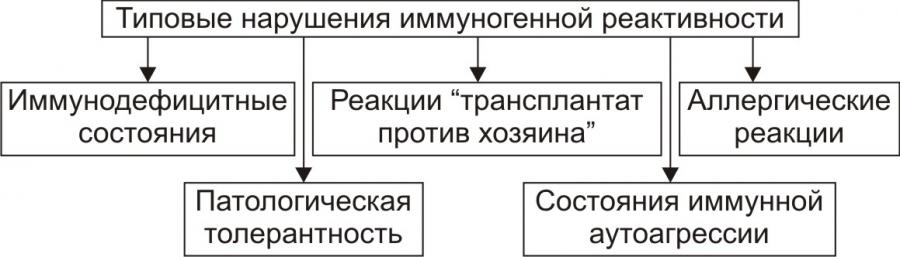 Как и любая система организма, иммунная подвержена развитию патологических процессов. Основу иммунопатологии составляет неспособность иммунной системы выполнять присущие ей в норме защитные функции. Патология может касаться различных уровней и звеньев иммунной системы. Нарушения ее функций могут проявляться в виде гипер-, гипо-, дисфункции, в изменениях толерантности к антигенам. Гиперфункция иммунной системы может развиваться: при поступлении в организм стимуляторов иммунного ответа; при наследственных изменениях синтеза антител, обусловливающих усиленный иммунный ответ на какой-либо антиген; при нарушении регуляторных влияний внутри иммунной системы, характеризующихся дефицитом торможения. Особое место занимает гиперфункция при формировании опухолей из клеток иммунокомпетентной ткани. При гипофункции иммунной системы развиваются иммунодефицитные состояния. При дисфункции иммунной системы в организме создаются условия для развития аллергии. Дисфункция может развиваться вследствие нарушения дифференцирования или кооперации лимфоцитов и антигенпредставляющих клеток. Например, у лиц со снижением функции Тх1 может быть увеличена реакция В-лимфоцитов и выработка антител класса IgE, что вызывает разви- 9 тие аллергических реакций (в частности, при бронхиальной астме). Дисфункция иммунной системы иногда сочетается с гипофункцией. Классификация типовых нарушений иммунологической реактивности. К ним относятся: – иммунодефициты; – аллергия; – аутоиммунные заболевания; – патологическая толерантность; – реакция «трансплантат против хозяина». Патологическая толерантность заключается в «терпимости» системы иммунобиологического надзора к чужеродным антигенам, что может проявляться в отношении антигенов бактерий, вирусов, клеток злокачественных опухолей. Такое нарушение может возникать вследствие иммунодефицитов, повышения активности Т-супрессоров, антигенной перегрузки иммунной системы. Состояние индуцированной толерантности используют в случаях пересадки органов для предупреждения отторжения трансплантата. В иммунологических механизмах повреждения тканей при аутоиммунных заболеваниях принимают участие все те эффекторные механизмы, которыми иммунная система защищает организм от экзогенной интервенции: гуморальные антитела, иммунные комплексы, цитотоксические Т-лимфоциты и цитокины. В развитии патологического процесса указанные факторы могут действовать как порознь, так и совместно. Общая характеристика аллергии. Значение аллергии в патогенезе болезней. |
