Вопросы к зачётуэкзамену по патологической физиологии
 Скачать 1.35 Mb. Скачать 1.35 Mb.
|
|
Фагоцитоз– защитно-приспособительная реакция организма, заключающаяся в узнавании, активном захвате (поглощении) и переваривании м/о, разрушенных клеток и инородных частиц специализированными клетками – фагоцитами. К ним относятся полиморфно-ядерные лейкоциты (в основном нейтрофилы), клетки системы фагоцититрующихмононуклеаров (моноциты, тканевые макрофаги), а также клетки Купфера в печени, мезангиальные клетки почек, глиальные клетки в ЦНС и др. Рзличают четыре стадии фагоцитоа: приближение (хемотаксис), прилипание (аттракция, адгезия), захват фагоцитиремого объекта (поглощение), внутриклеточное переваривание. В процессе узнавания большую роль играют особые компоненты сыворотки крови, которые являются молекулярными посредниками при взаимодействии микробов с фагоцитами и обуславливающие усиление фагоцитоза – опсонины. К ним относят антитела IgGi, IgG3, IgM, иммуноглобулины IgAl, IgA2, термолабильные субкомпоненты комплемента. Основная роль при поглощении принадлежит сократительным белкам, способствующим образованию псевдоподий. Поглощение объекта лейкоцитами может происходить двумя способами: I) контактирующим с объектом участок цитоплазмы втягивается внутрь клетки, а вместе с ним втягивается и объект; 2) фагоцит прикасается к объекту своими длинными и тонкими псевдоподиями, а потом всем телом подтягивается в сторону объекта и обволакивает его. И в том и в другом случае инородная частица окружена плазматической мембраной и вовлечена внутрь клетки. В итоге образуется своеобразная гранула с инородным телом (фагосома). Затем фагосома приближается к лизосоме, их мембраны сливаются, образуется единая вакуоль, в которой находятся поглощенноая частица и лизосомальные ферменты (фаголизосома). В фаголизосомахначинается переваривание поглощенного объекта. Эффективность фагоцитоза возрастает, когда в процесс подключается так называемая кислородная система. При фагоцитозе повышается потребление кислорода, причем столь резкое, что его принято называть “респираторным взрывом”. Смысл столь резкого (до 10 раз) повышения потребления кислорода состоит в том, что он используется для борьбы с микроорганизмами. Происходит образование токсичных для микробов активных форм О2– перекиси водорода, гидроксильных радикалов, супероксидного аниона, синглетного кислорода. Эти высокоактивные соединения вызывают перекисное окисление липидов, белков, нуклеиновых кислот, углеводов и при этом повреждают построенные из этих веществ клеточные структуры микроорганизмов. В этой ситуации фагоцит и сам подвергается агрессивному действию названных веществ, но он обладает мощным механизмом, благодаря которому избыточного накопления активных форм кислорода не происходит. Защитную роль при этом играют прежде всего два фермента: глютатионпероксидаза и глютатионредуктаза, роль которых заключается в том, что первый переносит водород на окисленный глютатион, а второй – снимает этот водород и передает его на Н2О2, в результате чего образуются две молекулы воды. Определенную роль играет каталаза, выводящие из клеток избыток перекиси водорода. Супероксидный анион обезвреживается особым ферментом - супероксиддисмутазой. У фагоцитов имеются и другие не связанные с кислородом (кислороднезависимые) механизмы борьбы с микроорганизмами. К ним относятся: лизоцим, разрушающий мембраны бактерий; лактоферрин, конкурирующий за ионы железа и, наконец, дефензины (белки со структурой насыщенной аргинином), катионные белки, нарушающие структуру мембран микроорганизмов. Совместное действие механизмов обеих групп приводит к разрушению объектов фагоцитоза. Однако наряду с завершенным фагоцитозом в микрофагах наблюдается, например, при некоторых инфекциях фагоцитоз незавершенный или эндоцитобиоз, когда фагоцитированные бактерии или вирусы не подвергаются полному перевариванию, а иногда даже начинают размножаться в цитоплазме клетки. Эндоцитобиоз объясняют недостатком или даже отсутствием в лизосомах макрофагов антибактериальных катионных белков, что снижает переваривающую способность лизосмальных ферментов. Фагоцит, поглотивший бактерии, но не способный их переварить становится переносчиком инфекции по организму, способствует ее дессиминации. Выявлены болезни, сопровождающиеся первичными (врожденными) или вторичными (приобретенными) дефектами фагоцитоза – “болезни фагоцитов”. К ним относится так называемая хроническая гранулематозная болезнь, возникающая у детей, в фагоцитах которых из-за дефекта оксидаз нарушено образование перекисей и, следовательно, процесс инактивации микробов. Сниженная спосбность к уничтожению бактерий выявлено у людей нейтрофилы которых синтезируют недостаточное количество миелопироксидазы, глукоза-6-фосфатдегидрогеназы, пируваткиназы. +Необходимо отметить, что особую роль в развитии учения о фагоцитозе сыграли исследования И.И.Мечникова. И.И.Мечников (1892) разработал учение о фагоцитозе и отвел ему важнейшую роль в динамике В. На основании своих наблюдений он построил биологическую теорию В. Он впервые рассмотрел воспалительный процесс с эволюционных позиций, заложил основы сравнительной патологии. 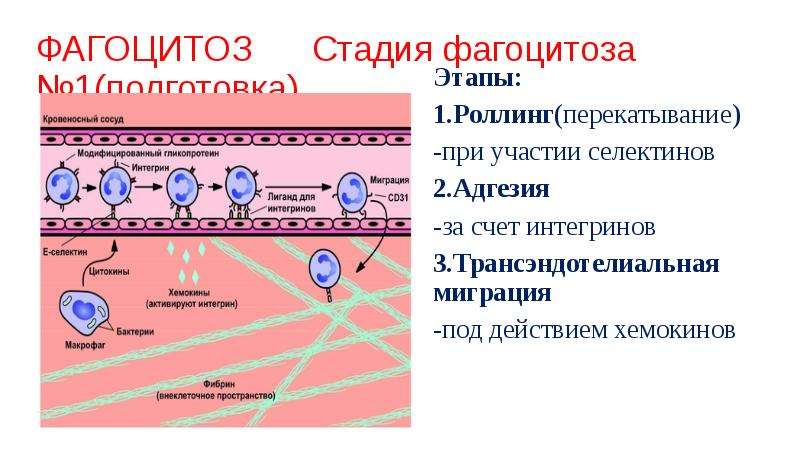 Пролиферативные процессы при воспалении *«Пролиферативное (продуктивное) воспаление характеризуется преобладанием пролиферации клеток. Альтеративные и экссудативные изменения отступают на второй план. Течение пролиферативного воспаления может быть острым, но в большинстве случаев — хроническим. Острое пролиферативное воспаление наблюдается при ряде инфекционных (брюшной и сыпной тифы, туляремия, бруцеллез), инфекционно-аллергических заболеваний (острый ревматизм, острый гломерулонефрит), хроническое течение характерно для большинства межуточных продуктивных процессов (пролиферативный миокардит, гепатит, нефрит с исходом в склероз), большинства типов гранулематозного воспаления, продуктивного воспаления с образованием полипов и остроконечных кандилом. Хроническое воспаление — сумма тканевых ответов против длительно присутствующего повреждающего агента: бактериального, вирусного, химического, иммунологического и т.д. В тканях, поврежденных хроническим воспалением, обычно обнаруживаются свидетельства следующих патологических процессов: 1) Иммунный ответ: к проявлениям иммунного ответа в поврежденной ткани относится присутствие лимфоцитов, плазматических клеток и макрофагов. Может быть увеличен уровень иммуноглобулинов в сыворотке. 2) Фагоцитоз: иммунный фагоцитоз осуществляется макрофагами, которые активируются лимфокинами, продуцируемыми T-клетками. Фагоцитируются антигены, которые покрыты опсонинами (иммуноглобулины и факторы комплемента). Неиммунный фагоцитоз направлен против чужеродных неантигенных частиц. 3) Некроз: обычно при хроническом воспалении в той или иной степени есть некротические изменения тканей, которые могут затрагивать только рассеянные единичные клетки или могут быть обширными. 4) Восстановление: восстановление тканей, поврежденных постоянно присутствующим повреждающим агентом, характеризуется формированием новых кровеносных сосудов, фибробластической пролиферацией и накоплением коллагена (фиброз). Хроническое воспаление может следовать вслед за острым воспалительным ответом, который не приводит к уничтожению повреждающего агента или оно может протекать без клинически видимой острой стадии. Хроническое воспаление диагностируется благодаря его морфологическим особенностям. Оно отличается от острого воспаления отсутствием основных признаков типа покраснения, припухлости, боли и увеличения температуры. Активная гиперемия, экссудация жидкости и эмиграция нейтрофилов при хроническом воспалении не выражены. Патогенез его отличается от острого воспаления тем, что оно длится достаточно долго для того, чтобы возникли иммунный ответ и регенерация. Большинство агентов, приводящих к развитию хронического воспаления, вызывают прогрессивный и часто обширный некроз ткани, который сопровождается замещением фиброзной тканью. Выраженность фиброза в тканях зависит от продолжительности хронического воспаления. Клеточный компонент является одной из частей иммунного ответа. В большинстве случаев постоянное повреждение тканей создается антигенным агентом, что ведет к активации иммунитета. Гранулемы инородных тел образуются при прямом неиммунном фагоцитозе инертных (неантигенных) инородных частиц. Специфические особенности хронического воспаления, возникающего в ответ на различные патогенные агенты, зависят от выраженности каждого из процессов, описанных выше. Например, агент, который стимулирует массивный выброс цитокинов, будет вызывать хроническое воспаление, характеризуемое накоплением многочисленных макрофагов. Оно будет отличаться от хронического воспаления против агента, вызывающего ответ цитотоксических T-лимфоцитов, которое характеризуется присутствием только T-лимфоцитов. Таким образом, изменения в организме и тканях при хроническом воспалении зависят от агента, вызывающего его. Хроническое воспаление обычно возникает в ответ на повреждающий агент, который является антигенным, например, микроорганизм, но может также развиваться в ответ на "собственный антиген", образующийся из поврежденных тканей. Для развития иммунного ответа необходимо несколько дней. Постоянное присутствие в участке повреждения антигена ведет к накоплению там активированных T-лимфоцитов, плазматических клеток и макрофагов. Так как эти клетки всегда определяются в тканях при хроническом воспалении, то клетки исполнительного звена иммунного ответа также называют клетками хронического воспаления. Хотя иммунная система активируется сразу после повреждения, необходимо несколько дней для развития иммунного ответа, потому что несенсибилизированные лимфоциты, которые впервые встречаются с антигеном, должны пройти несколько циклов деления, прежде чем увеличение числа лимфоцитов исполнительного звена можно будет определить в тканях. Простое острое воспаление обычно приводит к удалению антигена до появления признаков наличия иммунного ответа в тканях. Макрофаги (моноциты) привлекаются в очаг из крови такими хемотаксическими факторами, как C5a и TGFb. Местная "активация" происходит под влиянием многочисленных цитокинов, особенно g интерферона и IL-4. Макрофаги, в свою очередь, выделяют разнообразные факторы, которые активируют развивающийся иммунный ответ, включая цитокины (IL-1, IL-6 и TNFa, компоненты комплемента, простагландины и различные факторы роста типа FGF (фактор роста фибробластов), PDGF (тромбоцитарный фактор роста) и TGFb (трансформирующий фактор роста). Многочисленные протеазы и гидролазы способствуют фагоцитарному и бактерицидному действию. Пролиферативное воспаление встречается в любом органе, любой ткани. Выделяют следующие виды пролиферативного воспаления: +—межуточное (интерстициальное); —гранулематозное; —воспаление с образованием полипов и остроконечных кондилом.» Пролиферация. Под воспалительной пролиферацией понимают размножение местных клеточных элементов в очаге воспаления. Пролиферация развивается с самого начала воспаления наряду с явлениями альтерации и экссудации, но становится преобладающей в более поздний период процесса, по мере стихания экссу-дативно-инфильтративных явлений. Первоначально она в большей мере выражена на периферии очага. Важнейшим условием про-грессирования пролиферации является эффективность очищения очага воспаления от микроорганизмов или другого вредного агента, продуктов альтерации тканей, погибших лейкоцитов (рангов очищение). Ведущая роль в этом принадлежит макрофагам — гематогенного (моноциты) и тканевого (гис-тиоциты) происхождения. Раневое очищение происходит главным образом путем внеклеточной деградации поврежденной ткани, а также за счет фагоцитоза. Оно осуществляется под регуляторным влиянием цитокинов с помощью таких ферментов, как протеогликаназа, коллагеназа, желатиназа. Активация этих ферментов может происходить под воздействием акти-ватораплазминогена, высвобождаемого при участии цитокинов из мезенхимальных клеток. Простагландины, высвобождаясь вместе с ферментами, могут, со своей стороны, индуцировать протеиназы и вносить свой вклад в процессы деградации. Элиминируя останки лейкоцитов и разрушенных тканей, макрофаги устраняют один из важнейших источников собственной хемотаксической стимуляции и подавляют дальнейшее развитие местной лейкоцитарной реакции. 'По мере очищения очага воспаления количество макрофагов убывает из-за снижения поступления их из крови. Из очага они уносятся восстанавливающимся током лимфы в ре-гионарные лимфоузлы, где погибают. Лимфоциты частью погибают, частью превращаются в плазматические клетки, продуцирующие антитела, и затем постепенно элиминируются. Пролиферация происходит главным образом за счет мезенхимальных элементов стромы, а также элементов паренхимы органов. В ней участвуют камбиальные, ад-вентициальные, эндотелиальные клетки. В результате дифференцировки стволовых клеток соединительной ткани — полибластов — в очаге появляются эпителиоидные клетки, фибробласты и фиброциты. Основными клеточными элементами, ответственными за репаративные процессы в очаге воспаления, являются фибробласты. Они продуцируют основное межклеточное вещество — гликозами-ногликаны, а также синтезируют и секре-тируют волокнистые структуры — коллаген, эластин, ретикулин. В свою очередь, коллаген является главным компонентом рубцо-вой ткани. Процесс пролиферации находится под сложным гуморальным контролем. Решающее значение здесь имеют опять-таки макрофаги. Они являются основным источником фактора роста фибробластов — термолабильного белка, стимулирующего пролиферацию фибробластов и синтез коллагена. Макрофаги также усиливают привлечение фибробластов в очаг воспаления. Важную роль в этом играет секретируемый макрофагами фибронектин, а также интер-лейкин-1. Макрофаги также стимулируют пролиферацию эндотелиальных и гладкомы-шечных клеток, базальной мембраны и, таким образом, .образование микрососудов. Зетение или стимуляция системы моно-нуклеарных фагоцитов соответственно ослабляет или усиливает развитие грануляционной ткани в очаге гнойного воспаления. В свою очередь, макрофаги опосредуют регуляторное влияние на фибробласты и пролиферацию в целом Т-лимфоцитов. Последние же активируются протеиназами, образующимися в очаге воспаления в результате распада ткани. Протеиназы могут оказывать непосредственное влияние как на макрофаги, так и на фибробласты. Макрофаги и лимфоциты могут высвобождать цито- и лимфокины, не только стимулирующие, но и угнетающие фибробласты, выступая в качестве истинных регуляторов их функций. Фибробласты зависят также от тромбо-цитарного фактора роста, являющегося термостабильным белком с высоким содержанием цфстеина и м.м. ЗООООД. В качестве других факторов роста для фибробластов называют соматотропин, соматоме-дины, эпидермальный фактор роста, инсу-линоподобные пептиды, инсулин, глюкагон. Важную роль в пролиферативных явлениях играьйткейлоны — термолабильные гликопротеины с м.м. 40000Д, являющиеся ингибиторами клеточного деления. Механизм их действия состоит в инактивации ферментов, участвующих в редупликации ДНК. Одним из основных источников кейлонов являются сегментоядерные нейтрофилы. По мере снижения количества нейтрофилов в очаге воспаления уменьшается содержание кейлонов, что приводит к ускорению деления клеток. По другим предположениям, при воспалении сегментоядерные нейтрофилы практически не вырабатывают кейлоны и усиленно продуцируют антикейлоны (стимуляторы деления); соответственно деление клеток ускоряется, пролиферация усиливается. Другие клетки и медиаторы могут модулировать репаративный процесс, воздействуя на функции фибробластов, макрофагов и лимфоцитов. Существенное значение в регуляции репаративных явлений имеют также реципрокные взаимоотношения в системе коллаген — коллагеназа, стро-мально-паренхиматозные взаимодействия (Д. Н. Маянский). +Пролиферация сменяется регенерацией. Последняя не входит в комплекс собственно воспалительных явлений, однако непременно следует им и трудно от них отделима. Она состоит в разрастании соединительной ткани, новообразовании кровеносных сосудов, в меньшей степени — в размножении специфических элементов ткани. При незначительном повреждении ткани происходит относительно полная ее регенерация. При образовании дефекта он заполняется вначале грануляционной тканью — молодой, богатой сосудами, которая _впо-следствии замещается соединительной тканью с образованием рубца. Понятие о лихорадке, основные стадии. Лихорадка-(pyresis или febris) — общий неспецифический типовой патологический процесс, наиболее яркий компонент продромального синдрома, пример продолжительного гиперметаболического «противостояния» неблагоприятным факторам внешней среды, одним из признаков которого является повышение температуры тела. Цель гиперметаболического противостояния — интенсифицировать использование энергии, сдержать масштабы альтерации, создать неблагоприятные условия для размножения патогенов, потенцировать действие стрессорных и иммунных стереотипов защиты. Лихорадка возникла и закрепилась в филогенезе как защитно-приспособительная реакция. Суть лихорадки — координированный типовой иммунонейроэндокринный ответ аппарата терморегуляции высших гомойотермных животных и человека на пирогены, который характеризуе (УТТГ) на более высокий уровень, при сохранении механизмов терморегуляции, в чѐм состоит принципиальное отличие лихорадки от гипертермии. При повышенной температуре угнетается жизнедеятельность микроорганизмов и вирусов. В основе этого явления — ограничение доступности микроорганизмов к железу и цинку. Сопровождающий лихорадку стресс увеличивает антигипоксическую резистентность организма. Плата за эти приспособления — понижение доставки железа в ткани, что у длительно и часто лихорадящих приводит к железодефициту и анемии. Стадии лихорадки В своѐм развитии лихорадка всегда проходит 3 стадии. На первой стадии температура повышается (stadiaincrementi), на второй — удерживается некоторое время на повышенном уровне (stadiafastigi или acme), а на третьей — снижается до исходной (stadiadecrementi). Подъѐм температуры связан с перестройкой терморегуляции таким образом, что теплопродукция начинает превышать теплоотдачу. Причѐм у взрослых людей наибольшее значение имеет именно ограничение теплоотдачи, а не увеличение теплопродукции. Это значительно экономнее для организма, так как не требует увеличения энергозатрат. Кроме того, данный механизм обеспечивает большую скорость разогревания тела. У новорождѐнных детей, наоборот, на первый план выходит повышение теплопродукции. Ограничение теплоотдачи происходит за счѐт сужения периферических сосудов и уменьшения притока в ткани тѐплой крови. Наибольшее значение имеет спазм кожных сосудов и прекращения потоотделения под действием симпатической нервной системы. Кожа бледнеет, а еѐ температура понижается, ограничивая теплоотдачу за счѐт излучения. Уменьшение образования пота ограничивает потерю тепла через испарение. Сокращение мышц волосяных луковиц приводит к взъерошиванию шерсти у животных, создавая дополнительную теплоизолирующую воздушную прослойку, а у человека проявляется феноменом «гусиной кожи». Возникновение субъективного чувства озноба напрямую связано с уменьшением температуры кожи и раздражением кожных холодовых терморецепторов, сигнал с которых поступают в гипоталамус, который является интегративным центром терморегуляции. Далее гипоталамус сигнализирует о ситуации в кору, где и формируется соответствующее поведение: принятие соответствующей позы, укутывание. Снижениемтемпературы кожи и объясняется мышечная дрожь, которая вызывается активацией центра дрожи, локализованного в среднем и продолговатом мозге. За счѐт активации обмена веществ в мышцах увеличивается теплопродукция (сократительный термогенез). Одновременно усиливается и несократительныйтермогенез в таких внутренних органах как мозг, печень, лѐгкие. Удержание температуры начинается по достижении установочной точки и может быть кратким (часы, дни) или длительным (недели). При этом теплопродукция и теплоотдача уравновешивают друг друга, и дальнейшего повышения температуры не происходит, терморегуляция происходит по механизмам, аналогичным норме. Кожные сосуды при этом расширяются, уходит бледность, и кожа становится горячей на ощупь, а дрожь и озноб исчезают. Человек при этом испытывает чувство жара. При этом сохраняются суточные колебания температуры, однако их амплитуда резко превышает нормальную. В зависимости от выраженности подъѐма температуры во вторую стадию лихорадку подразделяют на субфебрильную (до 38 °C), слабую (до 38,5 °C), умеренную(фебрильная) (до 39 °C), высокую (пиретическая) (до 41 °C) и чрезмерную (гиперпиретическая) (свыше 41 °C). Гиперпиретическая лихорадка опасна для жизни, особенно у детей. Падение температуры может быть постепенным или резким. Стадия снижения температуры начинается после исчерпания запаса экзогенных пирогенов или прекращения образования эндогенных пирогенов под действием внутренних (естественных) или экзогенных (лекарственных) антипиретических факторов. После прекращения действия пирогенов на центр терморегуляции установочная точка опускается на нормальный уровень, и температура начинает восприниматься гипоталамусом как повышенная. Это приводит к расширению кожных сосудов и избыточное теперь для организма тепло выводится. Происходит обильное потоотделение, усиливается диурез и перспирация. Теплоотдача на данной стадии резко превышает теплопродукцию. Типы лихорадок по характеру колебаний суточной температуры: 1. Постоянная лихорадка (febriscontinua) — длительное устойчивое повышение температуры тела, суточные колебания не превышают 1 °C. 2. Ремитирующая лихорадка (febrisremittens) — значительные суточные колебания температуры тела в пределах 1,5-2°С. Но при этом температура не снижается до нормальных цифр. 3. Перемежающаяся лихорадка (febrisintermittis) — характеризуется быстрым, значительным повышением температуры, которое держится несколько часов, а затем сменяется быстрым еѐ падением до нормальных значений. 4. Гектическая, или изнуряющая лихорадка (febrishectica) — суточные колебания достигают 3-5°С, при этом подъѐмы температуры с быстрым спадом могут повторяться несколько раз в течение суток. 5. Извращенная лихорадка (febrisinversa) — для неѐ характерно изменение суточного ритма с более высокими подъѐмами температуры по утрам. 6. Неправильная лихорадка (febrisathypica) — для которой характерны колебания температуры в течение суток без определенной закономерности. 7. Возвратная лихорадка (febrisrecurrens) — характеризуется чередованием периодов повышения температуры с периодами нормальной температуры, которые длятся несколько суток. Механизмы развития и возникновения лихорадки. Изменение теплообмена.  Увеличение температуры «установочной точки» преоптической области гипоталамуса. Повышение температуры «установочной точки» преоптической области гипоталамуса почти всегда возникает под влиянием эндогенного пирогена — вещества, выделяемого фагоцитирующими лейкоцитами и макрофагами. Эндогенный пироген является конечным общим звеном при подавляющем большинстве фебрильных заболеваний. Исключением является действие облучения ЦНС, яда скорпиона и ДДТ, которые прямым путем увеличивают температуру «установочной точки». Было предложено, что адреналин и норадреналин при передозировке могут прямым образом повышать температуру «установочной точки» преоптической области гипоталамуса. Некоторые виды опухолей выделяют эндогенные пирогены или эндогенные пирогеноподобные вещества. Повреждение мозга способно повлиять на «установочную точку», как и на другие области преоптической области гипоталамуса. Эндогенный пирогенпри развитии лихорадки Бактериальный эндотоксин при внутривенном введении вызывает лихорадку только после латентного периода, продолжающегося около 90 мин. Эндогенный же пироген при том же способе введения вызывает лихорадку в течение нескольких минут. Человеческая кровь после инкубации с бактериальным эндотоксином при ее введении добровольцам также быстро вызывает лихорадку, что подтверждает мнение о выделении эндогенного пирогенного вещества лейкоцитами. Большинство исследований показало, что введение эндотоксина непосредственно в преоптической области гипоталамуса неэффективно, в то время как инъекция даже минимальной дозы эндогенного пирогена в ту же область немедленно вызывает лихорадку. Однако в одной из работ описана лихорадка при прямом введении эндотоксина в желудочки или переднюю часть гипоталамуса мозга крыс. Первоначально предполагали, что только циркулирующие полиморфноядерные лейкоциты могут выделять эндогенный пироген. Поэтому развитие лихорадки у больных с гранулоцитопенией казалось загадкой. Однако впоследствии было доказано, что большинство, если не все, фагоцитирующих клеток, развивающихся из костномозговых предшественников, выделяют эндогенный пироген. Некоторые клетки, не происходящие из костного мозга, например фибробласты, фагоцитируют частицы латекса в культуре тканей, но они не выделяют эндогенный пироген. Продуцировать эндогенный пироген могут альвеолярные и перитонеальные макрофаги, а также ретикулоэндотелиальные клетки печени и селезенки. Эндотоксин, который быстро связывается с циркулирующими гранулоцитами, вызывает лихорадку прежде всего путем стимуляции выработки этими клетками эндогенного пирогена. С другой стороны, живые бактерии и вирусы элиминируются из крови главным образом ретикулоэндотелиальной системой и вызывают лихорадку путем стимуляции образования и освобождения эндогенного пирогена клетками этой системы в печени и селезенке. Хотя лимфоциты не образуют эндогенный пироген, они выделяют лимфокинин, который стимулирует продукцию и выделение эндогенного пирогена гранулоцитами и моноцитами. Пока не ясно, участвуют ли эозинофилы в продуцировании эндогенного пирогена. Освобождение эндогенного пирогена отмечается не только при инфекционных заболеваниях. Основным пусковым механизмом образования и выделения эндогенного пирогена является фагоцитоз микроорганизмов, комплексов антиген—антитело, погибших или поврежденных клеток, клеточных фрагментов. Например, при введении эритроцитов группы D больным с антителами против антигена D отмечаются озноб и лихорадка после латентного периода продолжительностью 90 мин, что подтверждает наличие промежуточного этапа в продукции эндогенного пирогена. Эндогенный пироген образуется при аллергических заболеваниях, болезнях соединительной ткани и воспалительных реакциях в ответ на опухоли. По-видимому, существует особый механизм развития лихорадки при травме и тканевой деструкции. Эндогенный пироген — это белок с низкой молекулярной массой. После того как он выделился фагоцитирующими клетками, он покидает кровоток и быстро проникает в преоптическую область гипоталамуса. Эндогенный пироген является чрезвычайно мощным веществом и способен вызвать лихорадку у лабораторных животных при внутривенном введении в нанограммовых количествах. В настоящее время считается, что эндогенный пироген не содержится как таковой в фагоцитирующих клетках, а образуется в них под воздействием соответствующих стимулов. Этот этап требует определенного времени, так как включает синтез новой информационной РНК. Секреция эндогенного пирогена не ведет к лизису или гибели фагоцитов. Нейромедиаторы, действующие в установочной точке при лихорадке Есть серьезные основания предполагать, что нейрохимическим медиатором, повышающим температуру «установочной точки» преоптической области гипоталамуса при воздействии эндогенного пирогена, является простагландин. Минимальные дозы простагландинов E1 и Е2 при инъекции их в мозг лабораторных животных быстро вызывают лихорадку. Парентерально введенные простагландины, как правило, являются пирогенными только в больших дозах, возможно, из-за их инактивации в легких. Однако лихорадочные реакции были отмечены у больных после инъекций простагландина Е2; описана выраженная пирексия после его внутривлагалищного введения. Увеличение концентрации простагландинов обнаружено в мозге лабораторных животных во время лихорадки. Ингибирование простагландинсинтетазы ЦНС (ацетилсалициловой кислотой или парацетамолом) ведет к снижению температуры тела при лихорадке, но не влияет на нормальную температуру. Это наблюдение подтверждает мнение о том, что значение простагландинов в преоптической области гипоталамуса ограничено повышением температуры «установочной точки» при лихорадке, а в нормальных условиях они не играют роли. Значение таких медиаторов, как циклический АМФ и моноамины, неясно .  |
