Вопросы к зачётуэкзамену по патологической физиологии
 Скачать 1.35 Mb. Скачать 1.35 Mb.
|
|
Изменение теплообмена описан в 39 вопросе по стадиям либо здесь другим словами I. Стадия повышения температуры. Подъем температуры на этой стадии отражает перестройку терморегуляции в том смысле, что теплопродукция превышает теплоотдачу. Изменяется и та, и другая, но главное значение при этом имеет ограничение теплоотдачи, что не только эффективнее относительно скорости разогревания тела, но и экономнее для организма, так как не требует дополнительных энергетических затрат. Теплоотдача уменьшается в результате сужения периферических сосудов и снижения притока теплой крови к тканям, торможения потоотделения и угнетения испарения, сокращения у животных мышц волосяных луковиц и взъерошивания шерсти, увеличивающей теплоизоляцию. Эквивалентом этой реакции у человека служит появление "гусиной кожи". Увеличение теплопродукции достигается в результате активизации обмена веществ в мышцах (сократительный термогенез) на фоне повышенного тонуса мышц и мышечной дрожи. Мышечная дрожь связана со спазмом периферических сосудов. Из-за уменьшения притока крови температура кожи снижается иногда на несколько градусов. Терморецепторы возбуждаются, возникает ощущение холода — озноб. В ответ на это центр терморегуляции посылает эфферентные импульсы к двигательным нейронам — возникает дрожь. Одновременно с этим усиливается и несократительныйтермогенез, т. е. образование тепла в органах, таких как печень, легкие, мозг. Это является результатом трофического действия нервов на ткань, вследствие которого активируются ферменты, увеличиваются потребление кислорода и выработка тепла. В разбалансировании теплового гомеостаза определенную роль могут играть также гуморальные факторы. Известно, что некоторые бактериальные токсины обладают способностью разобщать окисление и окислительное фосфорилирование и тем самым способствовать образованию тепла. Этот дополнительный термогенез может ускорить повышение температуры в I стадии лихорадки. Стадия удержания повышенной те м п е р ат у р ы. После того как в I стадии лихорадки температура повысилась до определенного уровня, она удерживается на нем в течение некоторого времени (дни, часы). Так как при этом повышается теплоотдача, то дальнейшего возрастания температуры не происходит. Включение теплоотдачи осуществляется благодаря расширению периферических сосудов; бледность кожи сменяется гиперемией. Кожа становится горячей на ощупь. Возникает ощущение жара. Поддержание температуры на повышенном уровне объясняется тем, что под влиянием лейкоцитарного пирогена меняется установочная точка центра терморегуляции. На этом уровне возобновляется механизм поддержания постоянства температуры с характерными колебаниями утром и вечером, амплитуда которых значительно превышает таковую в норме. По степени повышения температуры во II стадии лихорадки различают следующие ее виды: субфебрильная — до 38°С; умеренная — 38 — 39°С; высокая — 39 — 41°С; ги п е р п и р е т ич е с к а я — выше 4ГС. Стадия снижения температуры. После прекращения действия пирогенов центр терморегуляции приходит в прежнее состояние, установочная точка температуры опускается до нормального уровня. Накопившееся в организме тепло выводится в результате расширения кожных сосудов, появления обильного пота и частого дыхания. Снижение температуры может быть постепенным, л и т и ч е с к и м (в течение нескольких суток) или быстрым, критическим. В последнем случае может произойти слишком резкое расширение сосудов, а при сочетании с интоксикацией может наступить опасный для жизни коллапс Классификация лихорадочных реакций. В зависимости от продолжительности лихорадка может быть эфемерной (1-3 дня), острой (до 15 дней), подострой (до 1,5 месяца) и хронической (более 1,5 месяца). По степени подъема температуры различают лихорадку субфебрильную (37,1-37,9 °С), умеренную (38-39,5 °С), высокую (39,6- 40,9 °С) и гиперпиретическую (41 °С и выше). Последний вид лихорадки наблюдается, в частности, при столбняке и менингите. В зависимости от размера суточных колебаний температуры во вторую стадию лихорадки ее подразделяют на постоянную, послабляющую, перемежающуюся, изнуряющую, возвратную и атипичную. Следует отметить, что в большинстве случаев при развитии лихорадки сохраняется нормальный циркадный ритм колебаний температуры, т.е. вечером она выше, чем утром. Постоянная лихорадка febris continua характеризуется высоким подъемом температуры с суточными колебаниями не выше 1 °С (крупозная пневмония, сыпной тиф и др.). Послабляющая лихорадка f. remittens - при ней суточные колебания температуры превышают 1 °С, но снижения до нормы не происходит; такой вид лихорадки наблюдается при большинстве вирусных и многих бактериальных инфекциях (экссудативный плеврит, туберкулез и др.). Перемежающаяся лихорадка (f. intermittens) характеризуется большими колебаниями суточной температуры с падением ее по утрам до нормы или ниже (гнойная инфекция, туберкулез, некоторые разновидности малярии, ревматоидный артрит, лимфомы и др.). Изнуряющая лихорадка f. hectica) - суточные колебания температуры достигают 3-4 °С; наблюдается при гнойных процессах, сепсисе, туберкулезе и других заболеваниях. Возвратная лихорадка (f. recurrens) характеризуется чередованием лихорадочных и безлихорадочных периодов, длительность которых колеблется от одних до нескольких суток (возвратный тиф, лимфогранулематоз, малярия и др.). Атипичная лихорадка f. athypica) отличается совершенно незакономерными колебаниями температуры, причем максимальный подъем ее происходит утром (некоторые формы туберкулеза, сепсис и др.). Отличия лихорадки от экзогенной гипертермии. Изменение функций организма при лихорадке. Лихорадку стоит отличать от гипертермии, которая возникает вне связи с продукцией пирогенных веществ, и обусловлена повреждением механизмов терморегуляции. При лихорадке перестройка функции теплорегуляторного центра направлена на активную задержку тепла в организме независимо от температуры окружающей среды. При гипертермии организм стремится освободиться от лишнего тепла путем максимального напряжения процессов теплоотдачи, чему препятствует повышение температуры окружающей среды. Если при лихорадке механизмы терморегуляции не нарушены, и лихорадящие больные удерживают температуру вблизи нового «заданного значения», сохраняя постоянство соотношения между теплопродукцией и теплоотдачей, то при гипертермии это соотношение нарушено в пользу теплопродукции, и температура тела прогрессивно возрастает. Температура тела при лихорадке не больше 41.1 С, при гипертермии – 43 и более. Гипертермии обусловлены высокой температурой внешней среды, нарушением теплоотдачи и теплопродукции, а причина лихорадки - пирогены. При перегревании организма происходит нарушение механизмов терморегуляции, при гипертермических реакциях - нецелесообразное повышение теплопродукции, а при лихорадке система терморегуляции адаптивно перестраивается. При перегревании температура тела повышается пассивно, а при лихорадке - активно, с затратой значительного количества энергии. Изменение функций организма при лихорадке ОБМЕН ВЕЩЕСТВ ПРИ ЛИХОРАДКЕ При лихорадке происходят изменения едва ли не всех видов обмена веществ. Специфичным для лихорадки, как таковой, следует считать активацию окислительных процессов. На каждый 1 °С повышения температуры тела основной обмен увеличивается на 10-12%. Повышается потребность в кислороде. Содержание СО2 в артериальной крови снижается (главным образом, во второй стадии лихорадки) из-за усиления альвеолярной вентиляции. Следствием гипокапнии является спазм сосудов мозга, ухудшение снабжения его кислородом. Изменения углеводного и жирового обмена связаны с возбуждением симпатической нервной системы, сопровождающимся повышенным распадом гликогена в печени и усилением липолиза. Содержание гликогена в гепатоцитах снижается и происходит некоторое повышение содержания глюкозы в крови; иногда у лихорадящего больного обнаруживается глюкозурия. Усилены мобилизация жира из депо и его окисление, что является основным источником энергии у лихорадящих больных. Вместе с тем могут иметь место незавершенность окисления жирных кислот и повышенное образование кетоновых тел. Происходит активация протеолиза в мышцах и снижение его синтеза под действием кортизола, секреция которого усиливается. При инфекционных лихорадках может обнаруживаться отрицательный азотистый баланс. Кроме повышенного распада белка, этому способствует и пониженное поступление его с пищей вследствие анорексии. Усиление липолиза и протеолиза ведет к снижению массы тела при продолжительной лихорадке. Водно-солевой обмен также подвержен изменениям. На второй стадии лихорадки происходит задержка в тканях воды и хлорида натрия, что связывают с повышением секреции альдостерона. На конечной стадии выделение из организма воды и NaCl повышено (с мочой и потом). При хронической лихорадке обмен хлоридов не нарушен. Развитие лихорадки сопровождается снижением концентрации свободного железа в сыворотке крови, вместе с тем в ней возрастает содержание ферритина. При длительной лихорадке может развиться железодефицитное состояние, следствием его могут явиться психическая депрессия, гипохромная анемия и запоры. В основе этих нарушений лежит понижение активности дыхательных ферментов. Снижается свободное содержание в сыворотке и других бивалентных катионов (Си, Zn) вследствие усиленного связывания их белками «острой фазы», которые при лихорадке синтезируются печенью в повышенном количестве для обеспечения антимикробного действия. Лихорадочное состояние может сопровождаться сдвигами кислотно-основного состояния: при умеренной лихорадке возможно развитие газового алкалоза (в связи с гипокапнией), а при лихорадке высокой степени - метаболического ацидоза. РАБОТА ОРГАНОВ И СИСТЕМ ПРИ ЛИХОРАДКЕ При лихорадке наблюдается ряд изменений в работе органов и систем. Еще в лаборатории И.П. Павлова было показано, что при лихорадке, вызванной у собак экспериментально или возникшей спонтанно под влиянием инфекций, имеются нарушения условнорефлекторной деятельности. Возникают расстройства дифференцировочного торможения, происходит растормаживание ранее выработанных условных рефлексов. У людей при лихорадке наблюдаются явления повышенной возбудимости (в особенности в первой стадии ее развития). При высокой лихорадке нередко возникают бред, иногда галлюцинации, возможна потеря сознания, у детей могут развиться судороги. Частым клиническим симптомом при лихорадке является головная боль. Эти нарушения чаще наблюдаются при инфекционной лихорадке. Как уже упоминалось, при лихорадке возбуждаются центры симпатической нервной системы, что обусловливает целый ряд изменений функций различных органов (табл. 11-1). Изменяется функция сердечно-сосудистой системы. Регистрируется учащение сердечных сокращений в среднем на 8-10 ударов на каждый градус повышения температуры тела. У детей раннего возраста тахикардия выражена в большей степени - пульс учащается на 10 ударов на каждые 0,5 °С повышения температуры тела. Увеличивается минутный объем сердца в среднем на 27%. Изменения сердечной деятельности при лихорадке обусловлены как возбуждением симпатической нервной системы, так и прямым действием высокой температуры на синусовый узел. У некоторых больных при резком повышении температуры тела развивается аритмия. Возможно развитие перегрузочной формы сердечной недостаточности. Артериальное давление несколько повышается в первой стадии лихорадки (наблюдается спазм сосудов кожи для уменьшения теплоотдачи), во второй стадии оно становится нормальным или снижается на 10-15% по сравнению с нормой (т.к. сосуды! кожи расширяются для повышения теплоотдачи). В третьей стадии лихорадки артериальное давление снижено или нормально. При критическом снижении температуры тела может развиться острая сосудистая недостаточность (коллапс). Возможны нарушения микроциркуляции в легких - стаз, застойные явления. Давление крови в легочной артерии нередко увеличивается в связи с констрикцией ее ветвей. Дыхание может быть несколько замедлено в первой стадии лихорадки и учащено во второй стадии, что способствует нарастанию теплоотдачи. Эти изменения объясняются действием гипертермии на бульбарный дыхательный центр. В первую стадию лихорадки увеличивается диурез. Это связано с повышением кровяного давления из-за спазма сосудов кожи и оттоком значительной массы крови во внутренние органы, в том числе и в почки. На второй стадии лихорадки диурез уменьшен, что обусловлено в основном задержкой воды и натрия в тканях (повышена секреция альдостерона) и повышенным испарением воды с поверхности гиперемированной кожи и слизистых дыхательных путей. В третьей стадии лихорадки диурез вновь увеличивается, а при критическом падении температуры в связи с резким усилением потоотделения и гипотонией диурез снижается. Иногда развивается альбуминурия, в моче появляются гиалиновые цилиндры. Существенные изменения происходят при лихорадке в желудочно-кишечном тракте. Снижение слюноотделения обусловливает сухость во рту, эпителиальный покров губ высыхает и трескается, появляется налет на языке. При этом создаются условия для размножения различных микробов (стрепто- и стафилококков, палочки Винцента, спирохеты Мюллера и др.), находящихся в полости рта. Возникает неприятный запах изо рта. Эти нарушения требуют ополаскивания слизистой рта и зева дезинфицирующими растворами или обтирания губ и рта влажной марлей, смоченной этими растворами. У больных возникает жажда, резко снижается аппетит. Угнетается секреция желудочного, поджелудочного и кишечного соков. Все это ведет к нарушению пищеварения. Возникает необходимость кормить лихорадящих больных легкоусвояемой высококалорийной пищей (бульоны, соки и др.). Угнетается моторика желудка и тормозится его опорожнение, это вызывает рвоту. Двигательная функция кишечника также снижается, в связи с этим развиваются запоры. Застой в кишечнике в сочетании с понижением секреции пищеварительных соков способствует усилению процессов брожения и гниения, развитию аутоинтоксикации и метеоризма. Лихорадка сопровождается развитием стресса. В связи с этим повышается продукция АКТГ и глюкокортикоидов. Возбуждение симпатической нервной системы сопровождается повышенным поступлением в кровь катехоламинов. Кроме того, при лихорадке усиливается секреция альдостерона и гормона роста. Типовые нарушения углеводного обмена. Гипо- и гипергликемия. Глюкозурия и сахарный диабет. Многочисленные расстройства метаболизма углеводов условно объединяют в несколько групп: гипогликемии, гипергликемии, гликогенозы, гексоз- и пентоземии, агликогенозы. Перечисленные расстройства рассматривают как типовые формы нарушений углеводного обмена. Гипогликемии — состояния, характеризующиеся снижением уровня глюкозы плазмы крови (ГПК) ниже нормы (менее 65 мг%, или 3,58 ммоль/л). В норме ГПК натощак колеблется в диапазоне 65—110 мг%, или 3,58—6,05 ммоль/л. Причины Гипогликемии. Патология печени. Наследственная и приобретённая патология печени — одна из наиболее частых причин гипогликемии. К гипогликемии приводят нарушения транспорта глюкозы из крови в гепатоциты, снижение активности гликогенеза в них и отсутствие (или малое содержание) депонированного гликогена. Гипогликемия развивается также при длительном голодании, а также может развиться при значительной активации жизнедеятельности организма (например, при физической нагрузке или стрессе). Нарушения пищеварения. Нарушения пищеварения — полостного переваривания углеводов, а также их пристеночного расщепления и абсорбции — приводят к развитию гипогликемии. Гипогликемия развивается также при хронических энтеритах, алкоголь ном панкреатите, опухолях поджелудочной железы, синдромах нарушенного всасывания. Патология почек. Гипогликемия развивается при нарушении реабсорбции глюкозы в проксимальных канальцах нефрона почек. Эндокринопатии. Основные причины развития гипогликемии при эндокринопатиях: недостаток гипергликемизирующих факторов или избыток инсулина. Углеводное голодание. Углеводное голодание наблюдается в результате длительного общего голодания, в том числе углеводного. Дефицит в пище только углеводов не приводит к гипогликемии в связи с активацией глюконеогенеза (образование углеводов из неуглеводных веществ). Длительная значительная гиперфункция организма при физической работе. Гипогликемия развивается при длительной и значительной физической работе в результате истощения запасов гликогена, депонированного в печени и скелетных мышцах. Последствия гипогликемии: гипогликемическая реакция, синдром и кома. Гипогликемическая реакция — острое временное снижение ГПК до нижней границы нормы (как правило, до 80—70 мг%, или 4,0—3,6 ммоль/л). Гипогликемический синдром — стойкое снижение ГПК ниже нормы (до 60— 50 мг%, или 3,3—2,5 ммоль/л), сочетающееся с расстройством жизнедеятельности организма. Гипогликемическая кома — состояние, характеризующееся падением ГПК ниже нормы (как правило, менее 40—30 мг%, или 2,0—1,5 ммоль/л), потерей сознания, значительными расстройствами жизнедеятельности организма. Гипергликемии. Гипергликемии — состояния, характеризующиеся увеличением ГПК выше нормы (более 120 мг%, или 6,05 ммоль/л натощак). Причины гипергликемии: эндокринопатии, неврологические и психогенные расстройства, переедание, патология печени. Эндокринопатии. Эндокринопатии — наиболее частая причина гипергликемии. Основные причины развития гипергликемии при эндокринопатиях: избыток гипергликемизирующих факторов и дефицит инсулина. Неврологические и психогенные расстройства. Нейро- и психогенные расстройства характеризуются активацией симпатико-адреналовой, гипоталамо-гипофизарно-надпочечниковой и тиреоидной систем. Гормоны этих систем вызывают ряд эффектов, приводящих к значительной гипергликемии. Переедание. Переедание— одна из причин гипергликемии. Глюкоза быстро всасывается в кишечнике. ГПК повышается и превышает возможность гепатоцитов включать её в процесс гликогенеза. Кроме того, избыток углеводсодержащей пищи в кишечнике стимулирует гликогенолиз в гепатоци-тах, потенцируя гипергликемию. Патология печени. При печёночной недостаточности может развиваться преходящая гипергликемия в связи с тем, что гепатоциты не способны трансформировать глюкозу в гликоген. Обычно это наблюдается после приёма пищи. Последствия гипергликемии: гипергликемический синдром и гипергликемическая кома. Гипергликемический синдром - состояние, характеризующееся длительным увеличением уровня ГПК выше нормы, сочетающееся с нарушением жизнедеятельности. Гипергликемический синдром включает ряд взаимосвязанных признаков. • Глюкозурия - результат превышения возможности канальцевой реабсорбции глюкозы из первичной мочи при уровне ГПК более 10 ммоль/л (физиологического почечного порога для глюкозы). • Полиурия - образование и выделение мочи в количестве, превышающем норму (более 1000-1200 мл/сут), что связано с повышением осмоляльности мочи за счёт наличия в ней глюкозы. • Гипогидратация - уменьшение содержания жидкости в организме вследствие полиурии. • Полидипсия - повышенное употребление жидкости вследствие жажды, обусловленной гипогидратацией и повышением осмоляльности плазмы крови. • Артериальная гипотензия обусловлена гиповолемией вследствие гипогидратации организма. Гипергликемическая кома – частое и тяжелое осложнение, возникающее при сахарном диабете вследствие резкой нехватки гормона инсулина в крови пациента. Состояние развивается довольно медленно, при этом количество глюкозы в организме повышается с одновременным накоплением токсических продуктов распада. САХАРНЫЙ ДИАБЕТ Сахарный диабет - группа метаболических заболеваний, обусловленных снижением секреции инсулина или его эффектов даже при нормальном либо повышенном содержании его в крови, а также сочетанием этих факторов. Сахарный диабет (СД) - одно из наиболее тяжёлых заболеваний, чреватых тяжёлыми осложнениями, инвалидизацией и смертью. Заболеваемость колеблется в разных странах от 1 до 3% (в России около 2%), а у лиц с ожирением достигает 15-25%. Ожирение, СД, артериальная гипертензия и дислипидемия составляют так называемый «метаболический синдром» или «смертельный квартет». По данным экспертов ВОЗ, сахарный диабет увеличивает общую смертность пациентов в 2-3 (!) раза. Примерно в 3 раза чаще у них выявляется сердечно-сосудистая патология, в 10 раз - слепота, в 20 раз - гангрена конечностей. СД - одна из причин поражений почек, ведущих к смерти пациентов. Виды сахарного диабета Согласно классификации ВОЗ выделяют СД двух типов. • СД 1-го типа обусловлен дефицитом инсулина - абсолютной инсулиновой недостаточностью. Выделяют два основных подтипа СД 1-го типа - аутоиммунный (иммуноопосредованный) и идиопатический (неизвестной этиологии). • СД 2-го типа обусловлен недостаточностью эффектов инсулина независимо от его содержания в крови - относительной инсулиновой недостаточностью. Глюкозурия – это патологическое состояние, характеризующееся обнаружением в пробе мочи глюкозы. Причинами могут выступать заболевания поджелудочной железы, различные эндокринные расстройства, болезни почек. Сама по себе глюкозурия не имеет клинических проявлений. Длительное выделение с мочой большого количества глюкозы повышает риск развития инфекций мочевыводящих путей (пиелонефрита, цистита). Уровень глюкозы исследуется натощак в средней порции свежесобранной мочи. Коррекция данного лабораторного отклонения осуществляется лечением основного заболевания. Нарушения жирового обмена. Липиды - неоднородные по химическому составу органические вещества, нерастворимые в воде, но растворимые в неполярных растворителях. Типовыми формами патологии липидного обмена являются ожирение, истощение, липодистрофии, липидозы и дислипопротеинемии. Ожирение Ожирение - избыточное накопление липидов в организме в виде триглицеридов. ВИДЫ ОЖИРЕНИЯ В зависимости от степени увеличения массы тела выделяют три степени ожирения. • Для оценки оптимальной массы тела используют различные формулы. ♦ Наиболее простая - индекс Брока: из показателя роста (в см) вычитают 100. ♦ Индекс массы тела (ИМТ) вычисляют также по следующей формуле: 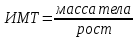 По генезу выделяют первичное ожирение и вторичные его формы. Первичное (гипоталамическое) ожирение - самостоятельное заболевание нейроэндокринного генеза, обусловленное расстройством системы регуляции жирового обмена. Вторичное (симптоматическое) ожирение - следствие различных нарушений в организме, обусловливающих снижение липолиза и активацию липогенеза (например, при СД, гипотиреозе, гиперкортицизме). ЭТИОЛОГИЯ Причина первичного ожирения - нарушение функционирования системы «гипоталамус-адипоциты». Вторичное ожирение развивается при избыточной калорийности пищи и пониженном уровне энергозатрат организма (в основном при гиподинамии). ПАТОГЕНЕЗ ОЖИРЕНИЯ Выделяют нейрогенные, эндокринные и метаболические механизмы ожирения. Нейрогенные варианты ожирения Центрогенный (корковый, психогенный) механизм - один из вариантов расстройства пищевого поведения (два других: неврогенная анорексия и булимия). Причина: различные расстройства психики, проявляющиеся постоянным, иногда непреодолимым стремлением к приёму пищи. Возможные механизмы: активация серотонинергической, опиоидергической и других систем, участвующих в формировании ощущений удовольствия и комфорта; восприятие пищи как сильного положительного стимула (допинга), что ещё более активирует указанные системы. Это замыкает порочный круг центрогенного механизма развития ожирения. Гипоталамический (диэнцефальный, подкорковый) механизм. Причина: повреждение нейронов гипоталамуса (например, после сотрясения мозга, при энцефалитах, краниофарингиоме, метастазах опухолей в гипоталамус). Наиболее важные звенья патогенеза: Повреждение или раздражение нейронов заднелатерального вентрального ядра гипоталамуса стимулирует синтез и секрецию нейропептида Y и снижает чувствительность к лептину, ингибирующему синтез нейропептида Y. Нейропептид Y стимулирует чувство голода и повышает аппетит. Нарушение формирования чувства голода вследствие избыточной выработки нейромедиаторов, формирующих чувство голода и повышающих аппетит (ГАМК, дофамина, β-эндорфина, энкефалинов). Это приводит к снижению синтеза нейромедиаторов, формирующих чувство сытости и угнетающих пищевое поведение (серотонина, норадреналина, холецистокинина, соматостатина). Эндокринные варианты ожирения Эндокринные механизмы ожирения - лептиновый, гипотиреоидный, надпочечниковый и инсулиновый. Лептиновый механизм - ведущий в развитии первичного ожирения. Лептин образуется в жировых клетках. Он уменьшает аппетит и повышает расход энергии организмом. Лептин подавляет образование и выделение гипоталамусом нейропептида Y. Нейропептид Y участвует в формировании чувства голода. Он повышает аппетит и снижает энергорасходы организма. Липостат. Контур «лептин-нейропептид Y» обеспечивает поддержание массы жировой ткани тела при участии инсулина, катехоламинов, серотонина, холецистокинина, эндорфинов. В целом, эта система БАВ, обеспечивающих динамический гомеостаз энергетического обмена и массы жировой ткани в организме, получила название системы липостата. Гипотиреоидный механизм ожирения включается при недостаточности эффектов йодсодержащих гормонов щитовидной железы, что снижает интенсивность липолиза, скорость обменных процессов в тканях и энергетические затраты организма. Надпочечниковый (глюкокортикоидный, кортизоловый) механизм ожирения включается вследствие гиперпродукции глюкокортикоидов в коре надпочечников (например, при болезни и синдроме Иценко-Кушинга), что способствует липогенезу за счёт гипергликемии и включения инсулинового механизма. Инсулиновый механизм развития ожирения развивается вследствие прямой активации инсулином липогенеза в жировой ткани. Метаболические механизмы ожирения. Запасы углеводов в организме относительно малы. В связи с этим выработался механизм экономии углеводов: при повышении в рационе доли жиров скорость окисления углеводов снижается. При расстройстве системы регуляции активируется механизм, обеспечивающий повышение аппетита и увеличение приёма пищи. В этих условиях жиры не подвергаются расщеплению и накапливаются в виде триглицеридов. Истощение Истощение - патологическое снижение массы жировой, а также мышечной и соединительной ткани ниже нормы. Крайней степенью истощения является кахексия. При истощении дефицит жировой ткани составляет более 20-25%, а при кахексии - более 50%. ИМТ при истощении менее 19,5 кг/м2. ЭТИОЛОГИЯ Истощение может быть вызвано эндогенными и экзогенными причинами. Экзогенные причины: Вынужденное или осознанное полное либо частичное голодание. Недостаточная калорийность пищи. Эндогенные причины истощения подразделяют на первичные и вторичные. Причина первичного истощения: подавление синтеза нейропептида Y в гипоталамусе (при травме или ишемии гипоталамуса, сильном затяжном стрессе) и гипосенситизация клеток-мишеней к нейропептиду Y. Причины вторичного (симптоматического) истощения: мальабсорбция, дефицит глюкокортикоидов, гипоинсулинизм, повышенный синтез глюкагона и соматостатина, гиперпродукция клетками опухолей. ПАТОГЕНЕЗ Экзогенное истощение и кахексия. Отсутствие или значительный дефицит продуктов питания приводят к истощению запаса жиров, нарушению всех видов обмена веществ, недостаточности биологического окисления и подавлению пластических процессов. Первичные эндогенные формы истощения Наибольшее клиническое значение имеют гипоталамическая, кахектиновая и анорексическая формы. При гипоталамической (диэнцефальной, подкорковой) форме истощения и кахексии происходит снижение или прекращение синтеза и выделения в кровь нейронами гипоталамуса пептида Y, что нарушает липостат. При кахектиновой (или цитокиновой) форме истощения синтез адипоцитами и макрофагами ФНОа (кахектина) приводит к подавлению синтеза нейропептида Y в гипоталамусе, угнетению липогенеза и активации катаболизма липидов. Анорексическая форма. У лиц, имеющих предрасположенность к анорексии, критическое отношение к массе своего тела (воспринимаемой как избыточную) приводит к развитию нервно-психических расстройств и длительным периодам отказа от приёма пищи. Наиболее часто наблюдается у девочек-подростков и девушек до 18-летнего возраста. Дальнейшее течение процесса связано с уменьшением синтеза нейропептида Y и значительным снижением массы тела, вплоть до кахексии. Вторичные эндогенные формы истощения и кахексии являются симптомами других форм патологии: синдромов мальабсорбции, роста новообразований (синтезирующих ФНОа), гипоинсулинизма, гипокортицизма, недостатка эффектов гормонов вилочковой железы. Липодистрофии и липидозы Липодистрофии - состояния, характеризующиеся генерализованной или локальной утратой жировой ткани, реже - избыточным её накоплением в подкожной клетчатке. Липидозы - состояния, характеризующиеся расстройствами метаболизма липидов в клетках (паренхиматозные липидозы), жировой клетчатке (ожирение, истощение) или стенках артериальных сосудов (например, при атеросклерозе). Дислипопротеинемии Дислипопротеинемии - состояния, характеризующиеся отклонением от нормы содержания, структуры и соотношения в крови различных ЛП. Характер течения и клинические проявления дислипопротеинемий определяются: генетическими особенностями организма (например, составом, соотношением и уровнем различных ЛП); факторами внешней среды (например, набором продуктов питания, особенностями рациона и режима приёма пищи); наличием сопутствующих заболеваний (например, ожирения, гипотиреоза, СД, поражений почек и печени). Атерогенность липопротеинов ЛП подразделяют на атерогенные (ЛПОНП, ЛПНП и ЛППП) и антиатерогенные (ЛПВП). Оценку потенциальной атерогенности ЛП крови проводят путём расчёта холестеринового коэффициента атерогенности: холестерин общий - холестерин ЛПВП холестерин ЛПВП В норме холестериновый коэффициент атерогенности не превышает 3,0. При увеличении этого значения риск развития атеросклероза нарастает. ВИДЫ ДИСЛИПОПРОТЕИНЕМИЙ По происхождению: первичные (наследственные; они могут быть моногенными и полигенными) и вторичные. По изменению содержания липопротеинов в крови: гиперлипопротеинемии, гипо- и алипопротеинемии, комбинированные дислипопротеинемии. Гиперлипопротеинемии - состояния, проявляющиеся стойким повышением содержания ЛП в плазме крови. Гиполипопротеинемии - состояния, проявляющиеся стойким снижением уровня ЛП в плазме крови вплоть до полного их отсутствия (алипопротеинемия). Комбинированные дислипопротеинемии характеризуются нарушением соотношения различных фракций ЛП. Атеросклероз Атеросклероз - хронический патологический процесс, приводящий к изменениям преимущественно во внутренней оболочке артерий эластического и мышечно-эластического типов вследствие накопления избытка липидов, образования фиброзной ткани, а также комплекса других изменений в них. При атеросклерозе наиболее часто поражаются такие артерии, как коронарные, сонные, почечные, брыжеечные, нижних конечностей, а также брюшной отдел аорты. ЭТИОЛОГИЯ Причины атеросклероза окончательно не выяснены. Существует три гипотезы, объясняющие возникновение атеросклероза: липидная, хронического повреждения эндотелия и моноклональная. Факторы риска. Известно не менее 250 факторов, способствующих возникновению и развитию атеросклероза. К наиболее значимым факторам риска относят курение, сахарный диабет, артериальную гипертензию, ожирение, аутоиммунные заболевания, гиперхолестеринемию, гипертриглицеридемию, гипергомоцистеинемию, гиподинамию, наследственную предрасположенность, приём пероральных контрацептивов. ПАТОГЕНЕЗ Выделяют следующие стадии атеросклеротического поражения сосудов: липидных пятен и полосок, образования атеромы и фиброатеромы, развития осложнений. Липидные пятна и полоски Неповреждённый эндотелий препятствует проникновению ЛП в интиму артерий. Под воздействием факторов риска эндотелиальные клетки повреждаются, и развивается эндотелиальная дисфункция - пусковой фактор атерогенеза. Образование липидных пятен и полосок протекает в несколько этапов: Миграции в участки интимы артерий с повреждёнными эндотелиальными клетками большого числа моноцитов и Т-лимфоцитов. Синтеза лейкоцитами БАВ (факторов хемотаксиса, кининов, Пг, ФНОа) и активных форм кислорода, что сопровождается интенсификацией СПОЛ. Указанные факторы потенцируют повреждение эндотелия и проникновение ЛП в интиму сосудов. Дополнительной активации перекисного окисления проникающих в субэндотелиальный слой ЛПНП с образованием модифицированных ЛП. Захвата модифицированных ЛП моноцитами при помощи «скевенджер-рецепторов» (рецепторов-чистильщиков) и превращение их в пенистые клетки - макрофаги, насыщенные липидами. Активации в очаге повреждения стенки артерии Т-лимфоцитов и макрофагов с развитием асептического воспаления. Пролиферации ГМК и фибробластов и синтеза ими компонентов соединительной ткани с образованием в интиме липидных пятен и полосок. Формирование атеромы и фиброатеромы Формирование атеросклеротической бляшки обусловлено несколькими факторами: Дальнейшим повреждением эндотелия медиаторами воспаления, что потенцирует проникновение в интиму сосудов ЛПНП и замыканию просвета сосуда. Развитие осложнений атеросклероза Модификация атеросклеротических бляшек приводит к развитию следующих процессов: кальцификаций, атерокальцинозу - накоплению в ткани бляшек соединений кальция; трещинам крышки фиброатеромы или её изъязвлениям, что сопровождается развитием пристеночного тромба с угрозой обтурации артерии или её эмболии; разрывам стенок новообразованных микрососудов, приводящим к кровоизлияниям в стенку артерии, образованию пристеночных и интрамуральных тромбов. Нарушения белкового обмена Белки занимают центральное положение в осуществлении процессов жизнедеятельности организма. Нарушения белкового обмена возможны на всех этапах, начиная с всасывания и кончая выведением из организма конечных продуктов обмена. Нарушение всасывания и синтеза белков в организме практически нет депо белков. Источником аминокислот для их синтеза служат компоненты пищи. При нарушении переваривания и всасывания белков развивается алиментарная белковая недостаточность. Причины: воспалительные и дистрофические процессы в кишечнике, голодание, несбалансированное по аминокислотному составу питание. Для нормального синтеза белков необходимо активное функционирование соответствующих генетических структур, на которых совершается этот синтез. При повреждении генетического аппарата изменяется синтез белков или синтезируются белки с измененной структурой. Измененный синтез белков может быть следствием нарушения одного из звеньев белоксинтезирующей системы - аппарата трансляции или посттрансляционной модификации молекул. С увеличением частоты ошибок трансляции в процессе жизни связывают старение организма. Относительная нехватка транспортной РНК ограничивает функциональные возможности органов и тканей при повышенных нагрузках. Нарушение синтеза белков может быть связано с дефектом регуляции; на клеточном уровне - это воздействие метаболитов, на уровне организма - гормоны и нервная система. При повышенной продукции соматотропина увеличивается синтез белков, наблюдается усиленный рост организма. Неадекватность этого гормона вызывает противоположный эффект. В денервированных тканях при перерезке нервов не только снижается синтез белков и развивается атрофия, но и появляются качественно новые белки - аутоантигены. Нарушение обмена аминокислот Образуются аминокислоты в процессе трансаминирования, разрушаются в процессе дезаминирования. Причины нарушения реакций трансаминирования: недостаточность пиридоксина (беременность, подавление сульфаниламидами кишечной флоры, лечение фтивазидом); ограничение синтеза белков (голодание, тяжелые заболевания печени). Глюкокортикоиды и тироксин оказывают стимулирующее влияние на изменение скорости трансаминирования. Угнетение окислительного дезаминирования приводит к гипераминоацидемии. Следствием этого является усиленная экскреция аминокислот почками и изменение соотношения отдельных аминокислот в крови, что создает неблагоприятные условия для синтеза белковых структур. Причины: гипоксия; белковая недостаточность при голодании; недостаток пиридоксина, рибофлавина, никотиновой кислоты. Декарбоксилирование является важным направлением белкового обмена, протекает с образованием СО2 и биогенных аминов. Увеличение количества биогенных аминов (гистамина, серотонина, дофамина, таурина) может вызвать ряд патологических явлений в организме: нарушение местного кровообращения, повышение проницаемости сосудов и повреждение нервного аппарата. Наследственное нарушение синтеза ферментов, участвующих в обмене аминокислот, приводит к тому, что соответствующая аминокислота не включается в метаболизм, а накапливается в организме, вызывая различные заболевания. Например, при нарушении обмена фенилаланина (недостаточности фенилаланингидроксилазы) развивается фенилкетонурия - тяжелое поражение центральной нервной системы и неизлечимое слабоумие. Нарушение конечных этапов белкового обмена Патофизиология конечных этапов белкового обмена не включает в себя патологию процессов образования азотистых продуктов и выведения их из организма. Основным показателем нарушения образования и выделения мочевины и других азотистых продуктов обмена является изменение уровня и состава остаточного (небелкового) азота в крови. Увеличение остаточного азота в крови - гиперазотемия - может быть следствием: нарушения образования мочевины в печени дистрофические изменения в печени; гипоксия; наследственное нарушение мочевинообразования. Следствие - накопление аммиака в крови, оказывающего токсическое действие на центральную нервную систему. Нарушение образования и выделения мочевой кислоты (конечный продукт обмена пуриновых оснований, входящих в структуру нуклеиновых кислот). Причины: заболевания почек, лейкозы. Гиперуринемия приводит к отложению солей мочевой кислоты в суставах и хрящах, вызывающих острое подагрическое воспаление. Исход: деформация суставов. Нарушения белкового состава крови. Проявляются: изменением общего количества белков (гипопротеинемия, гиперпротеинемия); изменением соотношения между отдельными белковыми фракциями (диспротеинемия) при нормальном общем содержании белков. Гипопротеинемия возникает за счет снижения количества альбуминов. Причины: голодание; заболевания печени; нарушение всасывания белков; кровопотеря, плазмопотеря, экссудация, транссудация; протеинурия. Гиперпротеинемия связана с гиперглобулинемией: усиление синтеза антител; компенсаторная реакция при снижении альбуминов в крови. Нарушения минерального обмена. Наибольшее практическое значение имеют нарушения обмена кальция, меди, калия и железа. при: подагре; мочекаменной болезни; мочекислом инфаркте. 1. Нарушение обмена кальция Нарушение обмена кальция в тканях организма называют обызвествлением. В зависимости от преобладания общих или местных факторов в развитии кальцификации различают три формы обызвествления: метастатическое; дистрофическое; метаболическое. Метастатическая кальцификация возникает при увеличении концентрации кальция или фосфора в крови (гиперкальциемия). Кальцификация происходит наиболее часто в стенках артерий, альвеолярных перегородках легких, в слизистой оболочке желудка, в миокарде левого желудочка и в почках. Причины метастатического обызвествления связаны с усиленным выходом солей кальция из депо и с пониженным выведением солей кальция из организма. При микроскопии кальций окрашивается в интенсивно фиолетовый цвет (базофильно). В ранних стадиях кальцификации очаги скопления кальция кажутся гранулярными, а большие очаги аморфными. Гистохимически кальций выявляют методом серебрения Косса. Вокруг отложений извести наблюдается воспалительная реакция, иногда отмечаются скопления макрофагов, гигантских клеток, образование гранулемы. Внешний вид органов и тканей мало изменен. Исход неблагоприятен: выпавшие соли практически не рассасываются. При кальцификации почечного интерстициума (нефрокальциноз) может возникать хроническая почечная недостаточность. Обширная кальцификация кровеносных сосудов может приводить к ишемии, особенно в коже. Редко при обширном повреждении легочных альвеол возникают нарушения диффузии газов. Кроме этих случаев, кальцификация не нарушает функции паренхиматозных клеток в тканях. При дистрофическом обызвествлении (петрификации) метаболизм кальция и фосфора не нарушен. Их уровень концентрации в сыворотке крови нормальный. Кальцификация происходит в результате местных нарушений в тканях. Отложения солей кальция имеют местный характер и обычно обнаруживаются в тканях омертвевших или находящихся в состоянии глубокой дистрофии. Основная причина дистрофического обызвествления - физико-химические изменения тканей, сопровождающиеся ощелачиванием среды в связи с усиленным потреблением кислорода и выделением углекислоты, изменением свойств белковых коллоидов (коагуляцией белка) и усилением активности фосфатаз. В таких тканях появляются разных размеров очаги каменистой плотности - петрификаты. Метаболическое обызвествление (интерстициальный кальциноз). Механизм его развития до конца не ясен. Главное значение придают нестойкости буферных систем (pH и белковые коллоиды) крови и тканевой жидкости, в связи с чем кальций не удерживается в них даже при его невысокой концентрации, часто играет роль наследственная предрасположенность. Интерстициальный кальциноз различают: системный; ограниченный. Примером интерстициального системного кальциноза служит опухолеподобный кальциноз. Интерстициальный ограниченный кальциноз, или известковая подагра, характеризуется отложением солей кальция в виде пластинок в коже рук, реже - ног. Исход неблагоприятен: выпавший кальций обычно не рассасывается или рассасывается с трудом. Имеют значение распространенность, локализация и характер обызвествления. 2. Нарушение обмена меди Нарушение обмена меди наиболее ярко проявляется при болезни Вильсона. При этом заболевании экскреция меди в желчь нарушена, что ведет к увеличению содержания меди в организме с накоплением ее в клетках. Депонирование меди в гепатоцитах обусловлено пониженным образованием в печени церулоплазмина, который способен связывать в крови медь. Печень и базальные ядра мозга - наиболее часто повреждаемые ткани, поэтому болезнь Вильсона еще называется гепато-церебральной дистрофией. 3. Нарушение обмена калия Увеличение количества калия в крови (гиперкалиемия) и в тканях отмечается при аддисоновой болезни и связано с поражением коры надпочечников, гормоны которого контролируют баланс электролитов. При некоторых аденомах надпочечника может наблюдаться и гипокалиемия (альдостерома с развитием синдрома Кона). Дефицит калия лежит в основе наследственного заболевания, именуемого "периодический паралич". Заболевание сопровождается приступами слабости и развитием двигательного паралича. Нарушения водного обмена. Обезвоживание и задержка воды в организме. Нарушения водного обмена. Общее содержание воды в организме животных достигает 65—70%. Вода в организме находится в 1) вода, химически и физически связанная; 2) вода в промежуточном — неупорядоченном состоянии по отношению к веществу и 3) вода, химически не связанная, выполняющая функции рассеивающей среды; физически она может быть подвижной или неподвижной. Соотношение различных фракций воды в организме до известной степени может меняться, и это откладывает свой отпечаток на водный обмен Если баланс - - обезвоживание организма, а если он становится + гипергидремия. Водный обмен нарушается при утрате способности почек концентрировать мочу из-за ухудшения реабсорбции воды в канальцах. следствие поражения гипоталам, регулирующего водно-солевой обмен посредством воздействия на заднюю долю гипофиза, которая ограничивает выделение антидиуретического гормона. В результате полиурия. происходит также при сильном потении, ожогах - дегидратация, осм давления, дистр изм-я в тканях. В результате усиленного распада образуется -белковый баланс и увеличивается содержание продуктов распада в тканях.в организме сгущение крови, окислительных процессов и замедление ресинтеза молочной кислоты приводят к изменению кислотно-щелочного равновесия в сторону ацидоза. Потеря организмом 10% связанной внутрикл. воды вызывает в нем значительные изменения, а 20% — даже смерть животного.интоксикация. Конц. азотистых продуктов в крови повышается Отек и водянка.Скопл жидкости в тк вследствие наруш обмена воды между кр и тк - отек. Если жид направляется в серозной пол и там скапл в б кол - водянка. В зав от скопл жидкости в той или иной серозной пол они им назв соответственно этой пол; напр, водянка плевр пол — гидроторакс, водянка околосерд сумки — гидроперикардиум, вод желудочков мозга — гидроцефалус и пр. Водянка брюшной пол –асцит. При отеке: 1)↑ объем тк, 2) ↓ их эласт св-ва, 3) Т. 4)При надавл на поверхн отечной тк или орг возник на некот вр углубление. Отечная жид сост из воды (97%), солей (около 0,7%) и белка (от 0,3 до 1,2%) – состав отлич в зав от заболев, вызв отёк. При нефрите - неб кол белка, при серд отеках его меньше и еще меньше при нефрозах и др. |
