Зачем врачу нужна биологическая химия
 Скачать 6.47 Mb. Скачать 6.47 Mb.
|
Быстрая компенсация сдвигов рНБуферные системыБуферные системы – это соединения, противодействующие резким изменениям концентрации ионов Н+, включающие кислотно-основные пары: слабое основание (анион, А–) и слабая кислота (Н-А). Они вступают в действие моментально и через несколько минут их эффект достигает максимума возможного. Существует несколько буферных систем жидкостей организма – бикарбонатная, фосфатная, белковая,гемоглобиновая. Бикарбонатная буферная системаЭта система состоит из бикарбонат-иона (НСО3–) и угольной кислоты (Н2СО3), буферная мощность составляет 65% от общей буферной емкости крови. В норме отношение HCO3– к H2CO3 равно 20 : 1. Работа этой системы неразрывно и тесно связана с легкими. При поступлении в кровь более сильной кислоты, чем угольная, ионы бикарбоната натрия взаимодействуют с ней, происходит реакция обмена и образуется соответствующая соль и угольная кислота. В результате, благодаря связыванию введенной в систему кислоты, концентрация ионов водорода значительно понижается. NaНСО3 + Н-Анион → Н2СО3 + Na+ + Анион– При поступлении оснований они реагируют с угольной кислотой и образуют соли бикарбонатов: H2CO3 + Катион-ОН → Катион+ + HCO3– + Н2О Возникающий при этом дефицит угольной кислоты компенсируется уменьшением выделения CO2 легкими. При накоплении угольной кислоты в крови не происходит параллельного значимого увеличения концентрации НСО3–, т.к. угольная кислота очень плохо диссоциирует. Благодаря работе бикарбонатного буфера концентрация водородных ионов понижается по двум причинам:
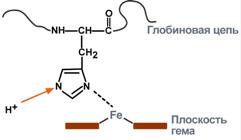
Н2СО3 → Н2О + СО2↑ Кроме эритроцитов, значительная активность карбоангидразы отмечена в эпителии почечных канальцев, клетках слизистой оболочки желудка, коре надпочечников и клетках печени, в незначительных количествах – в центральной нервной системе, поджелудочной железе и других органах. Фосфатная буферная системаФосфатная буферная система составляет около 1-2% от всей буферной емкости крови и до 50% буферной емкости мочи. Она образована дигидрофосфатом (NaH2PO4) и гидрофосфатом (Na2HPO4) натрия. Первое соединение слабо диссоциирует и ведет себя как слабая кислота, второе обладает щелочными свойствами. В норме отношение HРO42– к H2РO4– равно 4 : 1. При взаимодействии кислот (ионов водорода) с двузамещенным фосфатом натрия (Na2HPO4) натрий вытесняется, образуется натриевая соль дигидрофосфата (H2PO4–). В результате, благодаря связываниювведенной в систему кислоты, концентрация ионов водорода значительно понижается. HPO42– + Н-Анион → H2PO4– + Анион– При поступлении оснований избыток ОН– групп нейтрализуется имеющимися в среде Н+ , а расход ионов Н+восполняется повышением диссоциации NaH2PO4. H2PO4– + Катион-ОН → Катион+ + HPO42– + Н2О Основное значение фосфатный буфер имеет для регуляции pH интерстициальной жидкости и мочи. В моче роль его состоит в сбережении бикарбоната натрия за счет дополнительного иона водорода (по сравнению с NaHCO3) в составе выводимого NaH2PO4: Na2HPO4 + Н2СО3 → NaH2PO4 + NaНСО3 Кислотно-основная реакция мочи зависит только от содержания дигидрофосфата, т.к. бикарбонат натрия в почечных канальцах реабсорбируется. Белковая буферная системаБуферная мощность этой системы составляет 5% от общей буферной емкости крови. Белки плазмы, в первую очередь альбумин, играют роль буфера благодаря своим амфотерным свойствам. Вкислой среде подавляется диссоциация СООН-групп, а группы NH2 связывают избыток Н+, при этом белок заряжается положительно. В щелочной среде усиливается диссоциация карбоксильных групп, образующиеся Н+ связывают избыток ОН–-ионов и pH сохраняется, белки выступают как кислоты и заряжаются отрицательно. 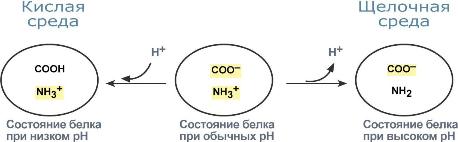 Изменение заряда буферных групп белка при различных рНГемоглобиновая буферная системаНаибольшей мощностью обладает гемоглобиновый буфер, который можно рассматривать как часть белкового. На него приходится до 30% всей буферной емкости крови. В буферной системе гемоглобина существенную роль играет гистидин, который содержится в белке в большом количестве. Изоэлектрическая точка гистидина равна 7,6, что позволяет гемоглобину легко принимать и легко отдавать ионы водорода при малейших сдвигах физиологической рН крови (в норме 7,35-7,45). Данный буфер представлен несколькими подсистемами:
Пара ННb/ННbО2 является основной в работе гемоглобинового буфера. Соединение ННbО2 является более сильной кислотой по сравнению с угольной кислотой, HHb - более слабая кислота, чем угольная. Установлено, что ННbО2 в 80 раз легче отдает ионы водорода, чем ННb. Работа гемоглобинового буфера неразрывно связана с дыхательной системой (Газобмен в легких и тканях).
В легкихпосле удаления СО2 (угольной кислоты) происходит защелачивание крови. При этом присоединение О2 к дезоксигемоглобину H-Hb образует кислоту ННbО2 более сильную, чем угольная. Она отдает свои ионы Н+ в среду, предотвращая повышение рН: Н-Hb + O2 → [H-HbO2] → НbO2 + Н+ В капиллярах тканей постоянное поступление кислот (в том числе и угольной) из клеток приводит к диссоциации оксигемоглобина НbO2 (Эффект Бора) и связыванию ионов Н+ в виде Н-Hb: НbO2+ Н+ → [H-HbO2] → Н-Hb + O2 | |||||||||