биохимия. Значение изучаемой темы
 Скачать 1.04 Mb. Скачать 1.04 Mb.
|
Тема № 1. Введение в биохимический практикум. Физико-химические методы в биохимии. Химия аминокислот, пептидов и белков. Определение белка в сыворотке крови биуретовым методом  Значение изучаемой темы: знания, полученные на данном занятии, будут применяться в будущей практической деятельности, навыки работы на колориметре – для выполнения лабораторных работ в курсе биохимии. 1. Основные понятия и положения темы1.1. Объект биохимических исследованийДля клинико-биохимических анализов используют: 1) биологические жидкости внутренних сред организма - плазму или сыворотку крови, спинно-мозговую жидкость, лимфу, амниотическую, внутрисуставную или внутриглазную жидкости. 2) биологические выделения (экстракты) - мочу, желчь, слюну, желудочный и кишечный соки, кал, пот, слезную жидкость, женское молоко и молозиво, семенную жидкость, слизистые выделения. Пробу биологической жидкости берут утром натощак. Чаще всего исследуется утренняя моча, но для некоторых анализов (например, гормонов) используется суточная моча. Капиллярную кровь у взрослых получают из пальца, у детей - можно из мочки уха, большого пальца ноги или пятки. Большое количество крови берут из локтевой вены (у маленьких детей - из подкожных вен головы). Из цельной крови с добавлением антикоагулянта (гепарина или цитрата натрия) центрифугированием можно получить плазму и форменные элементы крови. Сыворотка крови отличается от плазмы тем, что в ней отсутствует фибриноген и другие белки крови, участвующие в ее свертывании и вошедшие в сгусток. Для получения сыворотки кровь собирают в сухую пробирку без антикоагулянта и оставляют в холодильнике для образования и отделения сгустка. В сыворотке, плазме, эритроцитах определяют вещества, неравномерно распределенные между эритроцитами и жидкой средой крови. Например, Na, K, фосфаты, билирубин и т.д. Если анализ невозможно провести сразу, то объекты биохимических исследований можно хранить в холодильнике. Срок хранения, в зависимости от вида определяемого вещества, может быть от нескольких часов до нескольких суток. 1.2. Выражение результатов биохимических исследованийВыбранная для исследования методика должна отличаться точностью, специфичностью и воспроизводимостью результатов. В биохимии и клинической химии используются основные и производные единицы СИ. Концентрацию веществ, молекулярная масса которых известна (например, концентрацию глюкозы, мочевины, мочевой кислоты в биологических жидкостях), выражают в единицах молярной концентрации моль/литр или в дольных единицах - миллимоль/литр, микромоль/литр. Концентрацию веществ, у которых не установлена или точно не известна молекулярная масса, выражают в единицах массовой концентрации (или в массовых долях) - кг/л, г/л, мг/л, мкг/л и т.д. В этих же единицах выражаются результаты определения содержания белков (альбумин, фибриноген, общий белок, гаптоглобин, общих липидов.). 1.3. Физико-химические методы в биохимииЦентрифугированиеЦентрифугирование - метод разделения неоднородных систем, в том числе суспензий и растворов, в поле центробежных сил. В основе метода лежит следующий принцип: более крупные и более плотные частицы осаждаются быстрее и собираются на дне пробирки. Рабочая часть центрифуги – ротор, в который помещают пробирки с исследуемой жидкостью. Центрифужные пробирки перед центрифугированием уравновешивают и в роторе ставят друг против друга. В лабораторной практике центрифугирование чаще всего применяют для: 1) отделения форменных элементов от плазмы крови; 2) разделения субклеточных частиц; 3) осаждения денатурированных белков. В клинической биохимии наиболее часто используют центрифуги общего назначения, которые способны давать максимальную скорость до 6000 об/мин. Для получения субклеточных частиц используют скоростные и ультрацентрифуги. Ультрацентрифуги дают предельную скорость до 80 000 об/мин и центробежное ускорение до 500 000 g. Они снабжены холодильником и вакуумной установкой. Фотометрия Ф о т о м е т р и я - метод количественного анализа, основанный на измерении интенсивности поглощения или рассеяния веществом светового потока. Светопоглощение или э к с т и н к ц и я прямо пропорционально концентрации поглощающего вещества, толщине слоя раствора и коэффициенту молярной экстинкции. Коэффициент молярной экстинкции – величина поглощения, которую дает 1 моль вещества в 1 мл раствора при толщине слоя измеряемого раствора равной 1 см. Экстинкция прямо пропорциональна интенсивности окраски раствора, которая может быть изначальной (то есть определяемое вещество обусловливает цвет раствора), либо приобретенной в процессе химической реакции. Концентрацию определяемого вещества можно рассчитать двумя способами: 1) используя экстинкцию стандартного раствора с известной концентрацией определяемого вещества. Для этого составляют пропорцию: Ест. соответствует Сст. Еоп. -"- Соп. Сст. х Еоп.  откуда Соп.= ; откуда Соп.= ;Ест. где Ест. - экстинкция стандартного раствора; Еоп. - экстинкция исследуемого раствора; Сст. - концентрация стандартного раствора; Соп. - концентрация определяемого вещества. 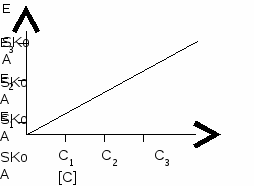 2) Концентрация исследуемого вещества определяется с помощью калибровочного графика. Для построения калибровочного графика измеряют экстинкции нескольких растворов с известной концентрацией определяемого вещества. 2) Концентрация исследуемого вещества определяется с помощью калибровочного графика. Для построения калибровочного графика измеряют экстинкции нескольких растворов с известной концентрацией определяемого вещества.Фотометрические приборы делятся на две большие группы: фотоэлектроколориметры и спектрофотометры. В фотоэлектроколориметрах нужные спектральные диапазоны выделяют при помощи светофильтров (красного, зеленого, синего, фиолетового и т.д.). В спектрофотометрах участки спектра выделяют при помощи призм или дифракционных решеток, поэтому можно установить любую длину волны в заданном диапазоне. Обычно спектрофотометры - это приборы более высокого класса, чем фотометры - в них можно выделить более узкий участок (более монохроматический) спектра, следовательно, точность измерения будет выше. Однако, все зависит от конкретной конструкции прибора. Чаще всего в клинической биохимии фотометрия проводится в области 400-700 нм – это, так называемая, видимая область спектра. Свет с большей длиной волны относится к ближней инфракрасной области, измерения в которой приходится делать чрезвычайно редко. Свет с длиной волны короче 400 нм относится к ультрафиолетовому диапазону, причем, различают ближнюю область с длиной волны 300-400 нм и коротковолновый диапазон 220-300 нм. Для фотометрических измерений в видимой и ближней инфракрасной областях применяются кюветы из обычного стекла. Для ближней ультрафиолетовой области нужны кюветы из специальных сортов стекла - увиолевые; в коротковолновой ультрафиолетовой области пригодны только кюветы из кварца или сапфира (высокой стоимости). Последовательность операций при работе на спектрофотометрах или фотометрах различных конструкций несколько различаются, но имеется общий принцип. Сначала устанавливают нужную длину волны, выбирая светофильтр на фотометре или вращая соответствующую рукоятку на спектрофотометре. Следующий этап - выведение нуля. Для этого в кюветодержатель устанавливают кювету с контрольным раствором (растворитель или раствор, полученный в результате холостого опыта, то есть без проведения химической реакции). Изменяя интенсивность светового потока, выводят показания прибора на величину шкалы, предусмотренную инструкцией (чаще всего - на нуль). После этого устанавливают опытную или стандартную пробу и по шкале прибора проводят отсчет величины оптической плотности. В биохимических лабораториях наиболее широко применяются фотоэлектроколориметры КФК, КМФЦ-2, БИАН-120 и др.; спектрофото-метры СФ-16, СФ-26 и их современные модификации. 1.4. АминокислотыАминокислоты - это производные карбоновых кислот, у которых один или несколько атомов водорода замещены на аминогруппу. 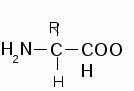 Известно более 150 аминокислот, из них только 20 входят в состав белков (эти аминокислоты называют белковыми). У белковых аминокислот аминогруппа находится в α-положении (т.е. у 2-го атома углерода). Белковые аминокислоты относятся к L-оптически активному ряду. Классификация аминокислот
В зависимости от природы R все аминокислоты можно разделить на группы: 1) аминокислоты с гидрофобными радикалами (таких аминокислот 8); 2) аминокислоты с гидрофильными полярными радикалами: а) незаряженными радикалами (7 аминокислот), б) положительно заряженными радикалами (3 аминокислоты), в) отрицательно заряженными радикалами (2 аминокислоты). Физико-химические свойства аминокислотАминокислоты - твердые тугоплавкие вещества, хорошо растворимые в воде, многие сладкие на вкус. В твердом состоянии они находятся главным образом в виде биполярного иона (цвиттериона). В растворе наблюдается равновесие между разными формами аминокислот. Это равновесие сдвигается в зависимости от рН среды. В щелочной среде преобладают анионные формы аминокислот, в кислой – катионные. рН среды, при которой аминокислоты существуют в виде цвиттериона, называется изоэлектрической точкой. В этой точке растворимость аминокислот минимальна. Химические свойства аминокислотРеакционная способность аминокислот связана с наличием амино- и карбоксильной групп, а также функциональными группами радикала.
1.5. Пептиды. БелкиПептиды - это полимеры, состоящие из аминокислот, соединенных пептидными связями. Классификация:
БелкиСтроение и общая характеристикаБелки - это полимеры, содержащие свыше 50 аминокислот, соединенных пептидными связями. 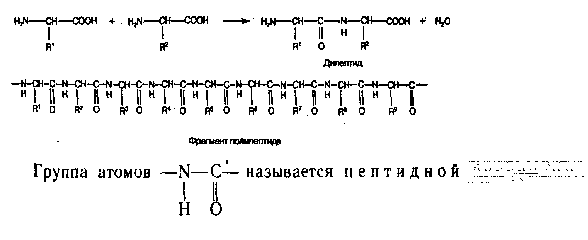 Структуры белковПервичная структура - это состав и последовательность аминокислот в цепи. Она стабилизируется пептидными связями и имеет форму цепи. При написании полных формул больших полипептидных цепей часто указывают только порядок следования друг за другом аминокислотных остатков с помощью специальных трехбуквенных обозначений, например для начала полипептидной цепочки инсулина: гли—иле—вал—глу— и т. д., что соответствует следующей последовательности: глицин—изолейцин— валин—глутаминовая кислота— 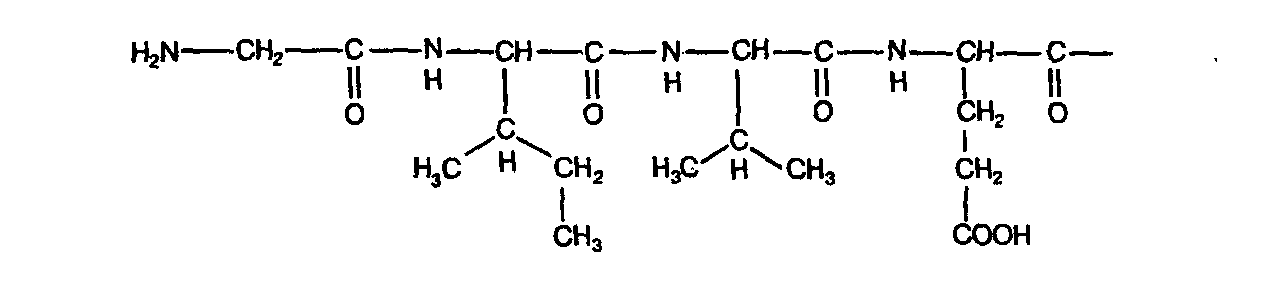 Полипептидную цепь принято записывать, начиная с N-конца, т. е. с конца, содержащего свободную NH2-rpynny. Вторичная структура - это регулярное (закономерное) расположение полипептидной цепи в пространстве. Она стабилизируется водородными связями между "N" и "О", находящимися в разных плоскостях пептидной связи и имеет форму спирали или β - складчатого листа. 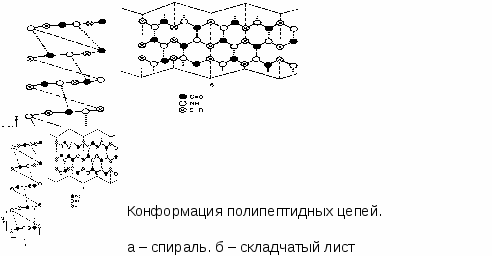  Третичная структура - это дальнейший специфический, но беспорядочный способ укладки вторичной структуры в пространстве. Она основана на взаимодействии групп, далеко отстоящих друг от друга вдоль цепи, и стабилизируется: дисульфидными мостиками, ионными связями (между СОО- и NH3+-группами радикалов), гидрофобными взаимодействи-ями, а также водородными связями. Способ укладки третичной структуры определяется первичной структурой, т.е. последовательностью аминокислот. Четвертичная структура - это агрегация нескольких мономерных третичных структур в олигомеры. Каждая третичная структура в таком белке называется субъединицей. Стабилизирующие связи: ионные, водородные, гидрофобные. Субъединицы могут быть как идентичными, так и разными по первичной, вторичной и третичной структуре. Олигомерные белки широко распространены в природе; в настоящее время их известно свыше 650 (большая часть из них является ферментами). Чаще всего они состоят из двух или четырех субъединиц, однако известны также около 30 белков, имеющих в своем составе три субъедиицы. Выделены и идентифицированы олигомерные белки, четвертичные структуры которых представлены пятью, шестью и даже девятью субъединицами. Основные физико-химические свойства белков1. Растворимость белков. Растворимость белков обусловлена образованием вокруг молекулы гидратной оболочки, которая не дает отдельным молекулам белка слипаться в крупные агрегаты. Гидратная оболочка возникает за счет того, что многие полярные радикалы аминокислот выступают наружу в окружающую водную среду. 2. Денатурация белков - необратимое разрушение четвертичной, третичной и может быть вторичной структур белка. Первичная структура всегда остается неизменной. Денатурацию могут вызвать высокие и очень низкие температуры, воздействие кислот и щелочей, солей тяжелых металлов, УФ-облучение и т.д. Денатурированный белок выпадает в осадок. 3. Высаливание белков - это качественно иной способ осаждения белков без изменения его структуры с помощью солей щелочных и щелочноземельных металлов. Причиной осаждения белков является отнятие гидратных оболочек и нейтрализация заряда на поверхности, затем слипание молекул в крупные агрегаты. Высаливание является обратимым процессом, так как белки при этом не утрачивают своих исходных свойств. 4. Электрофорез - это разделение белков в электрическом поле в зависимости от заряда и массы. Чем меньше масса и больше заряд белка, тем быстрее он движется в электрическом поле. 5. Изоэлектрическая точка - это значение рН, при котором суммарный заряд на поверхности белка равен 0, и белок не движется в электрическом поле. В этой точке белки легко осаждаются. 6. Лиофилизация - это сушка белков в вакууме с сохранением их нативных свойств. 7. Гидролиз белка - разрушение пептидных связей с помощью воды. Классификация белковI. По составу молекулы белки делятся на простые (состоят только из аминокислот) и сложные (кроме аминокислот содержат небелковые вещества: углеводы, липиды, нуклеиновые кислоты, металлы и другие). II. По форме молекулы белки делятся на глобулярные (имеют форму шара) и фибриллярные (имеют форму ниточки, палочки, цилиндрика). 2. План изучения темы2.1. Исходный уровень знаний1. Принцип работы колориметра. 2. Принцип работы центрифуги. Нормальное содержание белка в крови – 65-85 г/л. Диагностическое значение определения белка в сыворотке кровиУвеличение белка в крови (гиперпротеинемия) наблюдается сравнительно редко. Относительная гиперпротеинемия наблюдается при сгущении крови из-за значительных потерь жидкости. Гипопротеинемия наблюдается при недостаточном поступлении белка с пищей, заболеваниях желудочно-кишечного тракта, понижении биосинтеза белка при хронических паренхиматозных гепатитах, интоксикации, злокачественных новообразованиях. Гипопротеинемия может наблюдаться также при потерях белка организмом при острых и хронических кровопотерях, увеличенной проницаемости капилляров, кровопусканиях. Диагностическое значение определения белка в мочеМоча здорового человека содержит минимальные количества белка (около 40 мг в сутки), не обнаруживаемые качественным реакциями. Выде-ление белка в количестве более 4,5 мг в час, при котором качественные пробы становятся положительными, называют протеинурией. Почечные протеинурии возникают в результате органического поражения почек. Внепочечные протеинурии наблюдаются при патологических процессах мочевыводящих путей. От истинных почечных протеинурий необходимо отличать функциональные протеинурии, при которых отсутствуют органические поражения почек (протеинурия новорожденных, алиментарная протеинурия, холодовая, маршевая и т. д.). Причиной их чаще всего является увеличение размеров пор почечного фильтра при сильных внешних раздражителях. 1. Каплю раствора, содержащего смесь аминокислот гли, ала, глу, лиз, арг, гис, нанесли на середину электрофоретической бумаги, смочили буфером рН 6,0 и приложили электрическое напряжение. Укажите, в каком направлении (к катоду, аноду или останутся на старте) будут двигаться отдельные аминокислоты. 2. Трипептид, выделенный из токсина змей, состоит из трех незаменимых аминокислот серосодержащей, гетероциклической и гидроксилсодержащей. Напишите этот трипептид и определите его изоэлектрическую точку. 3. По данным количественного аминокислотного анализа в сывороточном альбумине содержится 0,58% триптофана, молекулярная масса которого равна 204. Рассчитайте минимальную молекулярную массу альбумина. 4. Чем объяснить возможное снижение растворимости белков при отщеп-лении от них пептидов (как в случае с фибриногеном)? 5. Как объяснить, что белок молока казеин при кипячении сворачивается (выпадает в осадок), если молоко кислое? |
