биохимия. Значение изучаемой темы
 Скачать 1.04 Mb. Скачать 1.04 Mb.
|
Тема № 6. Обмен белков и аминокислот. Биохимическая диагностика заболеваний печени: определение активности аминотрансфераз Значение изучаемой темы: Знания об обмене аминокислот и белков будут использованы в других разделах биохимии, а также при изучении таких дисциплин как патология, фармакология и будущей профессиональной деятельности. 1. Основные понятия и положения темы1.1. Функции белков- ферментативная; - структурообразовательная; - защитная (иммунная); - опорная; - сократительная; - регуляторная (гормоны, рецепторы); - энергетическая - транспортная (белки плазмы крови, белки мембран, белки плазматических мембран, белки каналов); - специфические функции. 1.2. Переваривание белковПереваривание белков осуществляется пептидазами. Пептидазы являются ферментами класса гидролаз, расщепляют пептидные связи. Различают эндо- и экзопептидазы. Эндопептидазы расщепляют внутренние пептидные связи, к ним относятся пепсин и гастриксин желудка, трипсин, химотрипсин, коллагеназа и эластаза поджелудочной железы, энтеропептидаза кишечника. Экзопептидазы расщепляют внешние пептидные связи, к ним относятся карбоксипептидаза поджелудочной железы, аминопептидаза и олигопептидазы кишечника. Все пептидазы образуются в неактивной форме и активируются путем ограниченного протеолиза в тех местах, где они действуют. Характеристика пептидазПепсин образуется главными клетками желудка в виде препепсина. Перевод препепсина в пепсин происходит путем отщепления 42 аминокислотных остатков. Процесс начинается под воздействием протонов водорода и идет медленно, а затем каждая активная молекула пепсина действует на неактивные молекулы, и этот процесс идет быстро. Таким образом, за короткое время в желудке образуется много активных молекул пепсина, которые расщепляют связи, образованные карбоксильными группами ароматических аминокислот (фенилаланина, тирозина и триптофана). Пепсин действует в сильно кислой среде при рН 1,5 - 2,5. Гастриксин образуется в желудке, расщепляет связи, образованные карбоксильными группами дикарбоновых аминокислот (глутамата и аспартата), действует при рН 3,5. Трипсин образуется в поджелудочной железе в виде претрипсина. Активируется под действием энтеропептидазы кишечника путем отщепления 6 аминокислот. Трипсин расщепляет связи, образованные карбоксильными группами аргинина или лизина. Под воздействием трипсина переходят в активное состояние другие пептидазы. Химотрипсин образуется в поджелудочной железе в виде прехимотрипсина. Активируется под действием трипсина. Расщепляет связи, образованные карбоксильными группами ароматических аминокислот. Эластаза образуется в поджелудочной железе, расщепляет связи образованные пролином. Карбоксипептидаза образуется в поджелудочной железе в неактивной форме, активируется трипсином, отщепляет аминокислоты со свободной карбоксильной группой, то есть является экзопептидазой. Аминопептидаза образуется в кишечнике, отщепляет аминокислоты со свободной аминогруппой. Дипептидазы образуются в кишечнике и расщепляют дипептиды. В результате действия выше перечисленных пептидаз белки расщепляются до аминокислот, которые всасываются стенкой кишечника путем активного транспорта с использованием специфических переносчиков, витамина В6 и АТФ. Через воротную вену аминокислоты попадают в печень, которая обладает наибольшей способностью поглощать аминокислоты из крови, весьма активны в этом отношении почки. Головной мозг поглощает аминокислоты избирательно. Часть аминокислот не всасывается и подвергается действию кишечной микрофлоры. Роль НСl- необходима для превращения препепсина в пепсин; - создает оптимум рН для работы пепсина; - способствует денатурации и набуханию пищевых белков; - обладает бактерицидным действием, то есть препятствует развитию микрофлоры. Соляная кислота образуется обкладочными клетками желудка. В добавочных клетках желудка образуется слизь, содержащая гликопротеины. Слизь препятствует самоперевариванию желудка. Регуляция выработки пищеварительных соковСоки желудка: Ацетилхолин, освобождающийся при раздражении блуждающего нерва, приводит к секреции гистамина, который через Н2-рецепторы стимулирует секрецию НСl. Гастрин, пептидный гормон желкдка, вызывает выделение желудочного сока. Энтерогастрон, гормон 12-перстной кишки, тормозит секрецию НСl и препепсина в желудке. Поджелудочные соки: Секретин, пептидный гормон 12-перстной кишки, стимулирует выделение поджелудочного сока, содержащего много воды и гидрокарбонатов, но обедненного ферментами. Ацетилхолин стимулирует секрецию поджелудочного сока, богатого ферментами. Холецистокинин, пептидный гормон 12-перстной кишки, усиливает секрецию сока поджелудочной железы, обогащенного ферментами. ГКС усиливают секрецию всех пищеварительных соков (и желудка, и поджелудочной железы), но снижает выделение слизи. Источники аминокислот
Пути использования аминокислот
- окисляться в цикле Кребса, - использоваться в ГНГ на синтез глюкозы, - превращаться в кетоновые тела. 1.4. Декарбоксилирование аминокислотДекарбоксилирование аминокислот - это отщепление от аминокислоты карбоксильной группы. Процесс катализируется декарбоксилазами, в состав которых входит витамин В6. В большинстве случаев при декарбоксилировании аминокислот образуются амины (исключением является глутамат, при декарбоксилировании которого образуется -аминомасляная кислота). Примеры реакций декарбоксилирования и функции образовавшихся продуктов: 1. При декарбоксилировании орнитина образуется путресцин, лизина - кадаверин (уравнение реакции смотрите в приложении или учебнике). Эти амины образуются при бактериальном брожении из белков и давно известны из-за неприятного запаха. Раньше их считали трупными ядами, хотя это не так. Из них образуются полиамины. Из путресцина образуются спермин и спермидин, которые стабилизируют структуру мембран. Спермидин прочно связан с ДНК и может способствовать стабилизации ее структуры. 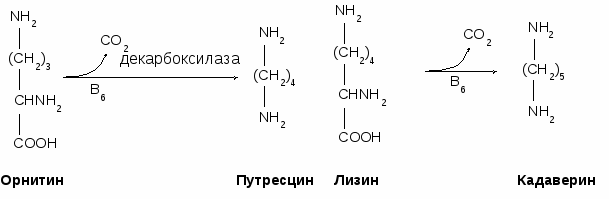 2. При декарбоксилировании серина образуется этаноламин, который путем метилирования превращается в холин. Холин и этаноламин входят в состав сложных липидов. Из холина путем ацетилирования образуется ацетилхолин. 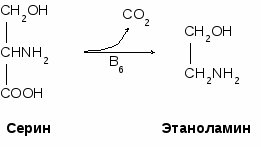 3. При декарбоксилировании цистеина образуется меркаптоэтиламин, который входит в состав КоА. Меркаптоэтиламин является радиопротектором. 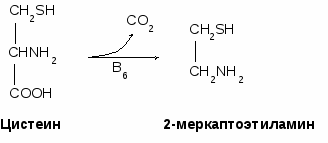 4. Таурин образуется при декарбоксилировании цистеиновой кислоты и входит в состав таурохолевой кислоты (желчная кислота) и является нейрорегулятором. 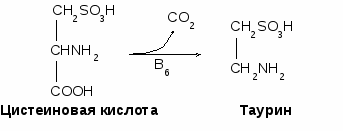 5. При декарбоксилировании гистидина образуется гистамин, который: а) через Н2-рецепторы усиливает секрецию НСl в желудке, б) через Н1-рецепторы снижает артериальное давление в результате расширения мелких сосудов и увеличения их проницаемости, в) участвует в аллергических и анафилактических реакциях. 6. При декарбоксилировании глутаминовой кислоты образуется гамма-аминомасляная кислота, которая тормозит эффекты ацетилхолина. 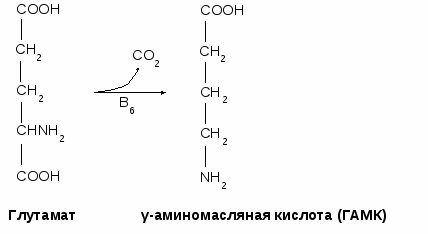 1.5. Дезаминирование аминокислотДезаминирование аминокислот - это процесс отщепления от аминокислоты аминогруппы. Различают несколько типов дезаминирования: окислительное, внутримолекулярное, восстановительное и гидролитическое. В организме человека имеет место окислительное дезаминирование. Для большинства аминокислот (кроме глутамата) оно протекает непрямо, вначале происходит переаминирование с образованием глутаминовой кислоты, которая, на втором этапе, подвергается окислительному дезаминированию. Для треонина и лизина дезаминирование происходит другим путем. 1.6. Переаминирование (трансаминирование) аминокислотЭтот процесс был открыт Браунштейном и Крицман в 1937 г. Реакция катализируется аминотрансферазами, в состав которых входит витамин В6. В переаминировании участвуют аминокислота и кетокислота (чаще 2-оксоглутарат, реже - пируват и оксалоацетат). В результате реакции образуются новая аминокислота и новая кетокислота. 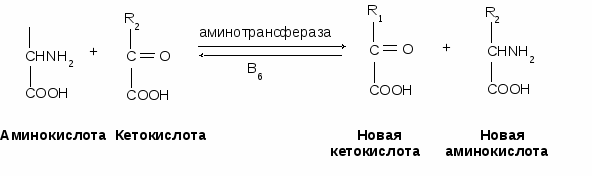 Значение реакции переаминирования1. Коллекторная функция, то есть аминогруппы от многих аминокислот собираются в одной форме в виде глутамата; 2. Является источником заменимых аминокислот; 3. В ходе этой реакции аминокислоты превращаются в кетокислоты, которые могут окисляться в цикле Кребса, использоваться в ГНГ или превращаться в кетоновые тела. Аминокислоты, которые в ходе метаболизма превращаются в углеводы, называются гликогенными. Таких аминокислот 15. Аминокислоты, которые в ходе своего метаболизма превращаются в кетоновые тела, называются кетогенными. Такой аминокислотой является лейцин. Аминокислоты, которые в ходе метаболизма дают углеводы и кетоновые тела, называются смешанными. Такими аминокислотами являются фенилаланин, тирозин, триптофан, лизин. 4. Аминотрансферазы - это универсальные ферменты, которые имеются в каждой клетке. В крови их очень мало. Увеличение активности аминотрансфераз свидетельствует о разрушении тех клеток, где они находились. Этот факт используется для диагностики некоторых заболеваний. Так, при инфаркте миокарда в крови увеличивается активность аспартатаминотрансферазы, а при вирусном гепатите или циррозе печени увеличивается активность аланинаминотрансферазы. Аминотрансферазы активируются катехоламинами, глюкокортикостерои-дами, большими дозами йодтиронинов. 1.7. Окислительное дезаминирование глутаминовой кислоты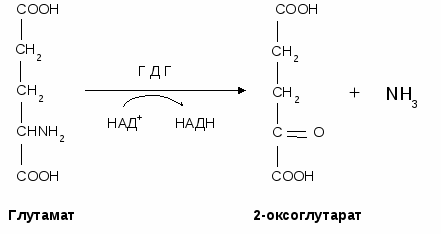 Происходит в митохондриях под влиянием глутаматдегидрогеназы (ГДГ). ГДГ является высокоактивным ферментом, ее тормозит АТФ, активирует АДФ. Продуктами глутаматдегидрогеназной реакции являются 2-оксоглутарат, NH3 и НАДН. 2-оксоглутарат окисляется в цикле Кребса, НАДН - в дыхательной цепи с выделением 3 АТФ, аммиак обезвреживается. ГДГ-реакция имеет энергетическое значение. Она особенно важна в головном мозге, так как в аварийных ситуациях поставляет энергию: например, при гипогликемии. 1.8. Восстановительное аминированиеВосстановительное аминирование - это реакция присоединения аммиака к 2-оксоглутарату с последующим восстановлением образующегося продукта. Донором водорода в этой реакции является НАДФН. Реакцию катализирует глутаматдегидрогеназа. Значение восстановительного аминирования:- является источником заменимых аминокислот; - служит одним из способов связывания аммиака в клетке. 1.9. Непрямое дезаминирование аминокислотНепрямое дезаминирование состоит из двух стадий:
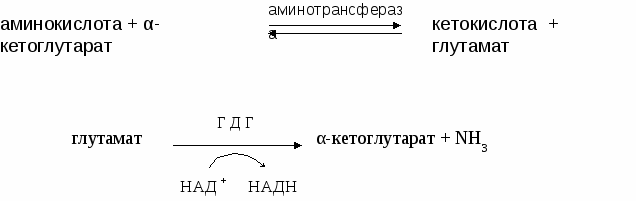
В ходе этого процесса аминокислоты теряют аминогруппы, превращаясь в кетокислоты, которые могут окисляться в цикле Кребса или использоваться в синтезе углеводов и жиров. Продукты; кетокислота, аммиак, НАДН. 1.10. Источники аммиака и пути его обезвреживанияАммиак образуется в результате реакций дезаминирования аминокис-лот, биогенных аминов (гистамина, серотонина, катехоламинов и др.), пуриновых и пиримидиновых азотистых оснований, амидов аминокислот в тканях организма. Часть аммиака образуется в кишечнике в результате деятельности микрофлоры (гниение белков) и всасывается в кровь воротной вены. Содержание аммиака в крови в норме 25-40 мкмоль/л. Причины токсичности аммиака1. Аммиак сдвигает реакцию, катализируемую глутаматдегидрогеназой, в сторону образования глутамата. В результате снижается концентрация -кетоглутарата, что вызывает угнетение обмена аминокислот (переаминирова-ние) и гипоэнергетическое состояние (угнетение цикла Кребса). 2. Аммиак усиливает синтез глутамина из глутамата в нервной ткани. Снижение концентрации глутамата нарушает обмен нейромедиаторов, в частности синтез -аминомасляной кислоты – основного тормозного модуля-тора. Это нарушает проведение нервного импульса и вызывает судороги. 3. Аммиак в крови и цитозоле образует ион NH4+, накопление которого нарушает трансмембранный перенос ионов, в частности Na+ и К+, что также влияет на проведение нервного импульса. 4. Накопление аммиака может сдвигать рН в щелочную сторону, вызывая метаболический алкалоз. Токсичный аммиак в клетках обезвреживается несколькими путями:- используется на восстановительное аминирование (этот процесс имеет небольшое значение); - используется на образование амидов (аспарагина и глутамина), которые поступают в кровь и переносятся в печень и почки, где под действием глутаминазы и аспарагиназы соответственно расщепляются до глутамата или аспартата и аммиака. В печени аммиак используется на образование карбамоилфосфата, из почек аммиак выводится в виде аммонийных солей с мочой.  В мышцах аммиак используется на образование аланина, который выводится в кровь и переносится в печень, где после переаминирования превращается в пируват, используемый в ГНГ для синтеза глюкозы. Образовавшаяся глюкоза поступает в кровь и переносится в мышцы, где превращается в пируват в ходе гликолиза. Обмен метаболитами (аланином и глюкозой) между печенью и мышцей называется глюкозо-аланиновым циклом. Синтез мочевины (орнитиновый цикл)Синтез мочевины протекает в гепатоцитах печени, является процессом циклическим. Для синтеза одной молекулы мочевины требуется 3 молекулы АТФ, 1 молекула аммиака, 1 молекула аспартата, 1 молекула СО2, 1 молекула орнитина. Ход реакций смотрите в лекциях или в учебнике. Орнитиновый цикл тесно связан с циклом Кребса: а) цикл Кребса поставляет синтезу мочевины СО2 и АТФ. б) фумарат, образованный в орнитиновом цикле, поступает в цикл Кребса, превращаясь в оксалоацетат. Оксалоацетат путем переаминирования превращается в аспартат, который опять может использоваться в синтезе мочевины. В результате орнитинового цикла очень токсичный аммиак превращается в безвредную мочевину - главный конечный продукт азотистого обмена млекопитающих. Мочевина из печени выделяется в кровь и переносится к почкам, где выделяется с мочой. Синтез мочевины усиливают катехоламины и глюкокортикостероиды. Определение активности аргиназы и орнитинкарбамоилфосфат-трансферазы в сыворотке крови используется для диагностики патологий печени. 1.11. Обмен ароматических аминокислотЙодтиронины  фениналанин тирозин ДОФА меланин фенилпируват гидроксифенил- катехоламины пируват фениллактат гомогентизиновая кислота фумарат ацетоацетат Патология обмена ароматических аминокислот1. Фенилкетонурия или пировиноградная олигофрения (слабоумие). Причины: отсутствует ген, отвечающий за синтез фенилаланингидроксилазы. В отсутствие этого фермента фенилаланин переаминируется с образованием фенилпирувата и далее фениллактата. При этом не хватает тирозина, из которого образуются катехоламины и йодтиронины, а также пигмент меланин. У больных снижается устойчивость к стрессу, падает артериальное давление, появляются признаки умственной отсталости. В крови накапливаются фенилаланин, фениллактат и фенилпируват, которые в больших концентрациях являются токсичными, особенно для головного мозга ребенка, необратимо повреждая его. Поэтому требуется ранняя диагностика этого заболевания, которая проводится следующим образом: к моче ребенка добавляют хлорное железо; зеленое окрашивание свидетельствует о наличии патологии. В этом случае больного ребенка переводят на диету, обедненную фенилаланином, но богатую тирозином. 2. Алкаптонурия возникает при отсутствии гомогентизинатоксидазы. В этом случае нарушается окисление гомогентизиновой кислоты в тканях, повышается ее содержание в жидкостях организма и моче. В присутствии кислорода гомогентизиновая кислота полимеризуется с образованием алкаптона (пигмента черного цвета). Поэтому моча таких больных на воздухе темнеет. Алкаптон может откладываться в коже, сухожилиях, хрящах носа, ушей и суставов. При значительных отложениях пигмента в суставах нарушается их подвижность. 3. Альбинизм возникает при отсутствии тирозиназы, которая участвует в превращении ДОФА в ДОФА-хинон и далее в меланин. В результате у людей возникает слабая пигментация кожи, волос, красноватый цвет радужной оболочки глаз. 1.12. Синтез креатинаКреатин - это небелковое азотсодержащее соединение, в образовании которого участвуют печень и почки. Процесс начинается в почках, где из глицина и аргинина образуются гликоциамин (гуанидиноацетат) и орнитин. Орнитин используется в синтезе мочевины. Гликоциамин поступает в кровь и переносится в печень, где он метилируется при участии S-аденозилметионина, превращаясь в креатин, который поступает в мышцы. Когда мышца находится в состоянии покоя, креатин под действием креатинкиназы и при участии АТФ превращается в креатинфосфат - запасной макроэрг. При мышечном сокращении фосфат с креатинфосфата переносится под действием креатинкиназы на АДФ с образованием АТФ. Конечным продуктом обмена креатина является креатинин, одновременное определение которого в крови и моче проводят для расчета клиренса, показывающего очистительную способность почек. Определение активности креатинкиназы в сыворотке крови используют для диагностики инфаркта миокарда. Принцип метода. Метод основан на фотометрическом определении динитрофенилгидразонов пирувата, образующегося в результате ферментативной реакции под действием АлАТ. При действии АсАТ образуется оксалоацетат, переходящий в пируват самопроизвольно. Концентрация динитрофенилгидразонов пирувата служит мерой активности обоих ферментов. Норма активности АлАТ – 0,1-0,7 мкмоль/мл за 1 час, АсАТ – 0,1-0,5 мкмоль/мл за 1 час. Диагностическое значение определения активности аминотрансфераз Повышение активности аминотрансфераз в сыворотке отмечается при поражении органов и тканей, богатых данными ферментами. При инфаркте миокарда наблюдается повышение активности АсАТ (в 2-20 раз). Увеличение активности начинается через 6-12 часов и возвращается к исходному уровню через 4-5 дней. При стенокардии активность АсАТ, как правило, остается в норме. При заболеваниях печени в первую очередь и наиболее значительно по сравнению с АсАТ изменяется активность АлАТ. При инфекционном гепатите максимум повышения отмечается на 6-10 день заболевания и постепенно возвращается к норме к 15-20 дню. Повышение активности АлАТ отмечается и при безжелтушной форме болезни Боткина. Механические желтухи, холангиты и ряд других заболеваний печени обычно не сопровождаются значительным повышением активности АсАТ и АлАТ и их соотношения (коэффициент де Ритиса). В норме этот коэффициент = 1,330,42. При паренхиматозных заболеваниях печени происходит снижение коэффициента, а при остром инфаркте миокарда он резко возрастает. б) Ситуационные задачи
а) каково происхождение гомогентизиновой кислоты; б) содержится ли гомогентизиновая кислота в моче здоровых людей; в) что такое "алкаптонурия"?
|
