биохимия. Значение изучаемой темы
 Скачать 1.04 Mb. Скачать 1.04 Mb.
|
Тема № 2. Ферменты. Биохимическая диагностика острого панкреатита: определение активности амилазы в сыворотке крови и моче. Значение изучаемой темы: Ферменты являются основой всей биохимии, так как в организме человека ими катализируются практически все реакции. Многие заболевания являются результатом изменения активности ферментов или их полного отсутствия. Кроме того, используемые лекарства действуют путем влияния на активность ферментов. Поэтому знание данной темы является непременным условием успешного обучения не только по биохимии, но и по другим дисциплинам в дальнейшем. 1.1. Отличия ферментов от неорганических катализаторов. Активный центр ферментовФерменты – это биологические катализаторы белковой природы. Простые ферменты состоят только из аминокислот, а сложные – из двух частей: белковой (апофермент) и небелковой (кофактор). Если кофактор прочно связан с апоферментом, он называется простетической группой, если непрочно – коферментом. В отличие от неорганических катализаторов, ферменты:
Участок фермента, в котором происходит специфическое связывание субстрата и его превращение в продукт, называется активным центром. Активный центр простых ферментов состоит из аминокислот, у сложных ферментов, кроме аминокислот, в состав активного центра входит кофактор. По теории Фишера субстрат подходит к ферменту, как ключ к замку, то есть между конформацией активного центра и конформацией субстрата существует абсолютное пространственное соответствие. Согласно теории Кошланда, активный центр фермента формируется окончательно при взаимодействии его с субстратом, то есть субстрат меняет активный центр в соответствии со своей формой в момент контакта с ферментом. 1.2. Механизм действия ферментовСкорость химической реакции определяется энергией активации (Эакт) - чем меньше энергия активации, тем легче (скорее) протекает реакция.  В присутствии фермента (Е) реакция (S Р) делится на несколько стадий: В присутствии фермента (Е) реакция (S Р) делится на несколько стадий: 1 2    S + E ES E + P S + E ES E + P Вначале фермент взаимодействует с субстратом (S) с образованием фермент-субстратного комплекса (ЕS). Энергия этой стадии невелика, и комплекс образуется быстро. На второй стадии происходит образование продукта (Р). Поскольку энергия ES-комплекса уже достаточно высока, то Эакт2 второй стадии будет опять невелика и переходное состояние ES достигается быстро. Таким образом, в присутствии фермента реакция делится на несколько стадий, каждая из которых имеет низкую энергию активации и поэтому протекает быстро. Этот механизм обеспечивается следующими факторами:
1.3. Свойства ферментовБелковая природа ферментов определяет уникальные свойства этих катализаторов:
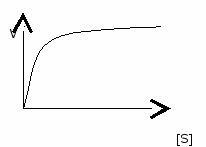
При насыщающих концентрациях субстрата зависимость прямая. 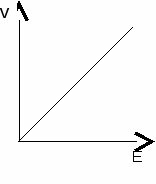 1.4. Определение активности ферментаАктивность ферментов определяют: - по скорости убывания субстрата; - по скорости образования продукта. За единицу любого фермента принимают такое его количество, которое катализирует превращение 1 мкмоль вещества в 1 минуту. мкмоль У мин х мг белка дельная активность = ----------------------- . 1.5. ИзоферментыЭто разновидности ферментов, катализирующие одну реакцию, но отличающиеся по своему составу и физико-химическим свойствам. Изоферменты имеются у ферментов с четвертичной структурой. Изоферменты различаются по кинетическим параметрам (Vмакс и КМ), тканевой локализации, электрофоретической подвижности, чувствительности к регуляторам и т.д. В зависимости от возраста, физиологического состояния и других причин, в организме устанавливается определенное соотношение изофер-ментов, которому соответствует определенный уровень активности фермента в целом. Изменение их соотношения в отдельных тканях или органах является одним из способов регуляции метаболических процессов в организме. Определение активности определенных изоферментов в сыворотке крови используется для диагностики. 1.6. Регуляция активности ферментовВещества, изменяющие активность ферментов, называются эффекторами или регуляторами. Эффекторы, снижающие активность ферментов, называются ингибиторами, повышающие активность – активаторами. Механизмы изменения активности ферментов
Аллостерический центр – это участок фермента, пространственно не совпадающий с активным центром. Присоединение регулятора к аллостерическому центру приводит к изменению конформации фермента, а, следовательно, и активного центра. Сродство фермента при этом изменяется. Аллостерические регуляторы вызывают активацию или ингибирование фермента. Аллостерическими регуляторами являются метаболиты, макроэрги, коферменты, катионы металлов, цАМФ, субстраты.
Отщепление регулятора возвращает активность фермента в исходное состояние. Частным случаем химической модификации является ограниченный протеолиз. Ограниченный протеолиз – это процесс отщепления какой-либо части фермента в виде олиго - или полипептида. В результате изменяется химическая структура фермента и формируется активный центр. Активность фермента возрастает.
Ингибирование ферментов Ингибирование ферментов бывает обратимым и необратимым. Необратимые ингибиторы прочно связываются с ферментами, при этом связываются или разрушаются функциональные группы, необходимые для проявления каталитической активности. Необратимые ингибиторы не имеют физиологического значения и являются ферментными ядами. Обратимыеингибиторы действуют недолго. Комплекс "фермент-ингибитор" непрочен и быстро диссоциирует, активность фермента при этом восстанавливается. Обратимые ингибиторы делятся на конкурентные и неконкурентные. Конкурентный ингибиторпохож на субстрат по структуре и форме, поэтому может конкурировать с ним за место в активном центре. Степень ингибирования зависит от концентрации субстрата и ингибитора. Чем больше концентрация ингибитора, тем сильнее ингибирование. Неконкурентныеингибиторы структурно не похожи на субстрат, поэтому действуют вне активного центра путем аллостерического механизма или путем химической модификации. 1.7. Регуляция ферментативных цепейРегуляция в ферментативных цепях направлена на ключевые ферменты, которые катализируют, как правило, необратимые реакции. К ключевым ферментам относятся: а) фермент, стоящий в начале цепи; б) лимитирующий фермент (имеет наименьшую скорость в цепи); в) ферменты, стоящие на развилке цепи. 1.8. Классификация ферментов
1.9. Использование ферментов в медицине
Энзимодиагностика: а) применение ферментов для определения различных веществ в биологических жидкостях; б) измерение активности ферментов или изоферментов в крови и моче для диагностики болезней, сопровождающихся разрушением клеток.
а) при нарушении пищеварения; б) для очистки гнойных ран (трипсин, химотрипсин); в) для лечения вирусных заболеваний (ДНК-аза, РНК-аза); г) при тромбозах и тромбоэмболиях (фибринолизин, стрепто-лиаза, стрептодеказа, урокиназа); д) для рассасывания контрактур рубцов после ожогов и операций (гиалуронидаза). Норма активности амилазы в сыворотке – 16-30 г/л в час 2. Определение активности - амилазы в моче Норма активности амилазы в моче – 28-160 г/л в час Диагностическое значение определения амилазы Повышение активности амилазы (гиперамилаземия) наблюдается при остром панкреатите. В первые 12 – 24 часа активность амилазы в крови повышается в 10-40 раз, затем быстро снижается и приходит к норме на 2-6 сутки. При этом активность фермента повышается также в моче (в 10-40 раз) и остается высокой до 7 суток. Гиперамилаземия наблюдается также при остром аппендиците, перитоните, перфоративной язве желудка и двенадцати-перстной кишки. Гипоамилаземия чаще всего свидетельствует о недостаточности экзокринной функции поджелудочной железы. Также встречается у больных гепатитами, циррозами, злокачественными опухолями с метастазами в печень, обширными ожогами кожи, сахарным диабетом, гипотиреозом, при интоксикациях. Отношение активности амилазы в крови к активности амилазы в моче служит показателем функциональной полноценности почечного фильтра. б) Ситуационные задачи
а) снижает энергию активации; б) ускоряет прямую и обратную реакции; в) обладает высокой специфичностью; г) ускоряет момент движения равновесия, не сдвигая его; д) прекращает каталитическое действие после добавления в раствор вещества, разрушающего пептидные связи. Какое из этих свойств служит прямым доказательством белковой природы катализатора?
а) уменьшается скорость превращения субстрата в активном центре; б) изменяется конформация фермента; в) эффектор присоединяется в активном центре; г) изменяется конформация аллостерического центра; д) нарушается комплементарность активного центра субстрату; е) эффектор присоединяется в аллостерическом центре; ж) изменяется конформация активного центра.
а) что такое ферменты? б) механизмы ингибирования ферментов. Виды ингибирования. Какой из них можно использовать для лечения болезней? |