Шпоры по физхимии. 1 Энергия, теплота, работа. Первый зн термодинамики. Внутренняя энергия и энтальпия фи состояния системы
 Скачать 1.31 Mb. Скачать 1.31 Mb.
|
   1.1.Энергия, теплота, работа. Первый з-н термодинамики. Внутренняя энергия и энтальпия – ф-и состояния системы. 1.1.Энергия, теплота, работа. Первый з-н термодинамики. Внутренняя энергия и энтальпия – ф-и состояния системы.Неотъемлемым свойством материи я-ся движение; оно неуничтожимо, как сама материя. Движение материи проявляется в разных формах, кот. могут переходить одна в др. Мерой движения материи является энергия. Закон сохранения и превращения энергии: энергия не создается и не разрушается, она переходит из одного вида в другой в эквивалентных количествах Формы перехода движения (энергии) м. б. разбиты на 2 группы 1. переход движения путем хаотического столкновения молекул 2х соприк. тел, т.е. путем теплопроводности (и путем излучения). Мерой передаваемого т.о. движения я-ся теплота. 2.перемещение масс, охватывающих большое число молекул (т.е. макроскопических), под действием к-л сил. Общей мерой передаваемого т. о. движения я-ся работа. Т.о., Q и A характеризуют качественно и количественно две разл. формы передачи движения от одной части материального мира к другой. I з-н термодинамики это з-н сохр. энергии в применении к Q и A: Q = A + U Q, сообщаемое системе, расходуется на совершение системой работы и приращение U системы. Для б/м превращений: Q = A + dU Формулировки: -Невозможно построить период. действующую тепловую машину, создающую A без соответ. затраты Q из окр. среды. -Если в к-л процессе энергия одного вида исчезает, то взамен п-ся энергия другого вида в эквивалентных количествах. -Полный запас энергии изолированной системы постоянен: в неизолированной системе энергия может изменяться за счет: а) совершения работы над окружающей средой; б) теплообмена с окружающей средой. «U» - совокупность кинетической и потенциальной энергии молекул, атомов, составных частей атомов и лучистой энергии, поддерж тепловое равновесие м/у частями системы.. «U» является однозначной, непрерывной и конечной ф-ей состояния системы; «U» системы, находящейся в данном состоянии, имеет одно опр-ое значение и не зависит от того, каким изменениям система подвергалась перед этим; разность «U» системы в 2x ее состояниях не зависит от пути перехода системы из исходного состояния в конечное, а только от исх. и конечного состояний. 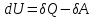 . Если процесс круговой, то U2 = U1 и Q = A. . Если процесс круговой, то U2 = U1 и Q = A.В изолированной системе: Q = 0 и А = 0, т.е. при любых процессах, протекающих в изолированной системе, U = 0, U = const: U изолированной системы постоянна. 1. 2. Осмос. Вывод уравнения осмотического давления. Равновесие осущ-ся при равенстве Т и p во всех частях всех фаз, составляющих систему, и при постоянстве состава во всех участках одной фазы. При наличии разностей хим. потенциалов компонентов м/у участками одной фазы или между разными фазами эти компоненты диффундируют в направлении падения своего хим. потенциала до тех пор, пока не будет достигнут одинаковый состав во всех участках внутри каждой фазы и равновесное распределение компонентов м/у фазами. Необходимым условием достижения такого равновесия является возможность свободного перехода всех компонентов из одного участка каждой фазы в другой участок и из одной фазы в другую. Иная ситуация наблюдается, когда отдельные части системы разделены перегородками, кот. непроницаемы для одних компонентов (пр.: растворенное в-во) и проницаемы для других (пр.: растворитель). Расм. рисунок. Сосуд 1 содержит водный раствор какого-либо вещества; закрыт внизу полупроницаемой перегородкой. Сосуд 1 помещен в сосуд 2 с водой. Вода будет проходить из сосуда 2 в сосуд 1. Такой самопроизвольный переход воды (или р-ля) через полупроницаемую перегородку в раствор наз. осмосом. Сила (на единицу площади), заставляющая р-тель переходить через полупроницаемую перегородку в раствор (находящийся при том же внешнем р, что и р-ль), наз. осмотическим давлением. Уровень р-ра в сосуде 1 повышается, создавая допол-ное давление, которое препятствует осмосу. При высоте h столба жидкости в сосуде 1 допол-ное Р достигает такой величины, при j осмос прекращается, т. е. устанавливается равновесие м/у р-ом данной концентрации и чистым р-ем, разделёнными полупроницаемой перегородкой. Впервые осмотическое давление () измерил Пфефер (1877) Для р-ов с с 0,3 моль/л V = 22,6 латм/моль (для идеальных газов рV = 22,4; V – объем, заключающий 1 2 1 моль растворенного вещества); при более высоких к-циях V растет. Зависимость от Т: Т. Рассмотренные закономерности осмотического P разбавленных р-ов охватываются уравнением Вант-Гоффа : = cRT, (с – молярная концентрация; 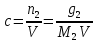 ) )Т.о., разбавленных растворов численно равно тому P, J производило бы то же число молекул растворенного вещества, если бы оно в виде ид. газа занимало при данной Т объем, равный объему р-ра. 2. 1. Простейшие термодинамические процессы, происходящие в идеальном газе. ИЗОХОРНЫЙ ПРОЦЕСС (V = const) Q = A + dU ; A = PdV = 0 (т.к. dV = 0 ) ; QV = dU ; QV = U Изменение U в изохорном процессе равно количеству выделяемой или поглощаемой Q: все тепло, подводимое к системе, идет на увеличение ее U, и наоборот, если тепло выделяется, то это происходит за счет уменьшения U. Теплоемкость: Q, поглощаемая при нагревании 1 г или 1 моля в-ва (т.е. удельная с или мольная С тепл-сть) на Т градусов в тех или иных условиях (V = const, P = const или др. условия). Различают среднюю и истинную тепл-ть. Средние: 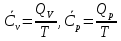 , Истинные: , Истинные: 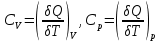 Для изохорного процесса: 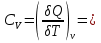 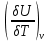 ;dU = CV dT;U = CV T. Изменение U ид. газа пропорц. изменению T. ;dU = CV dT;U = CV T. Изменение U ид. газа пропорц. изменению T.ИЗОБАРНЫЙ ПРОЦЕСС (P = const) QP = A + dU = pdV + dU; A = p (V2 V1) = p V = nRТ; QP = U + p V; Qp = QV + p V; Qp QV = p V Разность теплот изобарного и изохорного процессов равна A изобарного расширения или сжатия. Qp = QV + PdV Продифференцируем это выражение по Т: 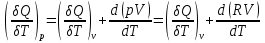 ; (т.к. PV = RT для 1 моля ид. газа). CP CV = R уравнение Майера ; (т.к. PV = RT для 1 моля ид. газа). CP CV = R уравнение МайераИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС (T = const) dU = Cv dT = 0. Внутренняя энергия ид. газа в изотермическом процессе остается без изменения. pV = RT = const для изотермы ; A = pdV; 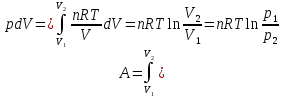 dU = 0 , U = 0 , Q = A. Закон Гей-Люссака–Джоуля: Внутренняя энергия ид. газа не зависит от P и V, а зависит только от T. 2.2.Уравнение изотермы хим. реакции. Станд. изобарный потенциал реакции, его значение и связь с константой равновесия. Комбинирование равновесий. Станд. Величины ∆ fG(Ai, 298) и их применение. 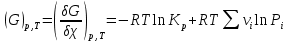 Это уравнение изотермы хим. p-ии. Здесь G изменение изобарного потенциала системы при хим. превращении такого числа молей реагирующих в-в, кот. соотв. стех-ому уравнению р-ии. G -изобарный потенциал реакции. Если исходные парциальные P всех участников р-ии Pi = 1, то Gо = RT ln KP Gо стандартный изобарный потенциал реакции. (F)V,T= RT ln KC+RTiln Сi; F- изохорный потенциал химической реакции или свободная энергия. Если исходные концентрации Сi = 1, то Fо= RT ln KC,Fо стандартный изохорный потенциал реакции. (G)P,T = (F)V,T , т.к. каждая из обеих величин равна ii . Константа КР и Gо однозначно связаны уравнением. Обе величины я-ся характеристиками равновесия : зная одну из них при какой-либо Т, можно предвидеть направление, в кот. пойдет р-ия, и количественно вычислить выход продуктов р-ий в ид. системах. Порядок и знак величины Gо позволяют качественно предвидеть положение равновесия р-ии. Большая положительная величина Gо означает, что конечные продукты имеют гораздо больший потенциал, чем исходные в-ва, и равновесное состояние близко к исходным в-вам, т.е. сдвинуто влево; выход продукта мал; КР 1. Если Gо большая отрицательная величина, то равновесие сдвинуто вправо, выход продукта велик, КР 1.. Основная практическая ценность изобарных потенциалов реакции связана с возможностью комбинирования равновесий и расчета констант равновесия и теорет. выходов продукта для реакций, j не изучались экспериментально, а нередко и не могли быть изучены непосредственно. Т.к. G ф-я состояния системы, то G не зависит от пути процесса. => Изобарный потенциал для р-ии, совершающейся в несколько стадий, равен сумме величин G для каждой стадии, и если одно из значений G неизвестно, то оно может быть рассчитано. Для такого расчета, анал-го расчетам теплот р-ий по з-ну Гесса, необходимо, чтобы конечные продукты одной р-ии (1-я стадия суммарной р-ии) находились в том же состоянии, в каком они я-ся исходными в-вами другой р-ии (2-я стадия). Это и достигается путем использования станд. изобарных потенциалов р-ии Gо. При вычислении этих потенциалов принимают, что каждый из компонентов р-ии находится при Р = 1 атм, твердые и жидкие в-ва являются чистыми фазами, а газообразные в-ва ид. газами при парциальном давлении Рi = 1. 3. 1. Термохимия. Теплоты химических реакций. Закон Гесса. Стандартные теплоты образования и сгорания. Изменение U в процессе хим. превращения в-ва происходит, как и в др. случаях, путем поглощения (выделения) Q и совершения A. A обычно мала. Q реакции часто значительна; она м. б. во многих случаях непосредственно измерена. Изучением теплот хим. р-ий занимается термохимия. Кол-во Q, необходимое для разложения соединения на его составные части, равно кол-ву Q, выделяющейся при образовании соединения из тех же составных частей. Изменение U при хим. р-ии, не зависит от пути, по кот. протекает р-ия, а лишь от хим. природы и состояния начальных и конечных в-в р-ии. Q р-ии в общем случае не является изменением ф-ии состояния и зависит от пути процесса. Однако по крайней мере в двух простейших случаях Q процесса не зависит от его пути:
З-н Гесса 1836 (з-н постоянства сумм теплот р-ий): если из данных исх. в-в можно получить заданные конечные продукты разными путями, то суммарная Q процесса на к-л одном пути = суммарной Q процесса на любом другом пути, т.е. не зависит от пути перехода от исх. в-в к продуктам р-ии. З-н Гесса вытекает из I ЗТ при ограничивающих условиях: V = const или P = const. В т/д: Q 0 кот. подводится к системе и ею поглощается, Q 0 j система выделяет; в т/х: Q 0 кот. выделяется (экзотермическая р-ия), Q 0 j поглощается (эндотермическая р-ия). QP, QV т/д обозначения; 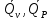 т/х. т/х. QP= 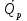 , QV= , QV=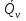 ; QP=Ho298 , QV=Uo298 . ; QP=Ho298 , QV=Uo298 .В обоих случаях: А 0, если производится системой; А 0, если внешние силы совершают работу над системой. Расширение 0 , сжатие 0. Значение з-на Гесса заключается в том, что, пользуясь им, можно определить Q реакций, кот. или не реализуются на практике, или не м. б. проведены чисто и до конца. СТАНДАРТНЫЕ ТЕПЛОТЫ ОБРАЗОВАНИЯ И СГОРАНИЯ. З-н Гесса дает возм-ть рассчитать Q множества р-ий по миним. числу Q некоторых р-ий. Стандартная теплота образования (Ноf, 298) это тепловой эффект р-ии образования 1 моля в-ва из простых в-в, взятых в их обычном соотношении и при станд. условиях Р = 1 атм, Т = 298 К. Следствие из з-на Гесса: тепловой эффект хим. реакции = сумме стандартных теплот образования продуктов р-ии за вычетом суммы стандартных теплот образования исходных в-в. аA+bB=cC+dD; (Но298)x=c(Ноf,298)C+d(Ноf, 298)Da(Ноf, 298)Ab(Ноf, 298)B (Но298)x = n(Ноf, 298)конеч.в-в n(Ноf, 298)нач.в-в 3.2. Криоскопия. Эбуллиоскопия. КРИОСКОПИЯ (Понижение темп-ры зам. р-ров). Р-р не затвердевает целиком при одной Т. Кристаллы начинают выделяться при одной Т; по мере понижения Т кол-во кристаллов растет и, наконец, р-р отвердевает. Затвердевание р-ра происходит в интервале Т. Т начала кристаллизации (т.е. та Т, при кот. начинается образов. кристаллов) – это не что иное, как Т, при кот. этот р-р становится насыщенным относительно твердого р-ля. При этой Т р-р и тв. р-ль находятся в равновесии и давления насыщенного пара р-ля над р-ом и над тв. р-ем д. б. равны. Т.к. P пара р-ля над р-ом всегда меньше, чем над чистым р-ем при той же Т, то р-р будет затвердевать при более низкой Т, чем р-ль. Это видно из рис.: ВС – показывает зависимость P насыщ. пара чистого твердого р-ля от Т; AD–зав-сть P насыщ. Пара чистого жидкого р-ля от Т; AD, AD – P пара р-ля над р-ми нелетучего в-ва с конц. N N. Точки пересечения этих кривых (С, С, С) – это Т начала затвердевания чистого жидкого р-ля (То) и р-ов (Т1, Т2 …).Понижение Т начала затверд-ния становится более значительным по мере увел. конц-ю р-ра. Найдем количественную зависимость м/у понижением Т начала затвердевания р-ра и его конц.. Ур-ие для ид. растворимости тв. в-в (N – конц. растворенного в-ва): 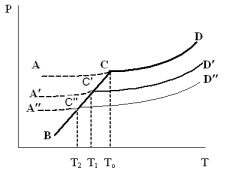 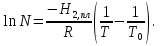 Подставим конц. р-ля N1 = 1 – N; Подставим конц. р-ля N1 = 1 – N;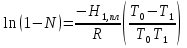 ; ; 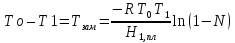 Т.к. величина N достаточно мала, можно разложить lnв ряд и ограничиться 1ым членом разложения: 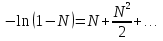 Т.к. Т мала, то То Т1 То2. Тогда Т.к. Т мала, то То Т1 То2. Тогда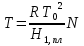 .В разбавленных р-рах .В разбавленных р-рах 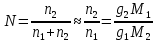 (g1 и g2 – их весовые кол-ва в р-ре). Положим g1 = 1000 г, тогда g2/М2 = m – моляльность р-ра. Получим: (g1 и g2 – их весовые кол-ва в р-ре). Положим g1 = 1000 г, тогда g2/М2 = m – моляльность р-ра. Получим: 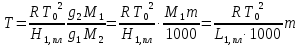 L1, пл. = Н1, пл. /М1 – удельная Q плавления р-ля. Тзам = Кm |
