Аминокислоты и белки. Пептид содержит (тут есть 2
 Скачать 1.55 Mb. Скачать 1.55 Mb.
|
|
Раздел 1. Аминокислоты и белки. Пептид содержит: (тут есть 2 варианта) 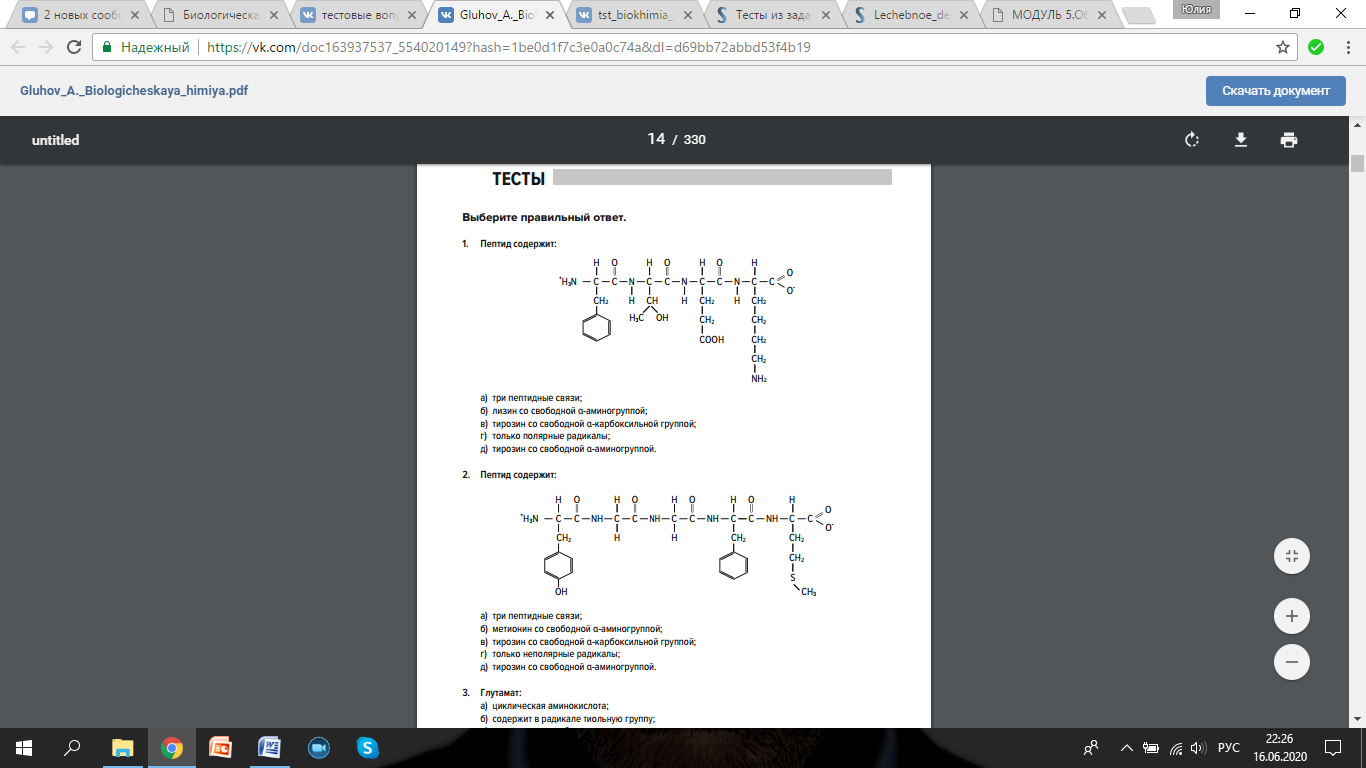 А) 3 пептидные  Д) тирозин со свободной альфа-аминогр 3. Глутамат: Г) аминокислота с анионным радикалом 4. Радикал глутамина содержит: Г) амидную группу 5. Метионин: Б) Содержит атом серы 6. Пептид, содержащий только гидрофильные незаряженные аминокислоты: В) Тир-Асн-Тре-Цис 7. Пептид, содержащий только гидрофобные радикалы аминокислот: Б) Иле-Лей-Три-Ала 8. Пептид содержащий на N-конце аминокислоту с гуанидиновой группой: А) Арг-Глн-Про-Сер 9. Пептид, содержащий на С-конце аминокислоту с амидной группой: В) Арг-Иле-Тре-Асн 10. Пептид «Лиз-Сер-Глу-Глн»: Г) не перемещается в электрическом поле при pH 7 11. Первичная структура белка: В) закодирована в молекуле ДНК 12. Первичная структура белка образуется за счет связей: Б) пептидных 13. В белках между а-амино- и а-карбоксильной группами аминокислот могут возникать связи: В) пептидные 14. Вторичная структура белка: В) пространственная укладка пептидного остова 15. В образовании вторичной структуры белка участвуют связи: Б) водородные 16. Формирование третичной структуры белков начинается с образования связей: А) гидрофобных 17. В третичной структуре экспортируемых белков встречаются связи, не характерные для внутриклеточных белков: Д) дисульфидне 18. Водородные связи могут образоваться между радикалами аминокислот: А) Цис-Глн 19. Гидрофобные взаимодействия могут возникать между радикалами аминокислот Б) Вал-Про 20. Ионные связи могут образовываться между радикалами аминокислот: Д) Асп-Гис 21. Сложные белки: Д) имеют небелковую часть 22. Миоглобин: А) сложный белок 23. Атропин: Б) спазмолитик 24. Дитилин: В) агонист Н-холинрецептора 25. Ацетилхолин и атропин: Г) лиганды М-холинорецепторов 26. Гемоглобин А: Г) сложный белок 27. НвS в отличииот НвА: В) в дезоксиформе плохо растворим в воде 28. Электрофорез на бумаге делит белки по ранице в: Б) зарядах 29. Метод, используемый для отделения низкомолекулярных веществ от белков: Г) диализ 30. Метод разделения белков по молекулярной массе: Д) гель-фильтрация 31. Метод присоединения специфического белка к иммобилизированному лиганду: А) аффинная хроматография 32. Изоэлектрическая точка белков: В) значение рН при котором белок имеет заряд равный нулю 33. Иммуноглобулины: Д) делятся на пять основных классов отличающихся по строении. Константных доменов 34. Иммуноглобулины G: Г) биваленты 35. Глутамин: А) аминокислота с гидрофильным радикалом Д) имеет в радикале амидную группу 36.Аргинин: Б)содержит гуанидиновую группу В)радикал имеет положительный заряд Д) образует ионы связи с Асп 37. Белки: А)полипептиды Б) имеют первичную структуру закодированную в ДНК Д) функционируют при взаимодействии со специфическим лигандом 38. Пептидеые связи в белке: Б) прочные Г) участвуют в формировании первичной структуры белка Д) разрушаются протеолитическими ферментами 39. первичная структура белков: а) линейная последовательность аминокислот; б) закодирована в ДНК; г) определяет конформацию; Вторичная структура белков: а) один из уровней конформации; б) пространственная укладка пептидного остова; в) может содержать а-спиралии Р-структуры; г) разрушается денатурирующими агентами; Третичная структура цитозольных глобулярных белков: а) формируется за счет слабых межрадикальных связей; в) обладает функциональной активностью; д) зависит от первичной структуры белка В формировании третичной структуры белка участвуют связи: б) водородные; в) дисульфидные; г) ионные; д) гидрофобные. Нативный белок всегда имеет: б) функционально активную конформацию; в) способность к небольшим конформационным изменениям; д) активный центр, специфично взаимодействующий с лигандом. Межрадикальные связи участвуют в формировании структуры белка: в) третичной; г) четвертичной; д) супервторичной. Конформационная лабильность белка: а) способность к изменению конформации; б) зависит от типа связей, участвующих в формировании конформации; г) определяет условия хранения белковых препаратов; д) позволяет белку взаимодействовать с группой похожих лигандов. К слабым связям, участвующим в формировании конформации, относят: в) водородные; г) ионные; д) гидрофобные. Конформация белка зависит от: а) первичной структуры; в) pH среды; г) состава среды; д) типа присоединяемых лигандов. Конформация белка включает структуры: б) вторичную; в) супервторичную; г) третичную; д) четвертичную. Активный центр белка б) имеет рельефную поверхность; в) избирательно взаимодействует с разными лигандами; д) определяет его функцию. Активный центр белка: а) формируется на уровне третичной структуры; в) комплементарен лиганду; д) разрушается при денатурации. Комплементарность белка лиганду: а) лежит в основе их взаимодействия; в) включает пространственное соответствие взаимодействующих молекул; г) включает химическое соответствие взаимодействующих поверхностей; Комплементарность белка лиганду: а) зависит от конформации белка; в) лежит в основе специфичности выбора лиганда; д) определяет специфическую функцию белка. Инсулин: б) имеет две полипептидные цепи; в) в молекуле имеет три дисульфидные связи; Денатурация белков характеризуется: а) разрушением конформации; в) потерей активности; д) склонностью к агрегации белков. Молекулы денатурированных белков одного типа имеют: а) одинаковую первичную структуру; в) случайную конформацию; г) хорошую доступность для действия протеаз; К факторам, вызывающим денатурацию белков, относят: а) высокую температуру; б) соли тяжелых металлов; г) спирты; Дитилин: а) лекарственный препарат; г) структурный аналог ацетилхолина; Атропин: б) структурный аналог ацетилхолина; г) снимает спазм гладких мышц; Атропин и дитилин: а) лиганды холинорецепторов; г) структурные аналоги ацетилхолина; д) комплементарно взаимодействуют с рецептором. Ацетилхолин и атропин: а) лиганды холинорецепторов; в) специфично взаимодействуют с рецепторами; Миоглобин: а) сложный белок; в) имеет 8 а-спиралей, которые формируют вторичную структуру; Миоглобин: б) мономерный белок; в) гемопротеин; Гемоглобин: а) сложный белок; г) связывает четыре молекулы кислорода; д) содержит простетическую группу. Гемоглобин: б) конформационно лабилен; г) сложный белок; д) имеет четвертичную структуру. Активный центр протомеров гемоглобина: а) содержит преимущественно радикалы гидрофобных аминокислот; б) имеет два функционально важных остатка Гис; г) связывает одну молекулу кислорода; д) содержит железо в составе гема, способное связываться с О2. Входеприсоединениякислорода к активному центру протомеров гемоглобина происходит: б) изменение конформации Нв; г) связывание кислорода с железом гема; Сродство Нв к кислороду уменьшается при: а) увеличении концентрации протонов; б) уменьшении концентрации протонов; в) сниженииконцентрации2,3-БФГ; г) увеличении концентрации 2,3-БФГ; д) последовательном отщеплении молекул кислорода. Гистидин Е7 протомеров гемоглобина: а) входит в состав активного центра; г) участвует в связывании О2 с железом гема; д) препятствует окислению железа гема. Гистидин F8 протомеров гемоглобина: б) связывает железо гема с белковой частью; д) участвует в изменении конформации белка при оксигенировании. 2,3-БФГ: а) синтезируется в эритроцитах; г) аллостерический лиганд Нв; 2,3-БФГ а) промежуточный продукт окисления глюкозы г) взаимодействует сНв в центральной полости; д) имеет сродство к дезоксигемоглобину. Миоглобин и гемоглобин: а) сложные белки; б) гемопротеины; в) взаимодействуютсО2; . Для освобождения белка от примеси солей используют методы: б) гель-фильтрации; г) диализа; Для разделения белков по молекулярной массе используют методы а) ультрацентрифугирования б)гель-фильтрации; в)электрофореза в полиакриламидном геле; . Разделение белков с помощью электрофореза в полиакриламидном геле б) заряде; в) молекулярной массе; Шапероны: а) делятся на группы по молекулярной массе; б)участвуют в поддержании нативной конформации внутриклеточных белков; г)необходимы для формирования нативной конформации высокомолекулярных Раздел 2 1. Ферменты — белковые катализаторы: г) узнают свой субстрат при наличии множества других соединений; 2. Абсолютная субстратная специфичность фермента: в) способность присоединять в активном центре один субстрат; 3. Ферменты, обладающие относительной субстратной специфичностью: в) катализируют один тип реакции с более чем одним структурно подобным субстратом; 4. Гексокиназа в отличие от глюкокиназы: д) имеет более низкое значение Км 5. Эта структура является компонентом кофермента: 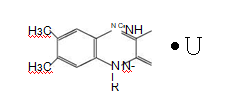 в) FAD; 6. . Эта структура является компонентом кофермента: 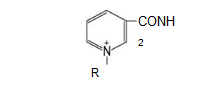 а) NAD+; 7. Эта структура является компонентом кофермента: 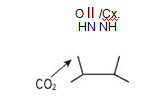 г) биотина; 8. Эта структура является компонентом кофермента: 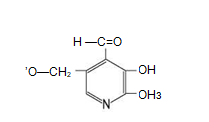 д) пиридоксальфосфата. 9. На конечной стадии ферментативного катализа: д) продукты выходят из области активного центра. 10. Киназы катализируют превращения: б) перенос фосфатной группы от молекулы донора к акцептору; 11. Протеинфосфатазы в отличие от протеинкиназ: в) катализируют реакцию: Белок — ОРО3Н2 + Н2О Белок —ОН + Н3РО4; 12. Утверждение, правильно характеризующее удельную активность ферментов: д) количество единиц активности фермента в 1 мг белка. 13. Протекание этой реакции нарушается при недостатке витамина: 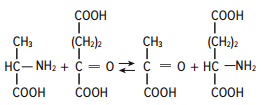 в) В6 14. Протекание этой реакции нарушается при недостатке витамина: 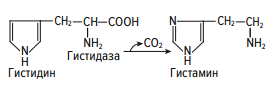 в) В6; 15. Протекание этой реакции нарушается при недостатке витамина: 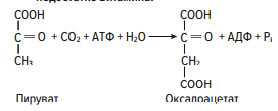 д) биотина. 16. Класс фермента, катализирующего реакцию превращения аминокислоты глутамата в у-аминомасляную кислоту (тормозной медиатор ЦНС): 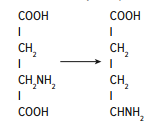 г) лиаза; 17. Класс фермента, катализирующего реакцию превращения сукцината в фумарат: 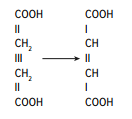 а) оксидоредуктаза; 18. Класс фермента, ускоряющего в печени реакцию превращения этанола в токсичный метаболит — ацетальдегид:. а) оксидоредуктаза; 19. Класс фермента, катализирующего реакцию превращения жира: 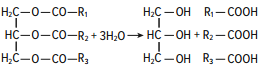 г) гидролаза; 20. Класс фермента, катализирующего реакцию активации глюкозы: Глюкоза +АТФ Глюкозо-6-фосфат + АДФ б) трансфераза; 21. Класс фермента, катализирующего реакцию протеолиза: 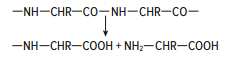 г) гидролаза; 22. Класс фермента, катализирующего реакцию метаболического пути распада глюкозы: 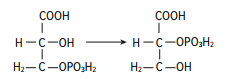 в) изомераза; 23. Класс фермента, катализирующего реакцию, осуществляющую запасание энергии в клетках: Креатин + АТФ Креатинфосфат + АДФ б) трансфераза; 24. Класс фермента, катализирующего реакцию, важную для завершения проведения сигнала ацетилхолина в нервно-мышечных синапсах: 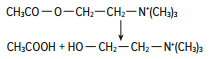 г) гидролаза; 25. Класс фермента, катализирующего конечную реакцию распада глюкозы в клетках при гипоксии: 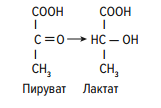 а) оксидоредуктаза; 26. Кофермент биотин участвует в реакциях, катализируемых: г) карбоксилазами; Кофермент тиаминдифосфат участвует в реакциях, катализируемых: д) декарбоксилазами. Кофермент FAD участвует в реакциях, катализируемых: д) дегидрогеназами. Конкурентные ингибиторы: б) являются структурными аналогами субстрата; Необратимые ингибиторы: г) уменьшают Утах; Аспирин — ингибитор циклооксигеназы. По механизму действия это лекарство является: б) необратимым ингибитором; Лекарственный препарат прозерин: д) является обратимым ингибитором ацетилхолинэстеразы. Сульфаниламидные препараты по структуре являются аналогами: г) парааминобензойной кислоты; Лекарства — ингибиторы ферментов: в) уменьшают активность фермента; Диизопропилфторфосфат: г) специфический необратимый ингибитор сериновых ферментов; Трасилол: г) лекарство, которое используется для лечения панкреатита; Фермент, активируемый частичным протеолизом: б) пепсин; Трипсин активируется в результате: а) изменения первичной структуры; Необратимая активация ферментов происходит при: д) протеолитическом отщеплении фрагмента фермента. Активация аллостерических ферментов происходит в результате: в) кооперативных изменений конформации субъединиц, вызванных присоединением эффектора; Характерной особенностью аллостерических ферментов является: а) олигомерноестроение; Аллостерические ферменты: б) имеют каталитический и регуляторный центры, локализованные на разных протомерах; Протеинкиназы: а) относятся к класс утрансфераз; Концентрация цАМФ в клетке: в) увеличивается при действии на клетку кофеина; Фермент аденилатциклаза: в) катализирует образованиец АМФ; цАМФ: д) регуляторный лиганд протеинкиназы А. По механизму белок-белковых взаимодействий активируется фермент: б) аденилатциклаза; Ферменты используются в клиникодиагностических лабораториях: б) в качестве аналитического реактива; Фермент аспарагиназа используется в медицине для: в) лечения лейкозов; Для диагностики рака предстательной железы в крови определяют активность фермента: д) кислой фосфатазы. Фермент гиалуронидаза используется в медицине для: в) рассасывания рубцов; Фермент пепсин используется в медицине для: а) улучшения пищеварения; Фермент а-амилаза используется в энзимодиагностике заболевания: б) поджелудочной железы; В первые сутки после инфаркта миокарда в крови больных больше всего возрастает активность фермента: а) креатинкиназы; Ферменты, так же как и небиологические катализаторы: а) ускоряют энергетически возможные реакции; в) не расходуются в процессе реакции; г) не изменяют направление реакции; Ферменты в отличие от небиологических катализаторов: б) действуют в клетке при мягких физиологических условиях; в) способны к регуляции; г) обладают высокой эффективностью действия; д) высокоспецифичны. Активный центр фермента: а) формируется на уровне третичной структуры; б) специфично связывает субстрат; д) катализирует химическое превращение субстрата. Аллостерический центр фермента: б) присоединяет лиганд комплементарно; в) печени; г) мозга Ферменты, обладающие абсолютной субстратной специфичностью: б) имеют конформацию активного центра, способную к небольшим изменениям; в) катализируют превращение только одного единственного субстрата; Ферменты, обладающие групповой субстратной специфичностью: б) катализируют однитипреакциис несколькими сходными субстратами; г) имеют«гибкую» конформацию активного центра; Сериновые протеазы: а) ускоряют гидролиз пептидных связей в белках; г) представлены ферментами (трипсином, химотрипсином, эластазой); д) проявляют групповую специфичность к субстрату. Константа Михаэлиса (Км): а) параметр, характеризующий кинетику ферментативных реакций; б) может иметь разное значение для изоферментов; в) концентрация субстрата, при которой достигается половина Vmax ферментативной реакции; Холоферменты: а) являются сложными ферментами; б) содержат кофакторы; в) обладают специфичностью, которая определяется белковой частью; д) комплементарно связывают как субстрат, так и кофермент. Кофермент: а) небелковая часть молекулы холофермента; в) производное витамина; г) компонент активного центра фермента; д) участник катализа. Кофермент пиридоксальфосфат участвует в реакциях: в) трансаминирования; д) декарбоксилирования. Фермент лактат дегидрогеназа: а) является холоферментом; г) относится к классу оксидоредуктаз; д) содержит в своем составе никотиновый кофермент. Фермент, катализирующий реакцию: 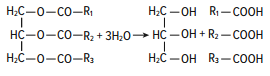 б) относится к классу гидролаз; г) использует кофермент NAD+; д) обладает групповой субстратной специфичностью. В процессе ферментативного катализа происходит: а) установление индуцированного соответствия между субстратом и активным центром фермента; в) изменение конформации фермента; г) образование фермент-субстратного комплекса; д) дестабилизация связей в молекуле субстрата. При образовании фермент-субстратного комплекса: а) изменяется конформация субстрата; б) образуются нековалентные связи между субстратом и ферментом; в) изменяется пространственное расположение функциональных групп, участвующих в катализе; д) усиливается комплементарность между ферментом и субстратом. При изменении pH среды в молекуле фермента происходит: а) изменение степени ионизации групп фермента; б) разрыв одних и образование других слабых связей; г) изменение конформации молекулы фермента; д) изменение активности фермента. В состав активного центра дегидрогеназ могут входить коферменты: в) NAD+; д) FAD. Фермент, катализирующий реакцию: 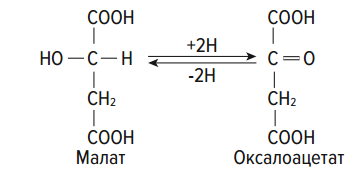 б) относится к классу оксидоредуктаз; г) является холоферментом; д) обладает абсолютной субстратной специфичностью. Фермент, катализирующий реакцию: 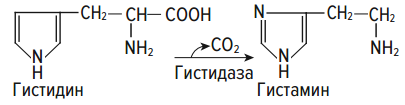 а) относится к классулиаз; г) является холоферментом; д) обладает абсолютной субстратной специфичностью. Ингибиторы могут снижать активность ферментов вследствие: а) взаимодействия ингибитора с функциональными группами аминокислот активного центра; б) взаимодействия ингибитора с функциональными группами аминокислот вне активного центра; г) нарушения нативной конформации фермента; Аспирин используют в качестве лекарственного препарата, так как он: б) вызывает ацетилирование ОН-группы серина фермента циклооксигеназы; в) необратимо ингибирует активность фермента; г) блокирует активный центр циклооксигеназы; Лекарственные вещества как ингибиторы ферментов являются: а) обратимыми ингибиторами; б) необратимыми ингибиторами; г) конкурентными ингибиторами; д) неконкурентными ингибиторами. Прозерин: б) структурный аналог ацетилхолина; д) конкурентный ингибитор ацетилхолинэстеразы. Ингибиторы ацетилхолинэстеразы, используемые для лечения миастений, являются: а) структурными аналогами ацетилхолина; б) конкурентными ингибиторами; г) обратимыми ингибиторами; Конкурентные ингибиторы ферментов изменяют: а) активность фермента; б) Км реакции; Сульфаниламидные препараты: б) относятся к антиметаболитам; в) являются структурными аналогами парааминобензойной кислоты; д) снижают количество фолиевой кислоты в бактериях. Лекарственный препарат трасилол: а) конкурентный ингибитор трипсина; б) используется для лечения панкреатитов; г) полипептид; Диизопропилфторфосфат: а) специфический ингибитор сериновых ферментов; г) необратимый ингибитор ацетилхолинэстеразы; д) входит в группу фосфорорганических соединений. Активность ферментов в клетке регулируется с участием следующих механизмов: б) частичного протеолиза; в) фосфорилирования/ дефосфорилирования; г) аллостерической регуляции; д) белок-белкового взаимодействия. Аллостерические ферменты, как правило: б) являются олигомерными белками; г) имеют активные и аллостерические центры, расположенные в разных протомерах; Регуляция активности ферментов с помощью частичного протеолиза включает: а) изменение первичной структуры фермента; б) изменение вторичной и третичной структур фермента; в) уменьшение молекулярной массы фермента; д) формирование активного центра. Регуляция активности ферментов с помощью белок-белковых взаимодействий сопровождается: б) присоединением или отщеплением регуляторных белковых субъединиц; в) присоединением или отщеплением белков-регуляторов; г) изменением конформации фермента; Белок-белковыми взаимодействиями регулируется активность: б) протеинкиназы А; г) аденилатциклазы; Аллостерические ферменты катализируют реакции: а) скорость-лимитирующие; б) расположенные в начале метаболического пути; г) необратимые; д) находящиеся в месте разветвления метаболического пути. Изменение активности ферментов по механизму фосфорилирования- дефосфорилирования катализируют ферменты: б) фосфопротеинфосфатаза; г) протеинкиназа; Изменение активности ферментов в клетке путем фосфорилирования: а) зависит от концентрации ряда гормонов в крови; б) происходит с участием АТФ; г) может вызвать активацию фосфопротеинфосфатаз; д) является обратимым для клетки процессом. Активация ферментов в клетке путем фосфорилирования: а) является ответом клетки на изменение концентрации ряда гормонов в крови; в) происходит с участием АТФ; Регулировать активность ферментов в клетке в условиях поддержания гомеостаза можно: а) с помощью аллостерического лиганда; б) путем фосфорилирования- дефосфорилирования; в) изменением концентрации субстрата; г) с помощью внутриклеточных ингибиторов; Фермент протеинкиназа А: а) снижает активность при недостатке АТФ; в) уменьшает активность при участии фосфодиэстеразы; г) имеет активную форму в виде олигомерного белка R2C2; Фермент креатинкиназа: б) существует в виде трех изоферментов; в) используется для диагностики инфаркта миокарда; Фермент аспарагиназа: а) уменьшает концентрацию аспарагина в сыворотке крови; г) снижает синтез белков в лейкозных клетках; Фермент лактатдегидрогеназа: а) является олигомерным белком; б) используется для диагностики инфаркта миокарда; д) относится к классу оксидоредуктаз. Использование ферментов в медицине возможно: а) в качестве лекарственных препаратов; б) для диагностики заболеваний; д) в качестве аналитических реактивов. Введение аспарагиназы в кровь больных лейкозом: а) изменяет концентрацию аспарагина в крови; д) применяется для уменьшения скорости пролиферации лейкозных клеток. Использование протеолитических ферментов в медицине возможно: в) для очистки ран; д) в качестве заместительной терапии при нарушении пищеварения. 100.Определение активности ферментов в крови используется для: б) постановки диагноза «инфаркт миокарда»; в) контроля эффективности лечения ряда заболеваний; д) диагностики воспалительных заболеваний печени. Для энзимодиагностики инфаркта миокарда используют ферменты: б) лактатдегидрогеназу; г) креатинкиназу; д) аминотрансферазы. Принципы энзимодиагностики: а) низкая активность или полное отсутствие внутриклеточных ферментов в крови в норме; б) выход ферментов в кровь при повреждении тканей; г) преобладание определенных изоферментов в разных тканях; д) органоспецифичность ферментов. Наследственные энзимопатии связаны с такими изменениями первичной структуры ферментов, при которых может произойти: а) нарушение сродства активного центра к субстрату; б) уменьшение количества нужного для клетки продукта; в) изменение концентрации метаболитов в клетке; д) уменьшение активности фермента. Нуклеазы как лекарства используются в медицине для: а) инактивации ДНК-содержащих вирусов; в) лечения вирусных конъюнктивитов; |
