1. Атеросклероз. Распространенность и основные клинические проявления в зависимости от локализации. Генетические и средовые факторы риска
 Скачать 3.2 Mb. Скачать 3.2 Mb.
|
|
Хирургические способы лечения Внутриаортальная баллонная контрпульсация (механическое нагнетание крови в аорту при помощи раздуваемого баллона во время диастолы, что способствует увеличению кровотока в венечных артериях). Проводят при наличии соответствующего оборудования и неэффективности лекарственного лечения кардиогенного шока. Чрескожная транслюминальная коронарная ангиопластика — восстановление проходимости венечных артерий с её помощью в первые 4-8 ч от начала инфаркта не только сохраняет миокард, но и прерывает порочный круг патогенетических механизмов кардиогенного шока. Наблюдение При кардиогенном шоке рекомендуется постоянный контроль АД, ЧСС, диуреза (постоянный мочевой катетер), давления заклинивания лёгочных капилляров (баллонный катетер в лёгочной артерии), а также контроль сердечного выброса с помощью ЭхоКГ или методом радионуклидной ангиографии. Прогноз: Смертность при кардиогенном шоке составляет 81-95 %. 12. Хроническая сердечная недостаточность: определение, этиология, клиника, современные классификации. Хроническая сердечная недостаточность (ХСН) – патофизиологический синдром, при котором в результате того или иного заболевания сердечно- сосудистой системы происходит снижение насосной функции, что приводит к дисбалансу между гемодинамической потребностью организма и возможностями сердца. Этиология ХСН Провоцирующие факторы: • Инфекции • Анемия • Тиреотоксикоз и беременность • Аритмии • Ревматизм и миокардиты • Инфекционный эндокардит • Артериальная гипертония • ИБС и острый инфаркт миокарда • Тромбоэмболия лёгочной артерии (ТЭЛА) • Физическая, психоэмоциональная, пищевая, водная и иные нагрузки Все причины, приводящие к ХСН можно подразделить на 4 группы: 1. Причины, оказывающие прямое повреждающее воздействие на миокард с развитием «миокардиальной» формы ХСН: • Первичные – миокардиты, дилатационная кардиомиопатия. • Вторичные – диффузный и постинфарктный кардиосклероз, поражение сердца при диффузных заболеваниях соединительной ткани, токсические поражения сердца и эндокринно-обменные заболевания. 2. Причины, вызывающие функциональную перегрузку сердца с развитием «перегрузочной» формы ХСН: • Перегрузка сопротивлением (систолическая перегрузка ЛЖ) – стенозы митрального, трикуспидального клапанов, устья аорты и легочной артерии, артериальная гипертензия. • Перегрузка объемом (диастолическая перегрузка ЛЖ) – недостаточность клапанов сердца, внутрисердечные шунты, гиперволемия, полицитемия. • Комбинированная перегрузка. 3. Причины, вызывающие нарушение диастолического наполнения сердца – гипертрофические кардиомиопатии, варианты «гипертонического сердца», слипчивый перикардит, значительный гидроперикард, рестриктивные кардиомиопатии. 4. Заболевания с высоким сердечным выбросом – тиреотоксикоз, значительная анемия, выраженное ожирение.   КЛИНИКА • Одышка (98.4%) и быстрая утомляемость (94,3%) • Сердцебиение (80.4%) • Отеки (73%) • Кашель (46%) • Ортопноз (28%). 13. Хроническая сердечная недостаточность: механизмы патогенеза, ремоделирование сердца. Направления и средства лечения.  Лечение ХСН Цели при лечении ХСН: • Предотвращение развития симптомной ХСН (для I стадии ХСН); • Устранение симптомов ХСН; • Замедление прогрессирования болезни путем защиты органов- мишеней (мозг, сердце, почки, сосуды); • Улучшение качества жизни больных ХСН; • Уменьшение госпитализаций (и расходов, что немаловажно с экономической точки зрения); • Улучшение прогноза. Пути достижения поставленных целей при лечении ХСН: • Диета; • Режим физической активности; • Психологическая реабилитация, организация врачебного контроля, школ для больных с ХСН; • Медикаментозная терапия; • Электрофизиологические методы терапии; • Хирургические, механические методы лечения. Немедикаментозное лечение ХСН Диета больных с ХСН На сегодняшний день рекомендации по диете больных с ХСН носят весьма конкретный характер. Основные позиции заключаются в следующем: 1. При ХСН рекомендуется ограничение приема поваренной соли, причем тем больше, чем выраженнее симптомы болезни и застойные явления. I функциональный класс (ФК) – не употреблять соленой пищи (до 3 г NaCl в день); II ФК – плюс не досаливать пищу (до 1,5 г NaCl в день); III ФК – плюс продукты с уменьшенным содержанием соли и приготовление без соли (< 1,0 г NaCl в день). 2. Ограничение потребления жидкости актуально только в крайних ситуациях: при декомпенсированном тяжелом течении ХСН, требующем в/в введения диуретиков. В обычных ситуациях объем жидкости не рекомендуется увеличивать более 2 л/сутки (максимум приема жидкости – 1,5 л/сутки). 3. Пища должна быть калорийная, легко усваиваемая, с достаточным содержанием белка, витаминов. 4. У пациентов с ишемическим генезом ХСН употребление до 20 мл этанола в сутки может способствовать улучшению прогноза. Для всех остальных больных с ХСН ограничение приема алкоголя имеет вид обычных рекомендаций, хотя по возможности следует ограничивать применение больших объемов (например, пива). Прирост веса > 2 кг за 1-3 дня, скорее всего, свидетельствует о задержке жидкости в организме и риске развития декомпенсации! Режим физической активности Покой не показан любым больным с ХСН вне зависимости от стадии процесса. Физическая реабилитация рекомендуется всем пациентам с I-IV ФК ХСН, единственным требованием можно считать стабильное течение декомпенсации, когда нет необходимости в экстренном приеме мочегонных и внутривенном введении вазодилататоров и положительных инотропных средств. Физическая реабилитация противопоказана при: • активном миокардите; • стенозе клапанных отверстий; • цианотических врожденных пороках; • нарушениях ритма высоких градаций; • приступах стенокардии у пациентов с низкой фракцией выброса левого желудочка. Принципы медикаментозного лечения ХСН В последние годы в России принято подразделять все лекарственные средства на 3 категории в зависимости от степени доказанности их действенности. Итак, препараты для лечения ХСН делят на основные, дополнительные и вспомогательные. 1. Основные – это лекарства, эффект которых доказан, сомнений не вызывает и которые рекомендованы именно для лечения СН (степень доказанности А): • Ингибиторы ангиотензинпревращающего фермента (иАПФ), которые показаны всем больным с ХСН, вне зависимости от этиологии, стадии процесса и типа декомпенсации. • Антагонисты рецепторов к ангиотензину II могут применяться не только в случаях непереносимости иАПФ, но и наряду с последними в качестве средства блокады РААС у больных с недостаточной клинической эффективностью иАПФ. • β-адреноблокаторы – нейрогормональные модуляторы, применяемые «сверху», дополнительно к ИАПФ. • Антагонисты рецепторов к альдостерону (альдактон), применяемые вместе с ИАПФ и БАБ у больных с выраженной ХСН. • Диуретики – показаны всем больным при клинических симптомах ХСН, связанных с избыточной задержкой натрия и воды в организме. • Сердечные гликозиды – в малых дозах. При мерцательной аритмии они остаются средством «первой линии», а при синусовом ритме и ишемической этиологии ХСН их применение требует осторожности и контроля. • Этиловые эфиры полиненасыщенных жирных кислот (эйкозопентанаиковой и доксозогексаноиковой) [Омакор]. 4 из 7 классов основных препаратов для лечения ХСН - иАПФ, β-АБ, антагонисты альдостерона и АРА - относятся к нейрогормональным модуляторам. Необходимо упомянуть, что сердечные гликозиды обладают нейромодуляторными свойствами и один из петлевых диуретиков – торасемид также способен влиять на компоненты РААС. 2. Дополнительные средства, эффективность и (или) безопасность которых показана в отдельных крупных исследованиях, но требует уточнения (степень доказанности В): • статины, рекомендуемые к применению у всех больных с ишемической этиологий ХСН; кроме того, обладающие способностью предотвращать развитие ХСН у больных с разными формами ИБС. • непрямые антикоагулянты, показанные к использованию у большинства больных ХСН, протекающей на фоне мерцательной аритмии, а также у пациентов с ХСН и синусовым ритмом. 3. Вспомогательные средства, эффект и влияние которых на прогноз больных ХСН не известны (не доказаны). Этими препаратами не нужно (да и невозможно) лечить саму ХСН, и их применение диктуется определенными клиническими ситуациями, осложняющими течение собственно декомпенсации: • периферические вазодилататоры (ПВД)* = нитраты, применяемые только при сопутствующей стенокардии; • блокаторы медленных кальциевых каналов (БМКК) – длительнодействующие дигидропиридины при упорной стенокардии и стойкой АГ, плохо корригируемой легочной гипертензии и выраженной клапанной регургитации; • антиаритмические средства (кроме β-АБ, входящих в число основных препаратов, в основном III класса) при опасных для жизни желудочковых аритмиях; • аспирин (и другие антиагреганты) для вторичной профилактики после перенесенного ИМ; • негликозидные инотропные стимуляторы - при обострении ХСН, протекающей с низким сердечным выбросом и упорной гипотонией. 14. Артериальная гипертония: основные факторы этиологии и патогенеза, роль наследственности. Гены – «кандидаты». Под термином “артериальная гипертензия” подразумевают синдром повышения АД при “гипертонической болезни” и “симптоматических артериальных гипертензиях”. Термин “гипертоническая болезнь” (ГБ), предложенный Г.Ф. Лангом в 1948г, соответствует употребляемому в других странах понятию “эссенциальная гипертензия”. Под ГБ принято понимать хронически протекающее заболевание, основным проявлением которого является АГ, не связанная с наличием патологических процессов, при которых повышение АД обусловлено известными, в современных условиях часто устраняемыми, причинами (симптоматические АГ). В силу того, что ГБ – гетерогенное заболевание, имеющее довольно отчетливые клинико-патогенетические варианты с существенно различающимися на начальных этапах механизмами развития, в научной литературе вместо термина “гипертоническая болезнь” часто используется понятие “артериальная гипертензия”. Этиология АГ – мультифакториальное заболевание. Приблизительная схема участия наследственных и средовых факторов в формировании артериальной гипертонии представлена в рис. 3.1.  Патогенез и клиника Повышение артериального давления (АД) обусловлено нарушением факторов, регулирующих деятельность сердечнососудистой системы. Первичным считается фактор наследственной предрасположенности. По концепции Ю. В. Постнова он заключается в распространенных нарушениях ионтранспортной функции и структуры цитоплазматической мембраны клеток. В этих условиях сохранность специфической функции клеток обеспечивается механизмом клеточной адаптации, связанным с регуляцией кальциевого обмена, с изменением гормональноклеточных взаимоотношений, с ростом активности нейрогуморальных систем (гипоталамогипофизарнонадпочечниковой, ренинангиотензинальдостероновой, инсулярной). Кальциевая перегрузка клетки увеличивает сократительный потенциал гладких мышц сосудов и активирует клеточные факторы роста (протоонкогены). Происходящая при этом гипертрофия и гиперплазия гладких мышц сосудов и сердца ведёт к реконструкции сердца (гипертрофия) и сосудов (повышенная сократимость, утолщение стенки и сужение просвета), которые, являясь адаптивными, одновременно поддерживают гипертензию. Повышенное АД ведёт к возрастанию левожелудочкового систолического давления, увеличению напряжения (и гипертрофии) желудочка, возрастанию степени повреждения миокарда свободнорадикальным окислением. Нарушения гемодинамики реализуются через патологию нейрогуморальных факторов в системе кратковременного действия (адаптационной) и в системе длительного действия (интегральной). Первые заключаются в извращении барорецепторных взаимоотношений в цепочке: крупные артерии, центры головного мозга, симпатические нервы, резистивные сосуды, ёмкостные сосуды, сердце, а также в активации почечного эндокринного контура, включающею ренинангиотензиновый механизм и резистивные сосуды. Нарушения в интегральной системе регуляции представлены избыточной секрецией альдостерона, задержкой натрия и воды, а также истощением депрессорных механизмов почек (простагландин Е2, калликреин, брадикинин), сосудов (простациклин, калликреинкининовая и дофаминэргическая сосудистая системы, эндотелиальный релаксирующий фактор - окись азота) и сердца (предсердный натрийуретический фактор). Важными патогенетическими факторами АГ признаны тканевая инсулинорезистентность, сопряжённая с усилением реабсорбции натрия, активности симпатической нервной системы, экспрессией протоонкогенов и ослаблением вазодилататорных стимулов, а также повышение плотности рецепторов сосудистого русла и миокарда и их чувствительности к адренергическим воздействиям под влиянием избыточной секреции кортизола и тиреоидных гормонов. Существенная роль принадлежит нарушениям биологического ритма нейроэндокринных систем и гормонов, обеспечивающих регуляцию ритмов сердечнососудистой системы. Обсуждается патогенетическая значимость снижения продукции половых гормонов и их защитного действия в отношении сосудистого русла, влияния на гемодинамику локальных нейрогуморальных систем (почечной, мозговой, сердечной, сосудистой), реконструкции сосудов и утилизации вазоактивных гормонов. Реконструкция сердца и сосудов, длительные периоды гипертензии приводят к нарушениям диастолической и систолической функции миокарда, а также церебральной, коронарной и периферической гемодинамики с формированием типичных осложнений артериальной гипертензии (инсульт, инфаркт, сердечная и почечная недостаточность). Спектр генов-кандидатов, принимающих участие в реализации артериальной гипертензии, достаточно широк и включает группы генов, контролирующих различные метаболические и гомеостатические системы, нарушения которых вовлечены в патогенез сердечно-сосудистых заболеваний. В частности, гены ренин-ангиотензиновой системы (ген ангиотензиногена, ген ренина, ген ангиотензинпревращающего фермента и др.); гены метаболизма липидов (ген аполипопротеина AI, ген аполипопротеина В; ген аполипопротеина Е, ген липопротеинлипазы и др.); гены, определяющие состояние эндотелия сосудов (ген эндотелиальной синтазы оксида азота, ген эндотелина и др.); гены, участвующие в тромбообразовании и формировании реологических свойств крови (ген тканевого активатора плазминогена, ген фактора свертываемости F13 и др.); ген метаболизма гомоцистеина (ген метилентетрагидрофолатредуктазы) [8]. В настоящее время наиболее изученным при АГ являются ген ангиотензиногена (АТГ), ген ренина, ген ангиотензинпревращающего фермента (АПФ), генрецептора ангиотензина-II типа 1 (АТР1). Ген АТГ был картирован в 1-й хромосоме в локусе 1q42 в той же области, что и ген ренина. Ген АПФ локализован на хромосоме 17q23. Наиболее изученным является I/D - полиморфизм этого гена, представляющий собой наличие или отсутствие в 16-ом интроне последовательности из 287 пар нуклеотидов. Аллель, содержащий такую последовательность, получил название I (insertion) аллель, не содержащий таковой - D (deletion). Этот полиморфизм не является структурным, но оказывает влияние на степень экспрессии гена. Человеческий ген рецептора АТР1 был клонирован и локализован на хромосоме 3q23. В настоящее время наиболее изученным при АГ является его А/С-полиморфизм в 3′-нетранслируемой области, представляющий собой замену в 1166 позиции аденина на цитозин. Таким образом, полиморфизм генотипов АТР1ограничивается следующими вариантами: АА, АС, СС [3]. 15. Артериальная гипертония: классификация, основные принципы лечения. Определение степени повышения АД. Классификация величины АД у лиц старше 18 лет представлена в таблице 3.1. Если значения систолического АД (САД) и диастолического АД (ДАД) попадают в разные категории, то степень тяжести АГ оценивается по более высокой категории. Наиболее точно степень АГ может быть определена только у пациентов с впервые диагностированной АГ и у больных, не принимающих АГП. Определение стадии АГ. В Российской Федерации по-прежнему актуально, особенно при формулировке диагностического заключения, использование 3-х стадийной классификации заболевания, также остается популярным и рекомендуемым ВНОК сам термин «гипертоническая болезнь». Гипертоническая болезнь 1 стадии предполагает отсутствие изменений в органах-мишенях (см. таблицу 3.2). Гипертоническая болезнь II стадии предполагает наличия одного и/или нескольких изменений со стороны органов-мишеней (см. таблицу 3.2). Гипертоническая болезнь III стадии устанавливается при наличии одного и/или нескольких ассоциированных (сопутствующих) состояний (см. таблицу 3.2). Установление III стадии болезни не отражает развития заболевания во времени и причинно-следственных взаимоотношений между АГ и имеющейся патологией сердца (в частности стенокардией). Наличие ассоциированных состояний позволяет отнести больного в более тяжелую группу риска и поэтому требует установления большей стадии заболевания, даже если изменения в данном органе не являются, по мнению врача, непосредственным осложнением ГБ. Факторы, влияющие на прогноз; оценка общего (суммарного) сердечно-сосудистого риска. Величина АД является важнейшим, но далеко не единственным, фактором, определяющим тяжесть АГ, ее прогноз и тактику лечения. Большое значение имеет оценка общего сердечно-сосудистого риска, степень которого зависит от величины АД, а также наличия или отсутствия сопутствующих ФР, поражения органов-мишеней (ПОМ) и ассоциированных клинических состояний (АКС). В зависимости от степени повышения АД, наличия ФР, ПОМ и АКС все больные АГ могут быть отнесены к одной из четырех групп риска (таблица 3.3): • низкого, • среднего, • высокого • и очень высокого дополнительного риска (таблицы 3.3 и 3.4). Термин “дополнительный риск” используется, чтобы подчеркнуть, что риск ССО и смерти от них у пациентов с АГ всегда больше, чем средний риск в популяции. 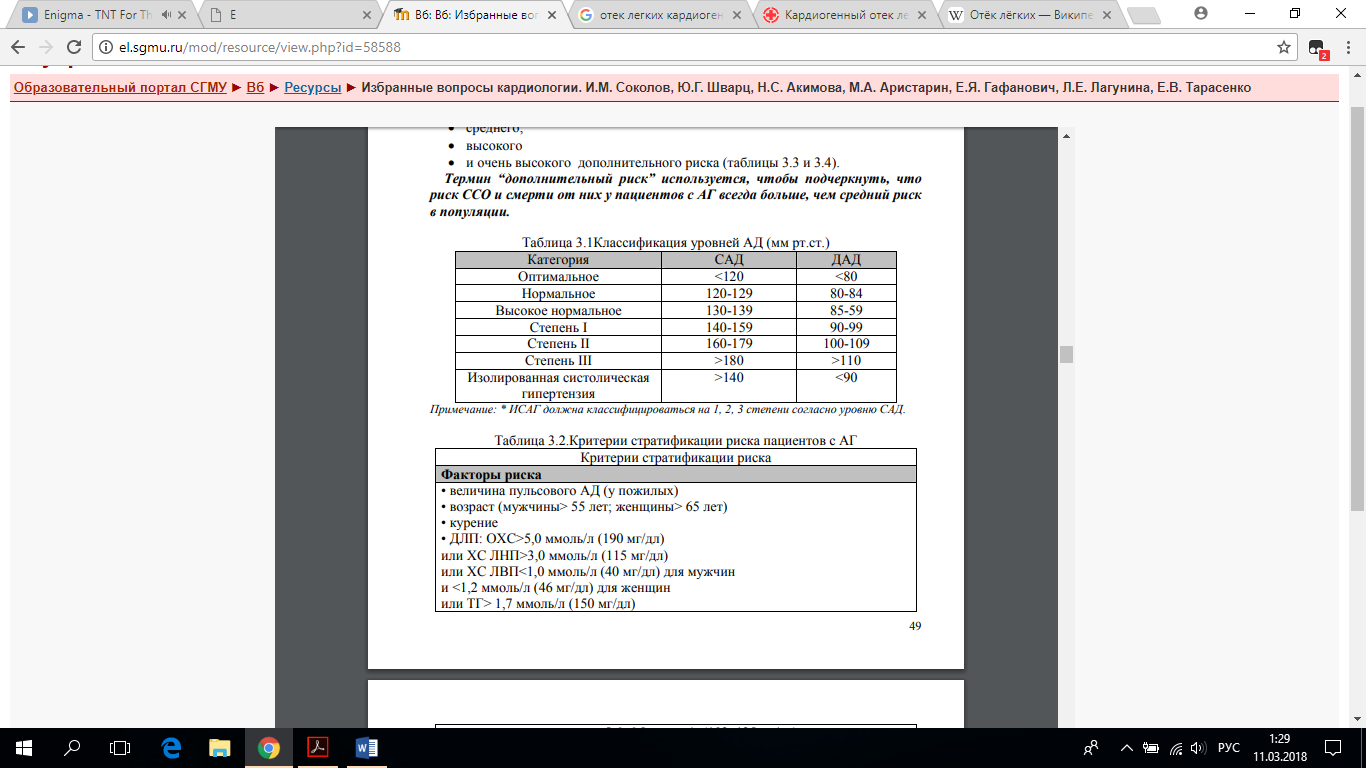    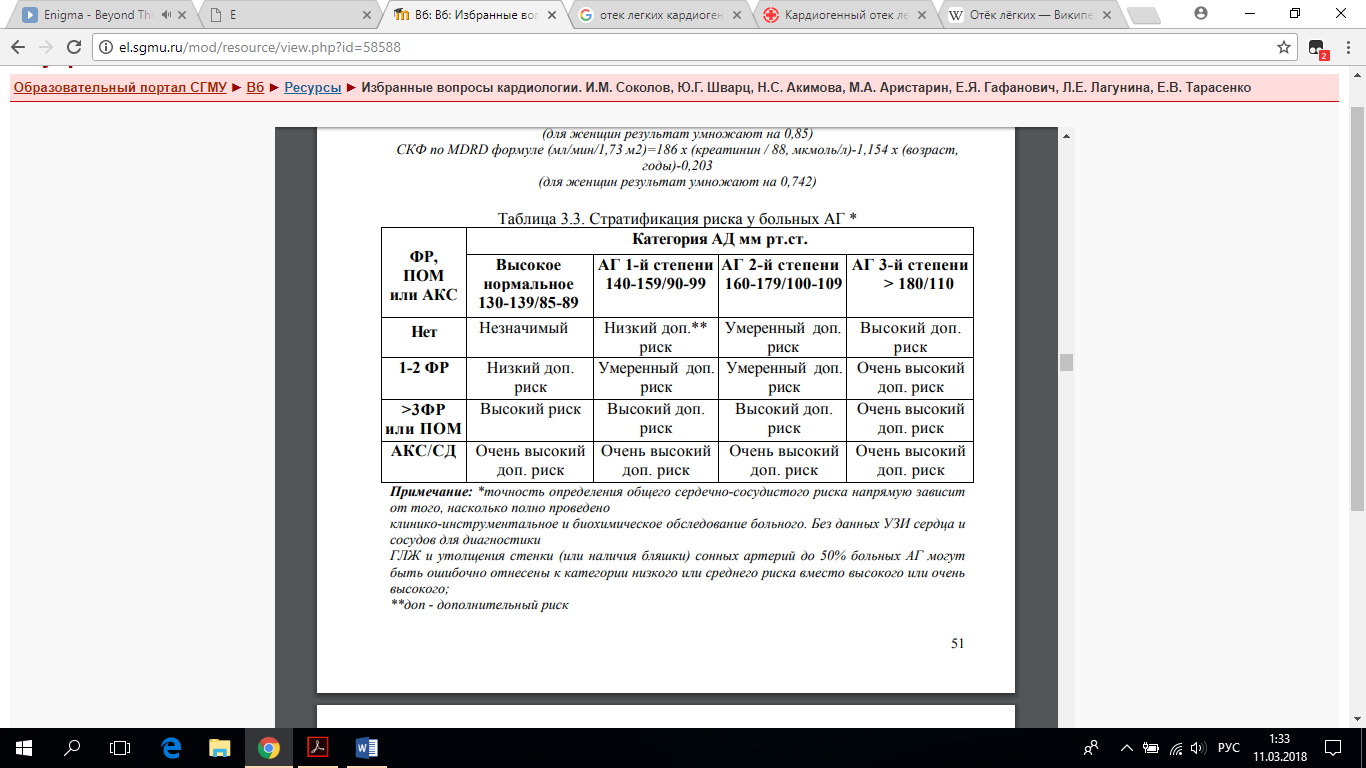 |
