1. Гипоталамус
 Скачать 1.9 Mb. Скачать 1.9 Mb.
|
|
Биомеханика вдоха и выдоха: 2 биомеханизма: - поднятие и опускание рёбер; - движение диафрагмы. Инспираторные мышцы: диафрагма, наружные межрёберные,(+трапециевидные, передние лестничные и грудино-ключично-сосцевидные) Экспираторные мышцы: внутр. межреберные, мышцы живота. Движения ребер. Во время вдоха верхние отделы грудной клетки расширяются в переднезаднем направлении, нижние - в боковых направлениях. Сокращаясь, наружные межреберные и межхрящевые мышцы в фазу инспирации поднимают ребра, напротив, в фазу выдоха ребра опускаются благодаря активности внутренних межреберных мышц. Движения диафрагмы. Диафрагма имеет форму купола, обращенного в сторону грудной полости. Во время спокойного вдоха купол диафрагмы опускается на 1,5—2,0 см. 3 Вопрос Многочисленные железы слизистой оболочки желудка вырабатывают желудочный сок. Основным ферментом его является пепсин, расщепляющий сложные молекулы белка на более простые молекулы аминокислот. Пищеварение в желудке происходит только при температуре тела 35—37 °С и при наличии в желудочном соке соляной кислоты, повышающей активность ферментов. Желудочное сокоотделение регулируется двумя механизмами — нервным и гуморальным. Благодаря нервной регуляции секреция желудочного сока начинается уже спустя несколько минут после того, как пища поступила в рот. Такой условнорефлекторно выделяемый желудочный сок называется аппетитным. Аппетитный сок имеет важное значение для пищеварения: благодаря ему желудок оказывается заранее подготовленным к приему пищи, и при ее попадании сразу же начинается процесс расщепления питательных веществ. Одновременно продукты расщепления пищевых веществ (глюкоза, аминокислоты и др.) через слизистую оболочку желудка всасываются в кровь; с током крови они попадают к желудочным железам и вызывают сокоотделение, которое продолжается в течение всего времени, пока пища находится в желудке. Это — гуморальная регуляция желудочного сокоотделения. 4Вопрос Определение количества гемоглобина Первую каплю крови снимают стерильной ваткой, а вторую набирают (насасывают) в капилляр Саля с резиновой трубкой до метки. Это следует делать осторожно, чтобы не насосать» крови больше необходимого количества и не набрать пузырьков воздуха. Как только уровень взятой крови достигнет метки, резиновую трубку зажимают пальцами, вытирают кончик капилляра ваткой, еще раз проверяют уровень крови и опускают капилляр в пробирку Сали, наполненную децинормальным раствором хлористоводородной кислоты до 10-го деления, но только так, чтобы кончик слегка погрузился в кислоту, и начинают осторожно выдувать кровь в пробирку. Последнюю каплю крови выдувают не в хлористоводородную кислоту, а на стенку выше уровня кислоты, последующим наклоном пробирки каплю крови смывают. Красная жидкость быстро, на глазах, приобретает коричневую окраску различной интенсивности в зависимости от содержания гемоглобина. Капилляр Сали еще раз наполняют путем насасывания жидкости из пробирки, чем достигается полное смывание крови с его стенок, а затем, заметив время, ставят пробирку в штатив. Гемоглобин определяют колориметрическим методом, т. е. путем сравнения цвета стандартного раствора гемоглобина с цветом образовавшегося в хлористоводородной кислоте хлорида гематина (рис. 10). Прибор для определения гемоглобина - так называемый гемометр - представляет собой деревянный штатив с тремя гнездами; два боковых гнезда заняты пробирками со стандартными растворами, а в среднее гнездо вставляют градуированную пробирку с исследуемым раствором солянокислого гематина и сравнивают цвета. Если цвет в исследуемой пробирке сразу же окажется светлее, чем в стандартной, набирают еще раз такое же количество крови из пальца, а при подсчете полученный результат делят пополам. Если же исследуемая жидкость темнее стандартной, то через 10 мин приступают к колори-метрированию. Для этого гемометр берут в левую руку и держат на уровне глаз, а правой в исследуемую жидкость пипеткой добавляют по каплям дистиллированую воду и размешивают стекляной палочкой. Воду прибавляют до тех пор, пока цвет содержимого исследуемой пробирки и боковых стандартов не станет одинаковым. Деления на градуированной пробирке обозначают содержание гемоглобина в исследуемой крови. Уровень жидкости в градуированной пробирке (одинаковой с цветом стандарта) укажет процентное содержание гемоглобина в определяемой крови. При определении количества гемоглобина допускается ошибка в пределах 5%. Современные гемометры имеют две шкалы. Одна из них показывает содержание гемоглобина в крови в грамм-процентах (количество граммов гемоглобина на 100 мл крови), вторая выражает то же количество гемоглобина в условных единицах (16,6 г% гемоглобина соответствует 100 ед). В норме количество гемоглобина у женщин несколько меньше, чем у мужчин.  Рис. 10. Гемометр Сали. Рис. 10. Гемометр Сали.Билет №15. 1.Интегрирующая деятельность ЦНС. Интегративная роль нервной системы ( от лат. Integrum –цельный, объединение каких-либо частей) заключается в объединении органов и систем в единую функциональную систему – организм. Такое объединение становится возможным благодаря трем факторам: 1) Участию ЦНС в управлении опорно-двигательным аппаратом с помощью соматической нервной системы; 2) Регуляции функций всех тканей и внутренних органов с помощью ВНС и эндокринной системы; 3) Наличию прямых и обратных (афферентных) связей ЦНС со всеми соматическими и вегетативными эффекторами. Можно выделить четыре основных уровня ЦНС, каждый из которых вносит свой вклад в обеспечение интегративной деятельности ЦНС. Первый уровень – нейрон. Взаимодействие возбуждающих и тормозящих входов, взаимодействие субсинабтических нейрохимических процессов в протоплазме в конечном итоге определяют, возникнет ли та или иная последовательность ПД на выходе нейрона или нет, т.е. будет ли дана команда другому нейрону, рабочему органу или нет, и возникнет ли соответствующая реакция. Таким образом, благодаря множеству возбуждающих и тормозящих синапсов на нейроне, он превратился в ходе эволюции в решающее устройство. Второй уровень – нейрональный ансамбль (модуль), обладающий качественно новыми свойствами, отсутствующими у отдельных нейронов – один и тот же модуль может участвовать в деятельности различных центров и отделов ЦНС и обеспечивать возникновение более сложных реакций ЦНС. Третий уровень – нервный центр. Нервные центры часто выступают как автономные командные устройства, реализующие управление тем или иным процессом на периферии в составе саморегулирующейся, самовосстанавливающейся, самовоспроизводящейся системы, - организм. Это достигается за счет множественных прямых, обратных, реципрокных связей в ЦНС, наличия прямых и обратных связей с периферическими органами. Четвертый уровень – высший уровень интеграции, включающий все центры регуляции, объединяемые корой большого мозга в единую регулирующую систему, а отдельные органы и системы – в единую физиологическую систему – организм, подсистемы которого постоянно формируют функциональные системы. Это достигается взаимодействием главных систем ЦНС – лимбической формации, РФ, подкорковых образований и неокортекса как высшего отдела ЦНС, организующего поведенческие реакции и их вегетативное обеспечение в различных условиях жизнедеятельности организма. 2. Транспорт кислорода кровью, КЕК, кривая диссоциации гемоглобина. Транспорт О2 осуществляется в физически растворенном и хи мически связанном виде. Физические процессы, т. е. растворение газа, не могут обеспечить запросы организма в О2. Подсчитано, что физически растворенный О2 может поддерживать нормальное по требление О2 в организме (250 мл*мин-1), если минутный объем кровообращения составит примерно 83 л*мин-1 в покое. Наиболее оптимальным является механизм транспорта О2 в химически свя занном виде. Согласно закону Фика, газообмен О2 между альвеолярным воздухом и кровью происходит благодаря наличию концентраци онного градиента О2 между этими средами. В альвеолах легких парциальное давление О2 составляет 13,3 кПа, или 100 мм рт.ст., а в притекающей к легким венозной крови парциальное напряжение О2 составляет примерно 5,3 кПа, или 40 мм рт.ст. Давление газов в воде или в тканях организма обозначают тер мином «напряжение газов» и обозначают символами Ро2, Рсo2. Градиент О2 на альвеолярно-капиллярной мембране, равный в среднем 60 мм рт.ст., является одним из важнейших, но не единственным, согласно закону Фика, факторов начальной стадии диффузии этого газа из альвеол в кровь.( Ни слова о собственно диффузии!!!) Транспорт О2 начинается в капиллярах легких после его хими ческого связывания с гемоглобином. Гемоглобин (Нb) способен избирательно связывать О2 и образо вывать оксигемоглобин (НbО2) в зоне высокой концентрации О2 в легких и освобождать молекулярный О2 в области пониженного содержания О2 в тканях. При этом свойства гемоглобина не изме няются и он может выполнять свою функцию на протяжении дли тельного времени. Гемоглобин переносит О2 от легких к тканям. Эта функция зависит от двух свойств гемоглобина: 1) способности изменяться от восстановленной формы, которая называется дезоксигемоглобином, до окисленной (Нb + О2 à НbО2) с высокой скоростью (полупериод 0,01 с и менее) при нормальном Рог в альвеолярном воздухе; 2) способности отдавать О2 в тканях (НbО2 à Нb + О2) в зависимости от метаболических потребностей клеток организма. Зависимость степени оксигенации гемоглобина от парциального давления Ог в альвеолярном воздухе графически представляется в виде кривой диссоциации оксигемоглобина, или сатурационной кри вой (рис. 8.7). Плато кривой диссоциации характерно для насы щенной О2 (сатурированной) артериальной крови, а крутая нисхо дящая часть кривой — венозной, или десатурированной, крови в тканях. На сродство кислорода к гемоглобину влияют различные мета болические факторы, что выражается в виде смещения кривой дис социации влево или вправо. Сродство гемоглобина к кислороду регулируется важнейшими факторами метаболизма тканей: Ро2 pH, температурой и внутриклеточной концентрацией 2,3-дифосфоглицерата. Величина рН и содержание СО2 в любой части организма закономерно изменяют сродство гемоглобина к О2: уменьшение рН крови вызывает сдвиг кривой диссоциации соответственно вправо (уменьшается сродство гемоглобина к О2), а увеличение рН крови — сдвиг кривой диссоциации влево (повышается сродство гемоглобина к О2) (см. рис. 8.7, А). Например, рН в эритроцитах на 0,2 единицы ниже, чем в плазме крови. В тканях вследствие повышенного со держания СО2 рН также меньше, чем в плазме крови. Влияние рН на кривую диссоциации оксигемоглобина называется «эффектом Бора». Рост температуры уменьшает сродство гемоглобина к О2. В ра ботающих мышцах увеличение температуры способствует освобож дению О2. Уменьшение температуры тканей или содержания 2,3-дифосфоглицерата вызывает сдвиг влево кривой диссоциации окси гемоглобина (см. рис. 8.7, Б). Метаболические факторы являются основными регуляторами связывания О2 с гемоглобином в капиллярах легких, когда уровень O2, рН и СО2 в крови повышает сродство гемоглобина к О2 по ходу легочных капилляров. В условиях тканей организма эти же факторы метаболизма понижают сродство гемоглобина к О2 и способствуют переходу оксигемоглобина в его восстановленную форму — дезоксигемоглобин. В результате О2 по концентрацион ному градиенту поступает из крови тканевых капилляров в ткани организма. Оксид углерода (II) — СО, способен соединяться с атомом железа гемоглобина, изменяя его свойства и реакцию с О2. Очень высокое сродство СО к Нb (в 200 раз выше, чем у О2) блокируют один или более атомов железа в молекуле гема, изменяя сродство Нb к О2. Под кислородной емкостью крови понимают количество Ог, которое связывается кровью до полного насыщения гемоглобина. При содержании гемоглобина в крови 8,7 ммоль*л-1 кислородная емкость крови составляет 0,19 мл О2 в 1 мл крови (температура 0oC и барометрическое давление 760 мм рт.ст., или 101,3 кПа). Величину кислородной емкости крови определяет количество гемо глобина, 1 г которого связывает 1,36—1,34 мл О2. Кровь человека содержит около 700—800 г гемоглобина и может связать таким образом почти 1 л О2. Физически растворенного в 1 мл плазмы крови О2 очень мало (около 0,003 мл), что не может обеспечить кислородный запрос тканей. Растворимость О2 в плазме крови равна 0,225 мл*л-1*кПа-1. Обмен О2 между кровью капилляров и клетками тканей также осуществляется путем диффузии. Концентрационный градиент О2 между артериальной кровью (100 мм рт.ст., или 13,3 кПа) и тканями (около 40 мм рт.ст., или 5,3 кПа) равен в среднем 60 мм рт.ст. (8,0 кПа). Изменение градиента может быть обусловлено как содержанием О2 в артериальной крови, так и коэффициентом утилизации О2, который составляет в среднем для организма 30— 40%. Коэффициентом утилизации кислорода называется количе ство О2, отданного при прохождении крови через тканевые капил ляры, отнесенное к кислородной емкости крови. С другой стороны, известно, что при напряжении О2 в артери альной крови капилляров, равном 100 мм рт.ст. (13,3 кПа), на мембранах клеток, находящихся между капиллярами, эта величина не превышает 20 мм рт.ст. (2,7 кПа), а в митохондриях равна в среднем 0,5 мм рт.ст. (0,06 кПа). 3. ССС У стареющего. После 25 лет максимальное потребление кислорода организмом постоянно уменьшается и к 55 годам оно уже почти на 27% ниже величин, отмеченных у 20-летних. Вместе с тем, физически активные люди сохраняют относительно высокое максимальное потребление кислорода во всех возрастных группах. Отсюда следует, что уровень максимального потребления кислорода больше отражает уровень физической активности, чем хронологию возраста. Так, постепенное снижение максимального потребления кислорода после 25 лет у остающихся физически активными мужчин составляет около 0,4 мл О2 кг мин1 на каждый год жизни. У мужчин же ведущих малоподвижный образ жизни темп его снижения оказывается вдвое быстрее. Указанное снижение аэробных способностей организма при старении находит объяснение в изменениях функции сердечно-сосудистой системы, в частности, в уменьшении с возрастом максимальной частоты сердечных сокращений у мужчин и женщин. Эти отношения могут быть выражены следующим образом. Максимальное число сердечных сокращений = 220 -возраст (к-во лет). Как следствие снижения максимального числа сердечных сокращений минутный объем и сердечный индекс также уменьшаются с возрастом. Величина последнего уменьшается на 20-30% от 30 к 80 годам. Отложение жиров в коронарных артериях ухудшает обеспечение кровью сердечной мышцы. Гипоксия миокарда приводит к инфильтрации его коллагеном, что уменьшает сократительную активность сердца, лимитирует его работу. В связи с этим, имеет место уменьшение ударного объема крови, индекса сократимости, систолического давления в левом желудочке, максимальной скорости укорочения волокон миокарда. С возрастом уменьшаются и возможности снабжения кровью тканей. Так, во внутренних органах, скелетных мышцах уменьшается плотность капилляров, увеличивается радиус диффузии, расширяется базальный слой стенок капилляров, уменьшается площадь суммарного артериального сечения. В ходе старения в кровеносных сосудах возникают атеросклеротические изменения, которые могут уменьшать кровоток в органах. В свою очередь, это оказывается причиной многих симптомов, таких как слабоумие, нарушения психических функций, изменения функций почек. Потеря эластичности сосудистой стенки и увеличение сопротивления кровотоку в мелких артериях повышает общее периферическое сосудистое сопротивление. В результате, общее периферическое сосудистое сопротивление (в дин-с-см 5), равное 1323+62 в возрасте 20-49 лет, в 60-69 лет достигает 2075+122,9, в 70-79 лет — 2286±139, в 80-89 лет -2324±108,3, у долгожителей -2746±212. Это приводит к закономерному повышению системного артериального давления. Так, к 60 годам систолическое артериальное давление возрастает до 140 мм рт.ст., а диастолическое — до 90 мм рт.ст. У лиц старше 60 лет (включая и долгожителей) уровень артериального давления не превышает в среднем 150/90 мм рт.ст. Росту величин артериального давления препятствует как увеличение объема аорты, так и снижение сердечного выброса. Контроль кровяного давления с помощью барорецепторного механизма аорты и синокаротидной зоны с возрастом оказывается нарушен, что может быть причиной тяжелой гипотензии стариков при переходе в вертикальное положение. Гипотензия, в свою очередь, может вызывать ишемию мозга. Отсюда многочисленные падения у стариков, вызванные потерей равновесия и обмороком при быстром вставании. В венах с возрастом развиваются явления флебосклероза, выражающиеся в распаде эластических волокон и замене их коллагеновыми, дегенерация эндотелия и основного вещества. В результате, у пожилых и стариков имеет место снижение тонуса и эластичности венозной стенки, что влечет за собой расширение венозного русла, снижение давления в венах. Присасывающее действие грудной клетки снижается, уменьшается величина венозного возврата, возникает явление венозного стаза. Нарастание емкости сосудистого русла при одновременном снижении сердечного выброса увеличивает время общего кругооборота крови — от 47,8±2,7 с у 20-39-летних людей до 60,6±3,2 с у 60-69-летних и до 65,4±3,1 с в 70-79 лет. Замедление капиллярного кровотока способствует более полному насыщению крови кислородом в легких и более полной его отдачи в тканях, что, в известной мере, компенсирует как нарушение диффузионной способности легких, так и ухудшение тканевого кровотока с возрастом. Флебосклероз повышает риск венозного тромбоза у пожилых. Вместе с тем, регулярные занятия физическими упражнениями улучшают показатели функций сердечно-сосудистой системы в большей мере, чем у людей того же возраста, но ведущих малоподвижный образ жизни. Например, у мужчин в возрасте 50 и 70 лет, в течение 20 лет бывших неактивными физически, 8-недельная тренировка продолжительностью от 1 до 2 часов по 3-5 раз в неделю повышает максимальное потребление кислорода в среднем на 20%. После 35 лет у мужчин и после 45 лет у женщин резко возрастает вероятность развития ишемической болезни сердца. В возрасте от 55 до 65 лет 13 из 100 мужчин и 6 из 100 женщин в США погибали от это болезни, хотя национальная программа борьбы за здоровый образ жизни в последние годы значительно снизила число этих заболеваний. Нарастание риска развития ишемической болезни сердца при старении во многом связывают с нарушением липидного состава крови (с гиперлипидемией), т.е. увеличением в ней уровня холестерина и триглицеридов. Но эти вещества не циркулируют свободно в плазме крови, а транспортируются ею в форме липопротеинов, поэтому точнее говорить о гиперлипопротеинемии. Количество холестерина, оседающего в мембранах клеток, и, в том числе, в сосудистой стенке, зависит от соотношения в плазме крови липопротеинов, экстрагирующих холестерин из мембран (липопротеины высокой плотности — ЛПВП) и способствующих его внедрению в мембрану (липопротеины особо низкой плотности — ЛПОНП и липопротеины низкой плотности — ЛПНП). Уровень ЛПВП отражает динамику движения холестерина из периферических тканей (включая сосудистую стенку) к печени, где он окисляется до желчных кислот и секретируется с желчью. ЛПНП и ЛПОНП — это средство транспорта жиров в организме к клеткам, в том числе, к гладким мышцах стенок артерий. В норме отношение липопротеинов, повышающих или понижающих уровень холестерина в мембранах, сбалансировано и коэффициент (ЛПНП+ЛПОНП)/ЛПВП, отражающий избыток холестерина в мембранах, низкий, но с возрастом он нарастает. Нарастание холестерина в мембранах клеток сосудов становится характерной чертой артериосуживающего процесса — артериосклероза. Этому способствует уменьшающаяся липолитическая и АТФ-азная активность в гладкомышеч-ных клетках сосудов. Отложение липидов в стенке сосудов вызывает кальцификацию и фиброзные изменения, в результате, артериальные стенки становятся суженными, ригидными и жесткими, делая кровоток в тканях более затрудненным. Этот процесс ускоряется употреблением пищи, богатой холестерином и ненасыщенными кислотами. Ряд факторов, например, физическая активность, могут увеличивать производство ЛПВП. Так, их уровень оказывается повышенным у стариков, использующих энергичные аэробные тренировки. Атерогенное сужение сосудов сердца, ухудшающее кровоснабжение миокарда, может длительно не давать клинических признаков заболеваний. Но недостаточность снабжения миокарда кислородом может быть выявлена по изменениям электрической активности сердца при умеренной физической нагрузке. Наиболее выраженным признаком этого является горизонтальная депрессия S-T сегмента на ЭКГ. Оказалось, что в группе лиц с выраженной депрессией комплекса S-T до 1 мм во время физической нагрузки имеет место увеличение смертности в 4,6 раза чаще, чем у лиц того же возраста, но с нормальным сегментом S-T. Появление желудочковых экстрасистол во время физической нагрузки является другим признаком тяжелого ишемического атеросклероза сосудов сердца. Эта форма электрической нестабильности миокарда имеет большое прогностическое значение для ишемической болезни сердца. 4. СОЭ по Панченкову. Кровь при движении - устойчивая суспензия. При помещении ее в стеклянный сосуд, эритроциты в силу их тяжести оседают. Скорость оседания эритроцитов зависит от состояния организма. При некоторых физиологических состояниях (например, беременность) и при целом ряде заболеваний (туберкулез, ревматизм и др.) оседание эритроцитов бывает незначительно ускоренным. Рис. 1. Аппарат Панченкова для определения СОЭ 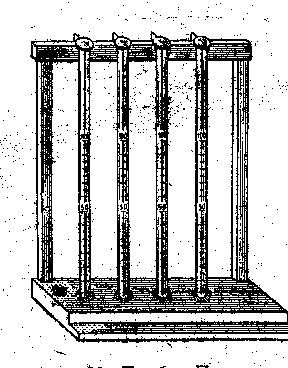 Для определения СОЭ применяют прибор Панченкова, состоящий из штатива, в котором могут быть зажаты в вертикальном положении специальные капилляры. Капилляры градуированы в миллиметрах. Метка 0 стоит на расстоянии 100 мм от конца. На капилляре есть еще две метки: К (кровь) - на высоте нуля и метка Р (реактив) - на уровне 50 мм. Для работы необходимо: прибор Панченкова, часовое стекло, стерильный скарификатор, вата, 5% раствор цитрата натрия, спирт, эфир, йод. Работу проводят на человеке. Ход работы. Капилляр промывают 5% раствором цитрата натрия. Затем набирают цитрат натрия до метки Р на уровне 50 мм и выдувают его на часовое стекло. Затем в тот же капилляр набирают кровь из пальца человека до метки К дважды. Следует иметь в виду, что для успешного взятия крови прокол должен быть довольно глубоким; капилляр следует держать горизонтально, погрузив его кончик в каплю крови, при этом кровь сама наполняет капилляр. Обе порции выпускают на часовое стекло, смешивая с имеющимся там цитратом натрия. Полученную таким образом на часовом стекле смесь крови с цитратом натрия в отношении 4:1 набирают в капилляр до метки 0 и ставят капилляр в штатив. Через час смотрят, какова высота в миллиметрах образовавшегося верхнего столбика плазмы в капилляре. Его величина и является мерой СОЭ. В норме СОЭ составляет от 4 до 10 мм/ч; показания от 10 до 15 мм/ч расцениваются как незначительное ускорение; 15-30 мм/ч - среднее ускорение, 30 мм/ч и выше - резкое ускорение. Примечание. Для практической работы допустимо набирать половинное количество крови и цитрата натрия, т.е. цитрата – до 25 мм, крови – до 100 мм в капилляре Панченкова. Билет №16. 1. слюна. Слюноотделение, регуляция. Слюна продуцируется тремя парами крупных слюнных желез и множеством мелких железок языка, слизистой оболочки неба и щек. Из желез по выводным протокам слюна поступает в полость рта. В зависимости от набора и интенсивности секреции разных гландулоцитов в железах они выделяют слюну разного состава. Околоушные и малые железы боковых поверхностей языка, содер жащие большое количество серозных клеток, секретируют жидкую слюну с высокой концентрацией хлоридов натрия и калия и высо кой активностью амилазы. Секрет поднижнечелюстной железы (смешанный) богат органическими веществами, в том числе муци ном, содержит амилазу, но в меньшей концентрации, чем слюна околоушной железы. Слюна подъязычной железы (смешанная) еще более богата муцином, имеет выраженную щелочную реакцию, высокую фосфатазную активность. Секрет слизистых желез, рас положенных в корне языка и неба, особенно вязок из-за высокой концентрации муцина. Здесь же есть и мелкие смешанные железы. Из ацинусов желез секрет поступает в систему все укрупня ющихся протоков, собирающихся в выводной проток, выносящий несколько измененную здесь (количество и состав) слюну в по лость рта. Вне приема пищи у человека слюна выделяется для увлажнения полости рта в среднем со скоростью 0,24 мл/мин, при жевании — со скоростью 3—3,5 мл/мин в зависимости от вида пищи; при введении в рот лимонной кислоты (0,5 ммоль) — 7,4 мл/мин. За сутки выделяется 0,5—2,0 л слюны, около трети ее образуется околоушными железами. Состав и свойства слюны. Смешанная слюна представляет со бой вязкую, слегка опалесцирующую мутноватую жидкость с отно сительной плотностью 1,001—1,017, вязкостью 1,10—1,32 пуаза. Состав слюны зависит от скорости ее секреции и вида стимуляции саливации. Смешанная слюна имеет рН 5,8—7,4, рН слюны около ушных желез ниже (5,81), чем поднижнечелюстных (6,39). С увеличением скорости секреции рН слюны повышается до 7,8. Состав слюны сложен и меняется в зависимости от свойств прини маемой пищи, вида стимулятора слюновыделения (табл. 9.3). Муцин склеивает пищевые частицы в пищевой комок, который, будучи покрыт слизью, легче проглатывается. Этому способствует также пенообразование. Слизь слюны выполняет и защитную функцию, покрывая нежную слизистую оболочку рта и пищевода. Слюна содержит несколько ферментов: α-амилазу, α-глюкозидазу. Гидролиз углеводов, осуществляемый с помощью этих фер ментов, из-за кратковременности пребывания пищи в полости рта происходит в основном внутри пищевого комка уже в желудке. Действие карбогидраз слюны прекращается под влиянием кислой реакции желудочного сока. Активность протеолитических фермен тов значительно ниже, а их роль в пищеварении взрослого челове ка невелика, однако эти ферменты имеют значение в санации по лости рта. Так, мурамидаза (лизоцим) слюны обладает высокой бактерицидностью. Дезинфицирующее действие на содержимое полости рта оказывают протеиназы (саливаин, гландулаин и др.), РНКазы. Значение слюны в пищеварении состоит в смачивании пищи, что способствует ее измельчению и гомогенизации при жевании; растворении питательных и вкусовых веществ, что важно для раз дражения вкусовых рецепторов и действия ферментов слюны; ослизнения принятой и пережеванной пищи, что необходимо для формирования пищевого комка и облегченного его проглатывания. Количество и состав слюны адаптированы к виду принимаемой пищи и режиму питания. На пищевые вещества выделяется более вязкая слюна, и ее тем больше, чем суше пища; на отвергаемые вещества и горечи — значительное количество жидкой слюны. Адаптация слюноотделения обеспечивается регуляторными воздей ствиями на слюнные железы. Регуляция слюноотделения. Вне приема пищи небольшое коли чество слюны выделяют подъязычные, щечные и поднижнечелюстные железы человека. Прием пищи и связанные с ним факторы ус ловно- и безусловнорефлекторно возбуждают слюноотделение. Латентный период слюноотделения зависит от силы пищевого раз дражителя и возбудимости пищевого центра и составляет 1—30 с. Слюноотделение продолжается весь период еды и почти полностью прекращается вскоре после ее окончания. На стороне жевания слюны выделяется больше и с более высокой активностью амила зы, чем на противоположной стороне. Возбуждение от рецепторов полости рта передается в ЦНС по афферентным волокнам тройничного, лицевого, языкоглоточного и блуждающего нервов. Импульсы достигают продолговатого мозга, других отделов мозга, включая кору большого мозга. Основ ной центр слюноотделения расположен в продолговатом мозге, сюда и в боковые рога верхних грудных сегментов спинного мозга посту пают импульсы из вышерасположенных отделов мозга. К слюнным железам импульсы следуют по эфферентным парасимпатическим и симпатическим нервным волокнам. Парасимпатическая иннервация поднижнечелюстной и подъ язычной слюнных желез начинается от верхнего слюноотдели тельного ядра продолговатого мозга. Волокна преганглионарных нейронов в составе барабанной струны доходят до ганглиев этих желез, где переключаются на постганглионарные нейроны и по их аксонам достигают гландулоцитов. Преганглионарные волокна око лоушных желез берут начало из нижнего слюноотделительного ядра продолговатого мозга, проходят в составе языкоглоточного нерва до ушного узла. Здесь расположены вторые нейроны, по ак сонам которых в состав ушно-височного нерва импульсы дости гают слюнных желез. Под влиянием ацетилхолина, высвобождаемого окончаниями постганглионарных нейронов, выделяется большое количество жидкой слюны с высокой концентрацией электролитов и низкой концентрацией муцина. Симпатическая иннервация слюнных желез осуществляется из боковых рогов II—IV грудных сегментов спинного мозга; отсю да волокна преганглионарных нейронов следуют в верхний шейный узел, где образуется контакт с постганглионарными нейронами. Их аксоны достигают слюнных желез. Норадреналин, высвобождаемый окончаниями постганглионар ных нейронов, вызывает выделение небольшого количества густой слюны, усиливает образование в железах ферментов и муцина. Одновременное раздражение парасимпатических нервов усиливает секреторный эффект. У человека симпатические нервы в наиболь шей мере усиливают секрецию поднижнечелюстных слюнных желез. Различия в секреции слюнных желез в ответ на прием различ ной пищи объясняются изменениями частот импульсов по пара симпатическим и симпатическим нервным волокнам, которые мо гут быть одно- и разнонаправленными. Слюноотделение относится к числу легкотормозимых процессов. Секрецию слюны тормозят бо левые раздражения, отрицательные эмоции, умственное напряже ние и др. Парасимпатическая денервация слюнных желез вызывает их гиперсекрецию, это так называемая паралитическая секреция (максимум ее обычно отмечается на 7—8-й день после опе рации). Снижение секреции слюнных желез называется гипосаливацией (гипосиалия). Она может вызвать многие нарушения, способст вовать развитию микрофлоры во рту и быть причиной скверного запаха изо рта (есть и другие причины этого явления). Длитель ное снижение слюноотделения может быть причиной трофических нарушений слизистой оболочки рта, десен, зубов. Избыточное слю ноотделение — гиперсаливация (сиалорея, птиализм) — сопро вождает многие патологические состояния. 2. Пд в кардиомицитах. Экстрасистолы. В естественных условиях клетки миокарда находятся в состоянии ритмической активности (возбуждения), поэтому об их потенциале покоя можно говорить лишь условно. У большинства клеток он составляет около 90 мВ и определяется почти целиком концентра ционным градиентом ионов К+.  Потенциалы действия (ПД), зарегистрированные в разных от делах сердца при помощи внутриклеточных микроэлектродов, су щественно различаются по форме, амплитуде и длительности (рис. 7.3, А). На рис. 7.3, Б схематически показан ПД одиночной клетки миокарда желудочка. Для возникновения этого потенциала потребовалось деполяризовать мембрану на 30 мВ. В ПД различают следующие фазы: быструю начальную деполяризацию — фаза 1; медленную реполяризацию, так называемое плато — фаза 2; быст рую реполяризацию — фаза 3; фазу покоя — фаза 4. Фаза 1 в клетках миокарда предсердий, сердечных проводящих миоцитов (волокна Пуркинье) и миокарда желудочков имеет ту же природу, что и восходящая фаза ПД нервных и скелетных мышечных волокон — она обусловлена повышением натриевой проницаемости, т. е. активацией быстрых натриевых каналов клеточной мембраны. Во время пика ПД происходит изменение знака мембранного по тенциала (с —90 до +30 мВ). Деполяризация мембраны вызывает активацию медленных на трий-кальциевых каналов. Поток ионов Са2+ внутрь клетки по этим каналам приводит к развитию плато ПД (фаза 2). В период плато натриевые каналы инактивируются и клетка переходит в состояние абсолютной рефрактерности. Одновременно происходит активация калиевых каналов. Выходящий из клетки поток ионов К+ обеспе чивает быструю реполяризацию мембраны (фаза 3), во время ко торой кальциевые каналы закрываются, что ускоряет процесс ре поляризации (поскольку падает входящий кальциевый ток, деполя ризующий мембрану). Реполяризация мембраны вызывает постепенное закрывание ка лиевых и реактивацию натриевых каналов. В результате возбудимость миокардиальной клетки восстанавливается — это период так называемой относительной рефрактерности. В клетках рабочего миокарда (предсердия, желудочки) мембран ный потенциал (в интервалах между следующими друг за другом ПД) поддерживается на более или менее постоянном уровне. Однако в клетках синусно-предсердного узла, выполняющего роль водителя ритма сердца, наблюдается спонтанная диастолическая деполяриза ция (фаза 4), при достижении критического уровня которой (при мерно —50 мВ) возникает новый ПД (см. рис. 7.3, Б). На этом механизме основана авторитмическая активность указанных сердеч ных клеток. Биологическая активность этих клеток имеет и другие важные особенности: 1) малую крутизну подъема ПД; 2) медленную реполяризацию (фаза 2), плавно переходящую в фазу быстрой реполяризации (фаза 3), во время которой мембранный потенциал достигает уровня —60 мВ (вместо —90 мВ в рабочем миокарде), после чего вновь начинается фаза медленной диастолической депо ляризации. Сходные черты имеет электрическая активность клеток предсердно-желудочкового узла, однако скорость спонтанной диасто лической деполяризации у них значительно ниже, чем у клеток синусно-предсердного узла, соответственно ритм их потенциальной автоматической активности меньше. Ионные механизмы генерации электрических потенциалов в клетках водителя ритма полностью не расшифрованы. Установлено, что в развитии медленной диастолической деполяризации и мед ленной восходящей фазы ПД клеток синусно-предсердного узла ведущую роль играют кальциевые каналы. Они проницаемы не только для ионов Са2+, но и для ионов Na+. Быстрые нат риевые каналы не принимают участия в генерации ПД этих клеток. Скорость развития медленной диастолической деполяризации ре гулируется автономной (вегетативной) нервной системой. В случае влияния симпатической части медиатор норадреналин активирует медленные кальциевые каналы, вследствие чего скорость диастоли ческой деполяризации увеличивается и ритм спонтанной активности возрастает. В случае влияния парасимпатической части медиатор АХ повышает калиевую проницаемость мембраны, что замедляет развитие диастолической деполяризации или прекращает ее, а также гиперполяризует мембрану. По этой причине происходит урежение ритма или прекращение автоматии. Способность клеток миокарда в течение жизни человека нахо диться в состоянии непрерывной ритмической активности обеспе чивается эффективной работой ионных насосов этих клеток. В период диастолы из клетки выводятся ионы Na+, а в клетку возвращаются ионы К+. Ионы Са2+, проникшие в цитоплазму, поглощаются эндоплазматической сетью. Ухудшение кровоснабжения миокарда (ишемия) ведет к обеднению запасов АТФ и креатинфосфата в миокардиальных клетках; работа насосов нарушается, вследствие чего уменьшается электрическая и механическая активность мио кардиальных клеток Если на сердце, находящееся в фазе относительной рефрактерности, нанести сверхпороговое раздражение, то возникнет внеочередное сокращение - экстрасистола. Амплитуда экстрасистолы будет зависеть от того, в какой момент этой фазы нанесено раздражение. Чем оно ближе к концу относительной рефрактерности, тем больше ее величина. После экстрасистолы следует более длительный, чем обычно период покоя сердца. Он называется компенсаторной паузой. Она возникает вследствие того, что очередной потенциал действия, генерирующийся в синоатриальном узле, поступает к мышце сердца в период ее рефрактерности обусловленный экстрасистолой (рис). У человека экстрасистолы возникают вследствие поступлений внеочередных импульсов из эктопических очагов автоматии. Ими могут быть скопления Р-клеток в миокарде предсердий, атриовентрикулярном узле, пучке Гиса, волокнах Пуркинье желудочков. Поэтому выделяют предсердные, атриовентрикулярные и желудочковые экстрасистолы. При предсердных и атриовентрикулярных экстрасистолах возникает неполная компенсаторная пауза, которая немного длительнее обычного сердечного цикла. При желудочковых полная компенсаторная пауза. В последнем случае нарушается и ритм пульса. Экстрасистолы могут возникать у здоровых людей при эмоциональном напряжении, курении, злоупотреблении алкоголем. Но чаще это проявление патологических изменений в проводящей системе. В тяжелых случаях возникают множественные очаги возбуждения. Развивается фибрилляция предсердий и желудочков. Это асинхронные сокращения отдельных групп кардиомиоцитов. В результате фибрилляции желудочков наблюдаются тяжелые нарушения гемодинамики и смерть. Для выведения из этого состояния применяется дефибрилляция 3. Опиатные рецепторы и их лиганды. Физиологические основы наркоза. Опиоидные рецепторы (опиатные рецепторы) — разновидность рецепторов нервной системы, относящихся к рецепторам, сопряжённым с G белком. Основная их функция в организме — регулирование болевых ощущений. В настоящее время различают четыре основные группы опиоидных рецепторов: μ- (мю), δ- (дельта), κ- (каппа) и ноцицептивные рецепторы. Они связываются как с эндогенными (вырабатываемые в организме), так и с экзогенными (поступающими извне) опиоидными лигандами. Опиатные рецепторы широко распространены в головном, спинном мозге, а также в желудочно-кишечном тракте и других органах. Механизм действия При активации опиоидного рецептора ингибируется аденилатциклаза, которая играет важную роль при синтезе вторичного посредника цАМФ (cAMP), а также осуществляется регулирование ионных каналов. Закрытие потенциал-зависимых кальциевых каналов в пресинаптическом нейроне приводит к уменьшению выброса возбуждающих нейромедиаторов (таких как глутаминовая кислота), а активация калиевых каналов в постсинаптическом нейроне приводит к гиперполяризации мембраны, что уменьшает чувствительность нейрона к возбуждающим нейромедиаторам. |
