Шпоры культура клеток органов и тканей. ККОИТ. 1. История развития метода культивирования клеток и тканей растений
 Скачать 1.38 Mb. Скачать 1.38 Mb.
|
|
Метод культуры–няньки. Одиночные клетки, изолированные стерильной петлей или микропипеткой из каллуса или суспензионной культуры, переносятся на стерильную фильтровальную бумагу, помещенную за 2-3 дня до изолирования клеток на верхушку каллусной ткани-няньки. Клетка на фильтре получает от каллуса питательные вещества в результате диффузии через фильтровальную бумагу. Метод кормящего слоя близок к методу культуры-няньки. В качестве кормящего слоя используют активно делящиеся клетки суспензионной культуры того же вида растений, что и одиночная клетка. Другой вариант культивирования одиночных клеток на основе выделений из делящихся клеток - кондиционирование среды. В этом случае клеточную суспензию в экспоненциальной фазе фильтруют через бактериальный фильтр, после чего фильтрат ( среду с выделениями клеток суспензии) добавляют в среду для культивирования одиночных клеток. Метод микрокапель основан на асептическом культивировании одиночных клеток в капле жидкой среды, окруженной стерильным минеральным маслом в специально сконструированных микрокамерах. Метод плейтинга – высев клеток в агаризованные среды. Суспензию одиночных клеток смешивают с расплавленной агаризованной средой , охлажденной до 35 –400 С и разливают тонким слоем в стерильные чашки Петри, которые инкубируют в темноте или рассеянном свете. Метод пластинок –реплик. На чашку, посеянную методом плейтинга, наносят капроновую сетку, чтобы она находилась в контакте с агаризованной средой. Клетки прорастают через нити сетки и прилипают к ней. Через 20 дней контакта сетку переносят на новую чашку Петри обратной стороной. При этом на новой чашке копируется расположение клеточных клонов. 32. Методы получения гаплоидных растений Большой интерес для селекционеров представляют гаплоидные растения. Гаплоиды получают двумя способами. Первый способ классический – отдаленная гибридизация, когда в зиготе отдаленного гибрида хромосомы одного из видов элиминируют. Второй способ основан на методиках культивирования in vitro, где из неоплодотворенных половых клеток с редуцированным набором хромосом можно регенерировать целые растения. Обычно они стерильны, так как у них нарушено формирование мужских и женских гамет. При культивировании in vitro, однако, может произойти спонтанное удвоение хромосом, или его можно вызвать искусственно, например, обработав колхицином клетки или растения. Дигаплоиды фертильны и вполне жизнеспособны. Гаплоиды и дигаплоиды имеют ряд преимуществ в селекционной работе: *гаплоидные растения имеют один набор хромосом, характерный для гамет, что дает селекционерам возможность наблюдать мутации сразу же в ходе осмотра гаплоидных растений, поскольку все рецессивные генные мутации в гаплоидных организмах не маскируются доминантными аллелями; *если гаплоидные клетки подвергнуть полиплоидизации с помощью колхицина, то возникнут дигаплоиды, характеризующиеся абсолютной гомозиготностью. Скрещивание гомозиготных линий дает, как правило, высокопродуктивное потомство. С другой стороны, в настоящее время картофель не размножают семенами из-за пестроты потомства, а создание с помощью гаплоидов гомозиготных линий устранит этот недостаток; *гомозиготные растения используются селекционерами и в других целях: количественный генетический анализ, изучение взаимодействия генов, изучение генетической изменчивости, определение групп сцепления, установление числа генов, действующих на количественные признаки, определение локализации полигенов и т.д. гаплоидные растения лишены летальных или сублетальных мутаций, ведущих к гибели или ослаблению потомства. Гаплоиды высших растений можно получить из эксплантов, взятых на любой стадии развития гаметофита после редукционного деления клеток спорогенной ткани пыльника. Наиболее распространены следующие методы индуцирования гаплоидов: индуцированный андрогенез в культуре пыльников и пыльцы; селективная элиминация хромосом в гибридном зародыше. Этот метод чаще всего используется в селекции злаковых; псевдогамия - развитие гаплоидного зародыша после оплодотворения инородной пыльцой без оплодотворения яйцеклетки или же развитие изолированной семяпочки (гиногенез). 33. Культивирование репродуктивных органов пыльников, неоплодотворенных завязей и семяпочек открывает перспективу массового получения гаплоидных растений, представляющих ценный исходный материал для селекции. Основным преимуществом гаплоидной технологии является быстрое получение гомозиготных линий. Такие линии происходят либо из отцовского, либо из материнского геномов репродуктивных клеток, имеют максимальную гомозиготность в отличии от соматических клеток, для которых характерна гетерозиготность.Значение гаплоидной технологии было сразу оценено селекционерами из-за значительного сокращения времени для создания гомозиготных линий и получения быстрой информации о ценности тех или иных комбинаций в ранних поколениях. Гаплоидные растения при культивировании пыльников получены более чем у 70 видов, в том числе у пшеницы, ячменя, риса, кукурузы . Поскольку гаплоиды, полученные в культуре пыльников, несут генотип мужской гаметы, этот процесс называется андрогенезом in vitro. Андрогенез может быть прямым и косвенным. Прямой андрогенез – образование гаплоидных растений-регенерантов благодаря пыльцевому эмбриогенезу, т.е. из эмбриоидов, формирующихся путем деления микроспор. Возникновение гаплоидных растений из каллусов, которые образуются в результате дедифференциации микроспор, называется косвенным андрогенезом. Не все растения, регенерировавшие из каллусов, являются гаплоидными, поэтому для массового получения гаплоидов необходимо индуцировать пыльцевой эмбриогенез. В клетках культивируемых пыльников могут идти следующие процессы: 1) эмбриоидогене; 2) дедифференциация и каллусогенез; 3) возникают структуры шаровидной формы: из которых не регенерируют растения; 4) продолжение микроспорогенеза и гаметогенеза; 5) деградация микроспор. Растения-регенеранты: в том числе гаплоидные появляются благодаря двум первым процессам. При нормальном развитии пыльцы in vivo одноядерные микроспоры претерпевают асиммтеричное деление с образованием генеративной и вегетативной клеток. Вегетативная клетка в дальнейшем остается в состоянии покоя, тогда как генеративная клетка делится, образуя два спермия. В пыльцевых зернах на поздних стадиях запрограммирован гаметофиный путь с образованием спермиев. Только молодые микроспоры или пыльца, произошедшие непосредственно после первого митоза могут быть индуцированы для перехода на спорофитный путь развития in vitro. При выделении пыльников из цветочных бутонов и помещении их на питательную среду индуцируется спорофитный путь развития микроспор. Внутри пыльника происходят многочисленные деления микроспор и образуется многоклеточный комплекс, из которого формируются различные андрогенные структуры (глобулы, эмбриоиды), дающие начало гаплоидным растениям. Выяснено 4 основных пути андрогенеза: 1 путь. Микроспора делится на две идентичные дочерние клетки, которые способны к спорофитному развитию. В данном случае не происходит формирования вегетативных и генеративных клеток. 2 путь. Микроспора в результате неравного деления образует вегетативную и генеративную клетки. Спорофиты возникают в результате дальнейшего развития вегетативной клетки, а генеративная клетка дегенерирует. 3 путь. Эмбриоиды формируются только из генеративной клетки. В таких случаях вегетативная клетка либо вовсе не делится , либо делится до известного предела. 4 путь. Как и во втором случае, в результате деления одноядерной микроспоры образуются вегетативная и генеративная клетки, которые в дальнейшем делятся и участвуют в развитии спорофита. Затем возможно непосредственное формирование эмбриоидов или образование спорофитов путем регенерации из каллуса. 34. Важнейшим биотехнологическим методом получения гаплоидных растений является метод культуры пыльников. В основе метода лежит использование явления андрогенеза in vitro, заключающегося в образовании гаплоидного растения (спорофита) из микроспоры или клеток пыльцевого зерна (гаметофита), т.е. в переключении микроспоры с гаметофитного пути развития к спорофитному Известны несколько методов создания гаплоидов в культуре изолированных тканей растений, имеющих свои преимущества и недостатки: 1 ) использование (введение в культуру) гаплоидных тканей нативного растения (пыльники, пыльцевые зерна, семяпочки); 2) гаплопродукции - создание условий для получения гаплоидной ткани на интактном растении (отдаленная гибридизация, приводящая к элиминации (абортированию) одного из родительских генотипов), а затем доращивание недоразвитого семени или зародыша. Гут и Магешвари, впервые занявшиеся культурой пыльников, вызвали рост гаплоидных клеток действием кинетина, а рост диплоидных клеток -включением в среду ауксина, индолилуксусной кислоты (ИУК) с кинетином. Затем последовали сообщения разных авторов о получении ими гаплоидов риса, рапса, ячменя, паслена черного, томата, эгилопсов, спаржи и других культур. В 70-х гг. из пыльцевых зерен уже получили гаплоиды 23 видов 5 семейств и 4 межвидовых гибрида. В процессе культивирования пыльников в условиях in vitro имеет место андрогенез - развитие эмбриоидов, а затем и растений из мужских половых клеток (микроспор). Для большинства растений оптимальным сроком посадки пыльников на питательные среды является стадия «средних» или «поздних» одноядерных вакуолизированных микроспор. На этой стадии микроспоры высвобождаются из тетрад и готовятся к первому митозу. Для культивирования пыльников используют среды: Мурасиге-Скуга с 1/2 концентрацией солей, китайские среды, среды с картофельным экстрактом, среду Нич. Ауксины либо вообще не добавляют, либо используют 2,4-Д. Из цитокининов применяют кинетин и 6-БАП. Агар-агар тщательно промывают, так как он содержит вещества, неблагоприятно влияющие на развитие пыльников. Для адсорбции метаболитов, ингибирующих ростовые процессы в культуре тканей, в питательные среды добавляют активированный уголь. Перед культивированием пыльники выдерживают при температуре 4-6 С в течение 2-8 сут. Изолированные пыльники культивируют либо в темноте, либо при слабом освещении при температуре (25+2) С. На питательных средах микроспора может образовать каллус или гаплоидный зародыш (сначала формируется 40-50-клеточный проэмбрио). Зародыш в глобулярной стадии разрывает экзину и проходит стадии, аналогичные развитию зиготического зародыша. Пыльца делится, клетки увеличиваются, экзина разрывается и образуется каллус, на котором, варьируя соотношение фитогормонов, можно получить гаплоидные эмбриоиды. Получение гаплоидов биотехнологическими методами позволяет быстро создавать гомозиготные линии, что делает данную технологию весьма ценной для селекции и генетики. В процессе культивирования изолированных пыльников на питательных средах развитие идет двумя путями: либо прямым андрогенезом (образованием эмбриоидов и гаплоидных растений-регенерантов) (рис. 4.16), либо косвенным андрогенезом, когда репродуктивные клетки дедифферен-цируются и переходят к пролиферации, образуя сначала каллус, а затем при пассировании на специальные среды - морфогенный каллус и регенеранты. Схема формирования андрогенных эмбриоидов 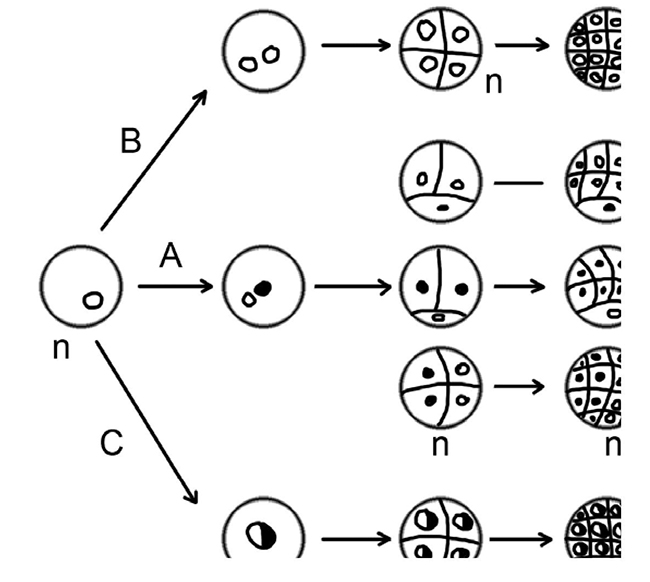 Побеги-регенеранты, полученные из пыльцевых каллусов, неоднородны по ряду морфологических признаков. Это обусловлено гетерогенностью каллусов. Поэтому необходимо проводить цитологическое изучение и каллусов, и растений-регенерантов. Как показали опыты, таким способом образуются не только гаплоидные, но и диплоидные и полиплоидные растения. Первые формируются из микроспор или из каллуса микроспоры, а диплоиды - из спонтанно удвоенных ядер, из клеток гаплоидного каллуса. У многих видов наилучший выход микроспор обеспечивается при предобработке культивируемых пыльников низкими температурами. У ячменя, например, обработка в течение 7-14 дней при 7 С дает оптимальные результаты. 35. Выращивание зародышей на искусственной питательной среде называется эмбриокультурой. Практические аспектыиспользования эмбриокультуры: *¾получение межвидовых и межродовых гибридов *¾сохранение важного для селекции материала путем культивированияin vitro потерявших всхожесть семян; *¾сокращение длительного селекционного процесса путем ускорения in vitro прохождения жизненного цикла растения. Экспериментальная гаплоидия – получение гаплоидных растений в условиях in vitro *Андрогенез *Гиногенез Гиногенез in vitro - процесс образования гаплоидного растения из клеток зародышевого мешка. Прямой гиногенез: Клетки зародышевого мешка=>эмбриоид=>гаплоидное растение. Непрямой гиногенез: Клетки зародышевого=>Каллус=> гаплоидное растение. Использование гаплоидов в генетических рабтах: *обнаружение рецесивных мутвций; *изучение взаимодейстаия генов; *определение групп сцепления *установление числа генов, действ. на количественные признаки. *установление локализации полигеннов; обнаружение редких рекомбинаций; обнаружение эуспрессии введенного извне генетического материала. Основные направления клеточной селекции in vitro: *отбор клеток устойчивых к гербицидам; *отбор клеток устойчивых к засолению; *отбор клеток устойчивых к экстремальным температурам; *отбор клеток устойчивых к патогенам; *отбор клеток, характеризующихся повышенным синтезом незаменимых аминокислот. Использование гаплоидов в селекционных работах: *удвоение числа хромосом=>чистые линии; *гибридизация с диплоидом=>гетерозис; *культура изолированных протопластов и клеток=>мутагенез и селекция ин витро=>регенерация растения=>выбор исходных форм для селекции. 36. Методы получения протопластов растительных клеток Протопласт - клетка, лишенная целлюлозной оболочки, окруженная цитоплазматической мембраной, сохраняющая все свойства, присущие растительной клетке. Впервые протопласты в 1892 г. выделил Дж. Клеркер, который использовал механический способ. При этом способе у плазмолированных клеток разрезают клеточную стенку, протопласты выходят в среду. В настоящее время метод претерпел модификации, улучшен, но имеет ряд ограничений: невысокая производительность, можно использовать ткани только с экстенсивным плазмолизом, трудоемкость и длительность. Другой метод выделения протопластов - энзиматический, с использованием ферментов. В 1952 году Салтон с помощью фермента лизоцима впервые разрушил клеточную стенку бактерий. В 1960 году Коккинг обработал кончики корней томата гидролитическим ферментом из культуральной жидкости плесневых грибов (Myrothecium verrucaria) и впервые получил изолированные протопласты высших растений энзиматическим способом. Преимущества энзиматического метода по сравнению с механическим: одновременно выделяется большое количество протопластов (до 10 млн. из грамма ткани или клеток), клетки не подвергаются сильному осмотическому стрессу, клетки не повреждаются, метод сравнительно быстрый. Для удаления клеточной стенки используют ферменты трех типов: целлюлазы, гемицеллюлазы и пектиназы. Комбинация ферментов и их соотношение специфично для каждого типа клеток. Выделение протопластов проводят в три этапа: обработка ферментами, выделение протопластов из клеточных стенок, отделение интактных протопластов от клеточных осколков. Стандартная методика протопластов (по Такебе) из тканей листа Nicotiana tabacum: Зрелый, сформировавшийся лист отделяют от взрослого растения в возрасте 60 - 80 дней, окунают в 70% этанол, а затем помещают на 15 - 20 минут в 10% раствор гипохлорита кальция и многократно промывают дистиллированной водой. С помощью пинцета нижний эпидермис снимают, очищенные от эпидермиса листья разрезают скальпелем на небольшие кусочки площадью 4 кв. см. Для лучшего снятия эпидермиса листья должны немного подвянуть, можно также ограничить снабжение водой перед срезанием листьев. Далее ткань обрабатывают последовательно или одновременно пектиназой, вызывающей мацерацию, и целлюлазой, разрушающей клеточные стенки. Оптимальная концентрация ферментов, как и время обработки, индивидуальны для разных тканей. Протопласты должны находиться в растворе ферментов минимальное количество времени, после чего следует тщательная промывка. Ферменты стерилизуют через бактериальные фильтры. Регуляция водообмена клетки связана с наличием клеточной стенки. Когда протопласт "голый", один из компонентов регуляции водообмена теряется, поэтому важное значение приобретают осмотические свойства среды выделения и культивирования. Среда должна быть немного гипертонической, чтобы протопласты находились в слегка плазмолизированном состоянии. Эти условия тормозят метаболизм и регенерацию клеточной стенки. В качестве осмотических стабилизаторов используют сахара (глюкозу, маннит, сорбит, ксилозу), ионные осмотики (CaCl2, KCl) в концентрации 0,3 - 0,8 моль/литр. Концентрации подбираются индивидуально для каждого растительного объекта. Удобнее обрабатывать ткани ферментами в чашке Петри, которую держат под углом 15о. Смесь ферментов с протопластами переносят в центрифужные пробирки. Отделить протопласты от ферментативной смеси можно двумя способами: либо фильтрация с центрифугированием, либо флотация. При фильтрации смесь пропускают через фильтры с размерами пор 40 мкм. На фильтре при этом остаются комки клеток и их большие осколки. При дальнейшем центрифугировании оседают протопласты, осколки остаются в супернатанте. При повторном центрифугировании идет отмывка от фермента, после чего протопласты переносятся в среду для культивирования. Метод флотации предложен О. Гамборгом с сотрудниками в 1981 году, и предназначается для ослабленных протопластов. Он основан на том, что протопласты имеют более низкую плотность, чем органеллы или остатки клеточных стенок. К исходной смеси добавляют раствор сахарозы и центрифугируют при скорости от 40 – 80 до 350 g. Чистые протопласты плавают, осколки оседают на дно. Протопласты можно выделять также из суспензионных и клеточных культур. Лучше всего - в поздней стадии логарифмического роста, когда клеточные стенки легче поддаются разрушению, протопласты наиболее жизнеспособны. Далее протопласты культивируют в тех же условиях, что и клетки. Состав солей может быть несколько изменен. Среда состоит из осмотического стабилизатора, неорганических соединений, источника углерода, азота, витаминов, фитогормонов. Условия культивирования: рН среды 5,4 - 5,8, температура 22 - 28оС, невысокая освещенность (не более 2000 лк). |
