Шпоры культура клеток органов и тканей. ККОИТ. 1. История развития метода культивирования клеток и тканей растений
 Скачать 1.38 Mb. Скачать 1.38 Mb.
|
|
Растения Растения Рис. 52. Возможные пути преобразования при культивировании изолированных тканей 47.Направление процесса органогенезаinvitro зависит от следующих факторов: таксономической принадлежности и генотипа исходного растения; онтогенетического возраста растения; локализации ткани, использованной в качестве экспланта; действия физических факторов при культивировании (температура, содержание кислорода, продолжительность и качество освещения); длительности культивирования; состава питательной среды. Зависимость от таксономической принадлежности наиболее хорошо прослеживается при сравнении особенностей культивирования изолированных органов и тканей у двудольных и однодольных растений. У двудольных растений каллусную ткань, способную к органогенезу, можно индуцировать не только из ме- ристематических клеток, но из вполне дифференцированных тканей листьев, стебля, корня. У однодольных растений для получения каллусной ткани в качестве эксплантов используют только ткани, содержащие меристематические клетки. Роль генотипа в проявлении морфогенной способности в культуре тканей хорошо изучена на примере разных сортов, изогенных и мутантных линий табака, моркови, цветной капусты, пшеницы, риса и других растений. Выявлены соответствующие доноры с высоким морфогенным потенциалом в культуреinvitro. Зависимость особенностей органогенеза от онтогенетического состояния растения установлена, в частности, при изучении особенностей культивирования листовых эксплантов эчеверии и табака. При культивировании молодых листьев указанных растений происходит образование корней. Из листьев, вычлененных из растений, средних по возрасту, индуцируется развитие и стеблевых почек, и корней. Из листьев, вычлененных из зрелых растений, развиваются только стеблевые почки. Такие различия в характере органогенеза при культивировании на средах одинакового состава определяются содержанием эндогенных фитогор- монов в тканях исходного экспланта. Уровень эндогенных фитогормонов определяет также зависимость между типом органогенеза и локализацией ткани, используемой в качестве исходного экспланта. При культивировании на среде одного и того же состава сегментов стебля, выделенных из разных частей цветущего растения табака, можно наблюдать проявление разных типов органогенеза. Из сегментов стебля, изолированных от базальной части, формируются вегетативные почки. Из сегментов, выделенных из средней части стебля, регенерируются вегетативные и цветочные почки в определенном соотношении. Из сегментов, изолированных из зон, близких к соцветию, развиваются только цветочные почки. Среди факторов питательной среды, влияющих на особенности регенерации в культуре ткани, наиболее важными в определении направления морфогенеза являются фитогормо- ны. В этом отношении классической является работа, выполненная Скугом и Миллером в 1957 г. Из сердцевинной паренхимы стебля цветущего растения табака была получена кал- лусная культура, клетки которой могут размножаться и расти на среде с ИУК и кинетином. При наличии в среде разного соотношения этих гормонов наблюдаются следующие особенности (рис. 5.4). Определенное превышение концентрации кинетина над ауксином в каллусной культуре приводит к образованию стеблевых почек и побегов. Увеличение концентрации ауксина приводит к развитию корней. Промежуточное соотношение концентраций этих фитогормонов поддерживает неорганизованный рост каллусной ткани. С увеличением продолжительности культивирования тканей утрачивается их способность к регенерации стеблевых и цветочных почек. Гораздо дольше сохраняется способность к ризогенезу. 48.С точки зрения биотехнологии соматический эмбриогенез имеет много преимуществ перед органогенезом. Регенерант на основе соматического зародыша полностью сформирован, тогда как побеги, полученные в результате органогенеза надо укоренять» а лишний труд неэкономичен для биотехнологии. Соматический эмбриогенез незаменим и для фундаментальных исследований. Дело в том, что тонкие механизмы морфогенеза в настоящее время представляются еще в некоторой степени «черным ящиком». С помощью суспензионных культур, с которыми чаще всего связано культивирование соматических эмбриоидов, исследователь может получить много информации о сигналах и белках-акцепторах, экзогенных стимуляторах и нативных эндогенных гормонах, участвующих в морфогенезе. Различают прямой и непрямой пути соматического эмбриогенеза. Прямой соматический эмбриогенез заключается в формировании вегетативного зародыша из одной или нескольких клеток тканей экспланта без стадии образования промежуточного каллуса. Такое явление наблюдается у цитрусовых. У них в одном семени может развиваться до 40 зародышей. Обычно один зародыш зиготический. Он формируется от слияния половых клеток и несет признаки и отцовского и материнского организмов. Остальные зародыши — неполовые (соматические) — развиваются из клеток нуцеллуса, окружающих зародышевый мешок, и несут признаки только материнского организма. Способность к полиэмбрионии у цитрусовых используется для их клонального размножения. Нуцеллус изолируют и культивируют in vitro в условиях, в которых происходит индукция образования эмбриоидов из отдельных клеток. Непрямой соматический эмбриогенез заключается в формировании зародышей из клеток каллусной ткани или суспензионной культуры. В отличие от стеблевых почек соматические зародыши — это независимые двухполюсные структуры, физически не прикрепленные к ткани, из которой они происходят. Кроме того, соматические эмбриоиды, в отличие от органогенеза побегов, более точно воспроизводят генотип исходного растения. Процесс соматического эмбриогенеза можно разделить на две стадии: 1. Начальная клеточная фаза, которая менее других изучена и наиболее важна, — это первичные процессы в проэмбриогенных клетках, связанные с их переходом в детерминированное состояние. Данный этап не характерен для зиготы, развивающейся из зародышевого мешка. 2. Переход к эмбриогенезу или развитию зародыша in vitro. Этот этап включает стадии, аналогичные стадиям при зиготическом эмбриогенезе: стадии глобулы, сердца, торпедо и сформированного проростка. Морфологически такие стадии практически одинаковы in vivo и in vitro. Факторами, индуцирующими соматический эмбриогенез, являются фитогормоны. Наиболее эффективен ауксин 2,4-Д, однако он необходим только для детерминации клеток. Развивающиеся зародыши не нуждаются в гормонах, так как начинают вырабатывать их сами. Длительное пребывание проэмбрио в среде, содержащей ауксин, приводит к пролиферации клеток, составляющих эмбриональный комплекс, и к прекращению диффе¬ренциален эмбриоидов, т. е. они снова превращаются в каллусные клетки (рис. 5.5). Эмбриогенный каллус, пересаженный на среду без ауксина или с пониженным его содержанием, образует эмбриоиды. Эмбриоиды, перенесенные на безгормональную среду, дают проростки. Независимость соматического эмбриогенеза от гормонов является аргументом в пользу точки зрения о том, что сам процесс изолирования растительной клетки от организма стимулирует реализацию ее тотипотентности, т. е. переход к морфогенезу. Рис. 5.5. Схема соматического эмбриогенеза в культуре клеток 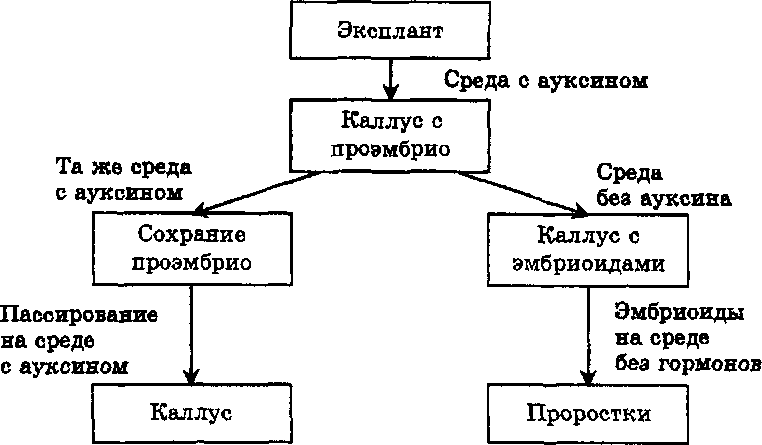 49. Растения являются незаменимым источником получения очень многих практически важных веществ. При этом следует подчеркнуть, что промышленное получение некоторых соединений, например, сердечных гликозидов, флавоноидов, кумаринов, эфирных масел достигается только путем выделения их из растительного сырья. Между тем возможности получения так называемых " метаболитов интереса" в достаточном количестве зачастую ограничены. Это связано с сокращением ресурсов некоторых ценных дикорастущих растений, принадлежностью многих лекарственных растений к группам эндемов, редким и исчезающим видам. В связи с этим большой интерес в качестве источника биологически активных веществ представляют культуры растительных клеток. Культуры растительных клеток могут синтезировать самые разнообразные по химической природе вещества. Среди них эфирные масла, фенольные соединения, алкалоиды, стероиды, терпеноиды и др. Но несмотря на то, что биомасса культивируемых клеток с начала 80-х годов используется в качестве источника экономически важных продуктов, ряд трудностей и нерешенных вопросов сдерживает широкомасштабное применение культивируемых клеток, обусловливает нерентабельность биотехнологических производств многих ценных видов растений. Содержание практически важных вторичных метаболитов в высших растениях определяется активностью их синтеза, эффективностью транспорта и депонирования в органах запаса растения. Все эти признаки определяются генетически, находятся под контролем развития организма и максимально реализуются в оптимальных внешних условиях. Неотселектированные дедифференцированные клетки накапливают, как правило, незначительное, по сравнению с интактным растением, количество веществ специализированного обмена. Только благодаря правильно разработанной стратегии получения высокопроизводительных штаммов к настоящему времени получены культуры тканей, в которых содержание вторичных продуктов достаточно велико, чтобы служить лекарственным сырьем. Однако для многих культур неоднократные попытки различных исследователей определить условия накопления продуктов, характерных для родительских растений, были неудачными. Важной характеристикой клеточной популяции является ее стабильность в отношении синтеза, транспорта и депонирования метаболитов " интереса". Стабильность может сохраняться в течение всего времени существования популяции. При этом сохраняются и активно работают гены синтеза, системы транспорта и депонирования. Возможен случай постепенного (в течение нескольких лет) увеличения числа клеток со сниженным синтезом метаболитов. И, наконец, в случае полной нестабильности клетки популяции очень быстро теряют свой биосинтетический потенциал. Вопрос о стабильности и нестабильности тесно связан с изучением биологии клеток разных популяций. В организме растения синтез метаболитов, их транспорт и отложение в запас на ходятся под строгим контролем развития. Часто эти события не только разведены во времени, но и происходят в разных органах растения. Клетка вне организма обычно не транспортирует метаболиты в соседние клетки или в питательную среду, хотя в ряде случаев это явление наблюдается (биосинтез алкалоидов в клеточных культурах мака). На выход вторичных продуктов в культурах растительных клеток влияют многие факторы, однако все способы регуляции вторичного метаболизма в культуре in vitro можно разделить на две группы: физиологическая и генетическая регуляции синтеза вторичных метаболитов. 50. Особый интерес для человека представляют те биологически активные соединения, которые могут быть использованы в медицине, технике, пищевой и парфюмерной промышленности, сельском хозяйстве. Если для получения ценных БАВ традиционно использовались целые организмы (микроорганизмы, растения, животные), то современная биотехнология нацелена на клеточные технологии, основанные на культивировании свободных и иммобилизованных клеток. Как альтернативные источники БАВ растительного происхождения клеточные культуры обладают следующими преимуществами: получение экологически чистых продуктов независимо от климата, сезона, погоды; создание клеточных линий-сверхпродуцентов путем генетических манипуляций; сохранение пула генов редких и исчезающих растений- продуцентов; возможность оптимизировать и стандартизировать условия выращивания; возможность автоматизации процессов. На рис. 6.1. показаны основные аспекты применения культур клеток растений в качестве продуцентов БАВ.  Благодаря усилиям многих исследователей накоплено немало ценной информации о способности культивируемых растительных клеток синтезировать многие традиционные экономически важные продукты: терпеноиды, гликозиды, полифенолы, полисахариды, эфирные масла, необычные пептиды и специализированные белки, натуральные красители, стероиды, пряности, инсектициды, воски, витамины. Также доказана возможность культур клеток осуществлять биотрансформацию. Эти «полупродукты» вторичных метаболитов не могут быть преобразованы химическим или микробиологическим путем, и только благодаря активности ферментов клеток растений в культуре происходит их превращение в ценный конечный продукт. Перевод клеток в условияinvitro может также приводить к синтезу совершенно новых соединений с принципиально другим механизмом действия. Например, японские исследователи добились успехов в получении таких новых БАБ, как необычные пептиды, антиканцерогенные соединения, убихинон-10 и др. 51. Строение биореактора для выращивания биомассы клеток-продуцентов Для создания оптимальной биореакторной системы необходимо точно придерживаться следующей генеральной линии: 1. Биореактор должен быть сконструирован так, чтобы исключить попадание загрязняющих микроорганизмов, а также обеспечить сохранение требуемой микрофлоры. 2. Объем культивируемой смеси должен оставаться постоянным, т. е. чтобы не было утечки или испарения содержимого. 3. Уровень растворенного кислорода должен поддерживаться выше критических уровней аэрирования культуры аэробных организмов. 4. Параметры внешней среды, такие, как температура, рН и т. п., должны постоянно контролироваться. 5. Культура при выращивании должна хорошо перемешиваться. К материалам, используемым при конструировании сложных биореакторов, предъявляются определенные требования: а) все материалы, вступающие в контакт с растворами, подающимися в биореактор, соприкасающиеся с культурой микроорганизма, должны быть устойчивыми к коррозии, чтобы предотвратить загрязнения металлами даже в следовых количествах; б) материалы должны быть нетоксичными, чтобы даже при самой малой растворимости они не ингибировали рост культуры; в) компоненты и материалы биореактора должны выдерживать повторную стерилизацию паром под давлением; г) перемешивающая система биореактора и места поступления и выхода материалов и продуктов должны быть легко доступными и достаточно прочными, чтобы не деформироваться или ломаться при механических воздействиях; д) необходимо обеспечить визуальное наблюдение за средой и культурой, так что материалы, используемые в процессе, по возможности должны быть прозрачными. Важным классификационным принципом биореакторов различного типа являются системы перемешивания. По способу перемешивания и аэрации биореакторы подразделяются на аппараты с механическим, пневматическим и циркуляционным перемешиванием. Аэрация может осуществляться также путем барботажа - подачи воздуха снизу через горизонтальную трубку с отверстиями, иногда аэрирование достигается применением специальных вибраторов, которые обеспечивают высокую степень асептики, малый расход энергии и относительно слабо травмируют клетки. Теплообмен в биореакторах осуществляется с помощью труб с охлаждающим или нагревающим агентом, которые оплетают аппарат и образуют так называемую рубашку реактора. Иногда эта система труб располагается непосредственно в полости ферментера. Нагревающими агентами в промышленных биореакторах служат горячая вода или пар, в лабораторных ферментерах чаще используется электрический подогрев. Система пеногашения биореактора – это средство борьбы с избыточным пенообразованием. Существуют химические, механические, акустические и другие виды пеногашения. Наиболее часто применяют химические и механические способы. К химическим средствам пеногашения относятся поверхностно активные вещества, которые, внедряясь в стенки пузырей, становятся центрами их неустойчивости. Эффективными пеногаситслями служат растительные масла и животные жиры. Недостатком этих пеногасителей является то, что при их утилизации микробными клетками сами по себе способствуют пенообразованию. Механические пеногасители представляют собой различные устройства, сбивающие пену: диски, лопасти, барабаны, располагающиеся в верхней части реактора. Более сложными приспособлениями являются сепараторы пены, которые одновременно служат для сбора биомассы, содержащейся в пенном слое. Устройства и режим стерилизации определяется конструкцией биореактора, вспомогательного оборудования, используемых питательных сред и т. п. Наибольшее значение имеют термический метод стерилизации оборудования и сред и фильтрационный способ, применяемый для удаления микроорганизмов из подаваемого в ферментеры воздуха или другого газа. 52.Режимы культивирования растительных клеток в биореактора Биореактор - изолированная система , в которую вместе с другими материалами вводят биологические агентыи в результате протекающей реакции происходит их размножение илиобразование других веществ. современные биореакторы должны обладать следующими системами: • эффективного перемешивания и гомогенизации среды выращивания; • обеспечения свободной и быстрой диффузии газообразных компонентов системы (аэрирование в первую очередь); • теплообмена, обеспечивающего поддержание оптимальной температуры внутри реактора и ее контролируемые изменения; • пеногашения; • стерилизации сред, воздуха и самой аппаратуры; • контроля и регулировки процесса и его отдельных этапов. При разработке новых биотехнологических процессов сначала прибегают к периодическому культивированию. Периодическое культивирование включает несколько этапов: стерилизацию сред и оборудования, загрузку биореактора питательной средой, внесение посевного материала, выращивание культуры, отделение и очистку готового продукта. После окончания последнего этапа производится мойка биореактора и подготовка его к новому циклу. Довольно широко в биотехнологии используется периодическое культивирование с подпиткой, при котором, помимо первичного внесения питательного субстрата до засева культуры, в процессе культивирования в аппарат через определенные интервалы добавляют питательные вещества либо порциями, либо непрерывно "по каплям". Существует также отъемно-доливочное культивирование, когда часть содержимого биореактора периодически изымается и добавляется равное количество питательной среды. Такой прием обеспечивает регулярное "омолаживание" культуры и задерживает ее переход в фазу отмирания. Этот прием иногда называется полунепрерывным культивированием. Модификацией периодического культивирования является культивирование с диализом, при котором питательный субстрат постоянно поступает в реактор через специальную мембрану. Диализ ведет к снижению концентрации продуктов жизнедеятельности клеток, неблагоприятно влияющих на их жизнеспособность. Помимо этого, диализ удаляет из культуры часть жидкости, что позволяет получать в конце процесса концентрированную биомассу. В непрерывных процессах культивирования клетки постоянно поддерживаются в экспоненциальной фазе роста. С этой целью в биореактор подается свежая питательная среда и обеспечивается отток из него культуральной жидкости, содержащей клетки и продукты их жизнедеятельности. Основным принципом непрерывных процессов (как уже отмечалось выше) является точное соблюдение равновесия между приростом биомассы вследствие деления клеток и их убылью в результате разбавления содержимого свежей средой. Различают хемостатный и турбидостатный режимы непрерывного культивирования. При хемостатном режиме культивирования саморегулируемая система возникает в силу следующих причин: если первоначальное поступление свежей питательной среды и вымывание биомассы превышает скорость деления клеток, то в результате разбавления культуры снижается концентрация веществ, ограничивающих ростовые процессы и скорость роста культуры повышается; увеличивающаяся популяция начинает активнее "выедать" субстрат, что в свою очередь приводит к торможению роста культуры. Конечным итогом этих процессов является (после серии затухающих колебаний) установление равновесия между скоростью ростакультуры и ее разбавлением. Турбидостатный режим культивирования базируется на прямом контроле концентрации биомассы. Наиболее распространенным методом ее определения является измерение светорассеивания с помощью фотоэлементов. Повышение концентрации клеток и соответственно оптической плотности автоматически ускоряет проток жидкости и наоборот. По своей конструкции турбидостаты отличаются от хемостатов лишь системами контроля скорости протока. Хемостаты применяются в процессах, характеризующихся малым протоком, когда концентрация клеток изменяется незначительно с изменением скорости протока, что облегчает саморегулировку системы. Турбидостаты используются в процессах, характеризующихся высокой скоростью разбавления при быстром и резком изменении концентрации биомассы. |
