Шпоры культура клеток органов и тканей. ККОИТ. 1. История развития метода культивирования клеток и тканей растений
 Скачать 1.38 Mb. Скачать 1.38 Mb.
|
|
Хлоропластная и митохондриальная ДНК Хлоропласты и другие пластиды обладают одинаковой генетической информацией, так называемым пластомом. У высших растений он представляет собой замкнутую молекулу ДНК длиной 150 т. н. п. Для синтеза пластид необходимо значительно больше белков. Остальные белки кодируются ядром, синтезируются в цитоплазме и поступают в хлоропласты. Некоторые важнейшие белки хлоропластов состоят из нескольких субъединиц, часть из них синтезируется на рибосомах цитоплазмы и транспортируется в хлоропласт, где они объединяются с другими полипептидами, закодированными в самом хлоропласте и там же синтезируемыми. Таким образом, для биосинтеза функционально активного хлоропласта требуется согласованная экспрессия генома и пластома. В составе митохондриальной ДНК имеются структурные гены, кодирующие полипептиды, гены рибосомных и транспортных РНК. Однако большая часть белков митохондрий, как и хлоропластов, кодируется ядерными генами. Но если геном хлоропластов представлен гомогенной популяцией крупных кольцевых молекул, то в митохондриях содержится несколько классов кольцевых молекул. Транспозоны (см.90) - сегменты ДНК, которые контролируют собственную транспозицию (перемещение) из одного сайта ДНК в другой путем вырезания из исходного сайта и внедрения в новый сайт хромосомы или плазмиды. Механизм перемещения фрагментов ДНК по геному до конца не выяснен. ДНК переносится ферментом транспозазой. Он специфически взаимодействует с концевыми инвертированными повторами мобильного элемента и может вырезать его из хромосомы. Вырезание может происходить точно – с восстановлением исходной структуры участка ДНК, и неточно, то есть с делециями и вставками от одного до нескольких нуклеотидов. Это приводит к появлению стабильных мутаций и является одним из механизмов создания новых последовательностей ДНК. Биологический смысл перемещения отдельных сегментов ДНК: - прерывание соответствующего гена, что ведет к эволюции; - регуляция деятельности генов, так как транспозоны могут нести сигналы для начала считывания генов. В новых областях усиливают или запрещают работу гена. Транспозоны также участвуют в горизонтальном переносе генов. Бактериальные плазмиды Основная масса клеточной ДНК бактерий содержится в хромосоме. Однако кроме хромосом бактерии содержат большое количество очень маленьких кольцевых молекул ДНК плазмид длиной несколько тысяч пар оснований. Такие мини-хромосомы называют плазмидами. Как правило, плазмиды имеют в своем составе гены устойчивости к антибиотикам, ионам тяжелых металлов (R-плазмиды), а также гены, контролирующие катаболизм некоторых органических соединений (плазмиды биодеградации, или D-плазмиды). Поскольку эти гены находятся в плазмидах, они представлены гораздо большим числом копий. Высокая копийность плазмид обеспечивает клетке синтез большого количества ферментов, химически нейтрализующих антибиотики или ксенобиотики, что и обеспечивает устойчивость к последним. Поскольку плазмидная ДНК значительно меньше хромосомной, ее довольно легко выделить в чистом виде. В присутствии ионов кальция плазмиды легко поглощаются бактериями-рецепиентами, даже если те их никогда не содержали, и в клетках бактериального потомства можно обнаружить много копий поглощенной плазмиды. Однако бактериальная клетка обычно может содержать в своем составе плазмиды одного типа. Это явление несовместимости плазмид. Существуют группы несовместимости – Inc-группы. В такой группе может быть несколько плазмид, совместимых между собой, но не совместимых с другими плазмидами. У этих плазмид сходны многие признаки и часто значительна гомология ДНК. 88 Векторные системы на основе агробактериальных плазмид: преимущества и недостатки Молекулярно-генетические механизмы агробактериальной трансформации Процесс трансформации можно разделить на четыре этапа: прикрепление бактерии к стенке растительной клетки, проникновение Т-ДНК внутрь клетки растения, интеграция Т-ДНК в геном растения и экспрессия Т-ДНК. Индукция начальных этапов трансформации может происходить только в месте раневого повреждения растения, где выделяются низкомолекулярные фенольные соединения (например, ацетосирингон), углеводы (например, глюкоза и глюкуроновая кислота) и где образуется кислый рН. Весь процесс вырезания и интеграции Т-ДНК в растительную хромосому осуществляют продукты генов, локализованных в vir-области. Восприятие раневых сигналов осуществляют белки VirA и ChvE. ChvE, белок, кодируемый хромосомным геном бактерии, чувствует присутствие ацетосирингона и изменяет способность VirA отвечать на фенольные соединения. VirA является гистидиновой протеинкиназой, способной к аутофосфорилированию, он дважды пронизывает внутреннюю мембрану бактериальной клетки и выступает в качестве донора фосфора белку VirG. Фосфорилированный VirG активирует транскрипцию остальных vir-генов. Индукция vir-генов обратима, что очень важно для патогена: в случае, если хозяин - больной и нежизнеспособный организм, перенос Т-ДНК не осуществляется. Оперон VirD кодирует несколько продуктов. Один из них является двухкомпонентной эндонуклеазой. Область Т-ДНК окружена одинаковыми повторами длиной 25 пар оснований. Эти последовательности являются сайтами узнавания VirD-эндонуклеазы, режущей точно между 3-м и 4-м основаниями 25 пар оснований повтора. Эта эндонуклеаза ответственна за вырезание Т-ДНК. Белки VirB и VirE необходимы для транспорта Т-ДНК из бактерии в растение. Внедрение Т-ДНК в растительный геном является многоступенчатым процессом. В геном растения могут встраиваться несколько копий Т-ДНК. После встраивания в хромосому Т-ДНК становится обычной частью генома растения. Т-ДНК транскрибируется в растительных клетках РНК-полимеразой II растения-хозяина. Транскрипты имеют особенности эукариотических матриц. Сама бактерия в клетку не проникает, а остается в межклеточном пространстве и использует растительные клетки со встроенной Т-ДНК как фабрику, продуцирующую опины - источник азота и углерода. Днк ti-плазмиды можно использовать в качестве вектора Т-ДНК Ti-плазмид обладает двумя свойствами, делающими ее по существу идеальным вектором для введения чужеродных генов в клетки растений. Во-первых, круг хозяев агробактерий очень широк: они трансформируют клетки практически всех двудольных растений. Во-вторых, интегрированная в состав генома растения Т-ДНК наследуется как простой доминантный признак в соответствии с законами Менделя, а ее гены имеют собственные промоторы (регуляторная область гена, определяющая время и место его экспрессии), под контролем которых могут экспрессироваться вставленные в Т-ДНК чужеродные гены. Простейший способ введения Т-ДНК в клетки растения состоит в том, чтобы заразить его A. tumefaciens, содержащей подходящую Ti-плазмиду, и предоставить дальнейшее естественному ходу событий. Однако размеры целой Ti-плазмиды существенно больше размеров молекул, обычно используемых в работе с рекомбинантной ДНК. Чтобы преодолеть эту трудность, разработан следующий подход. Прежде всего Т-сегмент вырезают из Ti-плазмиды с помощью рестриктаз и встраивают в один из стандартных плазмидных векторов для размножения в клетках бактерий - Escherichia coli. E. сoli содержит плазмиду pBR322, которая способна к саморепликации, то есть размножению, приводящему к увеличению числа ее копий. После того как в плазмиду pBR322 внедрили участок Ti-плазмиды, это рекомбинантная структура может затем реплицироваться многократно, что приводит к увеличению числа копий участков Ti-плазмиды. Этот процесс называется клонированием. Бактерии, содержащие плазмиду pBR322 с участком Т-ДНК, размножают, после чего эту плазмиду выделяют. Затем с использованием рестриктаз и стандартных приемов работы с рекомбинантной ДНК в Т-сегмент встраивают определенный ген. Этот молекулярный гибрид, теперь уже содержащий Т-ДНК со встроенным в нее геном, снова размножают в E. сoli, а затем вводят в клетки A. tumefaciens, несущие соответствующую полную Ti-плазмиду. В результате обмена идентичными участками (гомологичная рекомбинация) между Т-сегментами нативной и сконструированной Ti-плазмид Т-ДНК со встроенным чужеродным геном включается в Ti-плазмиду, замещая нормальную Т-ДНК. Таким образом, мы получаем клетки A. tumefaciens, несущие Ti-плазмиду со встроенным в Т-сегмент нужным геном. Последний этап заключается в заражении растений этими модифицированными генно-инженерными методами агробактериями. Клетки полученных трансгенных растений будут содержать интегрированную Т-ДНК со встроенным чужеродным геном. В целом идеальная векторная система на основе Ti-плазмиды должна: 1) содержать все сигналы, необходимые для переноса и стабильной интеграции в ядерную ДНК растений; систему для экспрессии чужеродных генов в растениях (узнаваемый растительными полимеразами промотор), маркер, который необходим для селекции трансформированных клеток; 2) не содержать онкогенов, то есть генов, которые подавляют дифференцировку растительных клеток. Кроме того, при конструировании векторных молекул должно быть предусмотрено наличие промоторов, работающих в растениях. Промотор (участок, к которому присоединяются РНК-полимеразы) должен обладать набором свойств, а именно: силой (активной экспрессией), возможностью регуляции, ткане- и органспецифической экспрессией. 89. Векторные системы на основе вирусных геномов: преимущества и недостатки В качестве векторов могут также использоваться вирусы растений. Их нуклеиновые кислоты реплицируются и проявляют свои функциональные свойства (экспрессируют) в клетках растений-хозяев, где потенциал вирусов и воспринимающих клеток объединяется и реализуется в приумножении организованных частиц патогена (например, для вируса мозаики табака в среднем 10 7 частиц на клетку, для вируса мозаики цветной капусты — порядка 10, 4 частиц на клетку). В последнее время, на роль векторов для переноса генов в растения, рассматривают ДНК-содержащие вирусы растений. Лучше изученным является вирус мозаики цветной капусты CaMV (cauliflower mozaic virus), который поражает в основном растения семейства крестоцветных. Частицы этого вируса имеют диаметр около 50 нм и содержат кольцевую ДНК размером 8 кб. Небольшой размер генома CaMV дает возможность манипулировать in vitro с вирусной ДНК, как с бактериальных плазмид, а затем ввести его в растения путем втирания в листья. Инфицирование незначительного количества клеток приводит к заражению всего растения, так как вирус быстро распространяется, передаваясь от клетки к клетке. При использовании 1-5 мкг клонированной ДНК для инфицирования одного растения путем механической инокуляции достигается почти 100%-ная эффективность инфекции. Для клонирования ДНК CaMV в E. coli используют плазмидные векторы E. coli, например, рВR322. После обработки соответствующими рестриктазами ДНК CaMV и рВR322 и лигирование образуется гибридная плазмида, которая способна к амплификации в E. coli. Среди преимуществ векторных систем на основе вирусов следует отметить малый размер генома, что дает возможность легко манипулировать вирусной ДНК и высокую копийность вирусной ДНК в клетках зараженных растений (до 50000 на клетку). Недостатками этих векторных систем является небольшая емкость вектора (менее 800 п.н.) и ограниченный круг хозяев – крестоцветные, они патогенны. Но следует отметить, что сильные вирусные промоторы могут использоваться для экспрессии чужеродных генов в других векторных системах. Например, промотор 35S вируса мозаики цветной капусты является сильным промотором, который не проявляет тканиноспецифичности экспрессии и активен не только в клетках крестоцветных, но и в клетках растений других семейств. Геном вирусов включает: – Структурные гены, которые кодируют белки. Занимают примерно 95 % вирусной хромосомы. Белки вирусов можно разделить на несколько групп: структурные, ферменты, регуляторы. – Регуляторные последовательности, которые не кодируют белки: промоторы, операторы и терминаторы. – Прочие некодирующие участки (сайты), в том числе: – участок attP , обеспечивающий интеграцию вирусной хромосомы в хромосому клетки–хозяина; – участки cos – липкие концевые участки линейных вирусных хромосом, обеспечивающие замыкание линейной хромосомы в кольцевую форму. 90. Векторные системы на основе вироидов и транспозонов: преимущества и недостатки В качестве векторных систем могут быть использованы также и вироиды, представляющие собой однонитевые цепи ковалентно связанных кольцевых РНК, включающих 270—300 нуклеотидов, лишенных оболочки. Вироиды поражают виноград, картофель, кокосовую пальму, томаты и другие растения как по вертикали (через зародышевые клетки), так и по горизонтали (распространяются по растительному организму через клеточный сок или переносятся механически). Вироиды заражают персиситентно (не происходит выздоровления). Вызывают системную инфекцию, т.е. мигрируют из сайта внедрения в другие части растений, переносятся механически или через клеточный сок, через семена, пыльцу. Вироиды также связаны с ядерными фракциями растений и могут размножаться в ядрах. При работе с вироидами получают 1-нитевую ДНК-копию РНК и достраивают комплементарную нить для получения 2-нитевой ДНК вироида. Такая 2-цепочечная ДНК вcтраивается в плазмиду и передается в клетки E. coli для клонирования. Считывание гена начинается с промотора, который узнается РНК-полимеразой, отвечающей за транскрипцию ДНК в матрицу РНК. Обычно это фрагмент ДНК из 41-44 пар оснований. Ген считывается слева направо, от 5’ к 3’ концу гена и заканчивается в терминальной области гена. За промотором начинается стартовый сайт транскрипции, за которым следует смысловая часть гена. Промоторная область гена содержит определенные короткие сочетания нуклеотидов, характерные для бактериальных генов, или для генов высших организмов. Такие сочетания служат сигналами для РНК-полимеразы, которая присоединяется к промоторной части гена и начинает его считывать. Однонитевые и двунитевые ДНК способны инициировать репликацию вироида в механически инокулированных растениях табака. Энзиматически in vitro синтезированы также РНК вироидов, высокоинфекционные для растений. Векторные системы могут быть разработаны на основе самих РНК, на основе вироидоспецифичных ДНК, а также в комбинации вироидоспецифичных ДНК с Ti-плазмидами. Вироиды инфицируют своих хозяев в течение всего их жизненного цикла, поэтому в случае использования вироидных векторных систем можно ожидать постоянной экспрессии чужеродного гена в растении. Транспозоны - сегменты ДНК, которые контролируют собственную транспозицию (перемещение) из одного сайта ДНК в другой путем вырезания из исходного сайта и внедрения в новый сайт хромосомы или плазмиды. Впервые были открыты в 40-х годах американской ученой Барбарой Мак-Клинток у кукурузы. Эти гены, индентифицированные по их способности подавлять экспрессию других генов кукурузы, находящихся рядом с ними, не имели фиксированного положения в хромосоме. Они как бы передвигались по всему геному растения. Регуляторные элементы могли встраиваться и выщепляться, причем после их выщепления зачастую начинали функционировать ранее молчащие гены. Оказалось, что гены, ассоциированные с регуляторными элементами, становились нестабильными и часто мутировали из-за нестабильности самих этих элементов. В течение многих лет кукуруза оставалась единственной системой, в которой обнаруживались такие подвижные генетические элементы. Механизм перемещения фрагментов ДНК по геному до конца не выяснен. ДНК переносится ферментом транспозазой. Фермент кодируется последовательность длиной около 20 нуклеотидов в середине транспозона. Он специфически взаимодействует с концевыми инвертированными повторами мобильного элемента и может вырезать его из хромосомы. Вырезание может происходить точно – с восстановлением исходной структуры участка ДНК, и неточно, то есть с делециями и вставками от одного до нескольких нуклеотидов. Это приводит к появлению стабильных мутаций и является одним из механизмов создания новых последовательностей ДНК. Биологический смысл перемещения отдельных сегментов ДНК: - прерывание соответствующего гена, что ведет к эволюции; - регуляция деятельности генов, так как транспозоны могут нести сигналы для начала считывания генов. В новых областях усиливают или запрещают работу гена. Транспозоны также участвуют в горизонтальном переносе генов. У бактерий были обнаружены 2 класса подвижных генов, различающихся по длине и сложности организации. 1. Инсерционные последовательности, или 1S элементы, имеющие длину около тысячи пар нуклеотидов и содержащие только ген, отвечающий за их перемещение. 2. Транспозоны, длиной от 3 до 20 т. н. п., состоящие из ряда дополнительных генов, отвечающих за устойчивость бактерий к различным токсическим веществам. Перенос генов при помощи транспозонов имеет большие преимущества, так как он происходит с высокой частотой и не влечет значительных перестроек интегрируемой ДНК. Кроме того, этим методом можно переносить достаточно большие фрагменты ДНК. 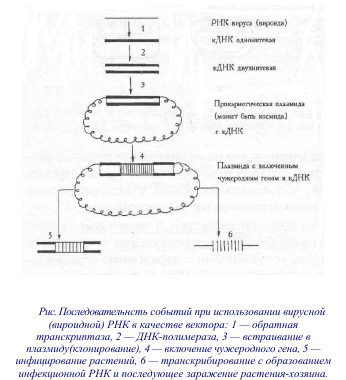 |
