Шпоры культура клеток органов и тканей. ККОИТ. 1. История развития метода культивирования клеток и тканей растений
 Скачать 1.38 Mb. Скачать 1.38 Mb.
|
|
79. Общие принципы разработки векторных конструкций для генетической трансформации растений Важным этапом работы по генетической трансформации растений является выделение и клонирование генов, создание на их основе векторов для переноса чужеродных генов из клеток-доноров в клетки-раципиенты. Использование плазмидных, транспозонных, вирусных, пневмобалли-стических и других векторных систем позволяет исследователям осуществлять трансформацию растительных генотипов и получать трансгенные (модифицированные) растения с заданными или близкими к ним свойствами и качественными характеристиками. В начале восьмидесятых годов были сделаны первые попытки перенести чужеродные последовательности ДНК в растительные клетки либо с помощью транспозонного мутагенеза, либо путем сайт-специфической миграции генов в тДНК и последующей двойной рекомбинацией с Ti-плазмидой дикого типа. Однако, эти ранние эксперименты, основанные на двойной рекомбинации,занимали много времени, были довольно сложны и трансформации проходили с очень низкой частотой. Необходимо было разработать более эффективные векторы, чтобы облегчить генетические манипуляции с бактериями и позволить селекцию и регенерацию трансформатов. Сейчас используют две принципиально разные системы для введения чужеродных генов в растения с помощью Ti-плазмид: векторы бинарные векторы. В основе создания векторов лежит тот факт, что гены тДНК не для растительных клеток, и любая последовтельность ДНК, встроенная между границами тДНК, может интегрировать в хромосому растительной клетки и нормально там экспрессироваться. В векторых системах тДНК можно заменить, например, на последовательность pBR322, а чужеродную ДНК, которую предполагается перенести в растения,нужно проклонировать в этом же векторе. Затем путем гомологичной рекомбинации эта чужеродная ДНК может быть перенесена на Ti-плазмиду реципиентного штамма агробактерии Одним из первых таких векторов на основании Ti-плазмид авляется pGV3850. В нем все гены, ответственные за синтез фитогормонов, были заменены на последовательность pBR322.ДНК pBR322 обеспечивала гомологию для области тДНК pGV3850 с любыми производыми pBR, несущими клонированный ген. Гены, кодирующие различные маркерные белки для быстрого отбора трансгенных растений, были встроены в pGV3850 [De Blocle, 1984]. Была разработана система трехродительного скрещивания для переноса любых производных pBR322 из E. coli в A. tumefaciens pGV3850. В настоящее время сконструированы и успешно используются и другие векторы на основе Ti-плазмид. Схемы (А) и бинарной (Б) векторных систем. vir – область вирулентности. HOM – области гомологии, в пределах которых может происходить рекомбинация, приводящая к образованию коинтегратов. LB и RB –левая и правая границы тДНК. MCS -сайт для клонирования. РТМ –маркет трансформации для растений. RES – маркер устойчивости к антибиотику для бактерий. OriT – начало переноса и bom-сайт для мобилизации векторов при конъюгации. Col E1 – начало репликации из плазмиды Col E1. RK2 – начало репликации из плазмиды широкого круга хозяев RK2. Система бинарных векторов основана на том, что область тДНК и гены vir могут распологаться на разных плазмидах. В таких системах обычно присутствуют два элемента: Ti-плазмида-помощник, в которой тДНК польностью делетирована. Эта плазмида несет в своем составе гены vir, действующие in trans. Плазмида широкого круга хозяев, имеющая сайты для клонирования и маркерные гены для селекции растений, ограниченные правой и левой фланкирующими последовательностями тДНК Обе описанные выше системы векторов предполагают --------- этапах сборку нужных конструкций в промежуточных векторах, например в pAP2034 или pRT103 а затем перенос из в готовом виде в рецепиентные штаммы агробактерий. 80. Генетическая трансформация растений in vitro с помощью Agrobacterium spp. Агробактериальная трансформация Использование Agrobacterium tumefaciens имеет преимущества перед биолистическим методом, поскольку увеличивает пропорцию стабильных низкокопийных событий трансформации, может доставлять сегменты ДНК больших размеров и не требует специальных баллистических установок. В естественных условиях Agrobacterium tumefaciens вызывает в растениях-хозяевах опухоли с названием «корончатые галлы». Корончатые галлы возникают из-за нарушений гормонального баланса, их клетки неограниченно растут даже в отсутствие растительных гормонов и сохраняют свои свойства при элиминации бактерии. A. rhizogenes вызывает у растений формирование множества придаточных корней («бородатые корни»). Эти отклонения обусловлены наличием в клетке бактерии так называемых Ti-и Ri-плазмид. Строение Ti-плазмиды Ti- и Ri-плазмиды представляют собой кольцевую 2-нитевую ДНК из 12-22 т.п.о. В состав Ti-плазмиды входят так называемая Т-ДНК (transferred DNA — трансформирующая ДНК, сегмент, встраиваемый в ДНК растения), которая кодирует ферменты синтеза опинов и фитогормонов; Vir-область, кодирующая гены, отвечающие за перенос Т-ДНК в растение; гены утилизации опинов; локусы ori обеспечивают репликацию плазмиды и контролируют поддержание плазмиды в бактериальной клетке, tra — контролируют конъюгацию бактерий. При интеграции в растительный геном и экспрессии Т-ДНК изменяется дифференцировка растительных клеток из-за нарушения гормонального баланса. Происходит гормон-независимый рост клеток. Опины служат для бактерии источником C, N и энергии. В области Т-ДНК, гомологичной у разных Ti-плазмид, есть 6 генов, отвечающих за морфологию опухоли и синтез гормонов. Эти гены имеют черты эукариотического типа регуляции: 1) имеются 3’ и 5’-фланкирующие последовательности, есть TATA и GAAT-боксы и сигналы полиаденилирования; 2) транскрипция этих генов инициируется РНК-полимеразой II; 3) последовательности генов узнаются транс-действующими факторами, гены имеют тканеспецифичность, сопоставимую с растительной. В негомологичных областях находятся гены опинсинтаз. Процесс трансформации. Процесс агробактериальной трансформации можно разделить на 4 этапа: 1) прикрепление бактерии к стенке растительной клетки; 2) вырезание Т-ДНК и проникновение её внутрь растительной клетки; 3) интеграция Т-ДНК в геном растения; 4) экспрессия Т-ДНК. На эффективность трансформации влияют особенности поверхности клеточной стенки растения при прикреплении бактерии. Бактерия прикрепляется к клетке латерально, возможно, полярно. В процессе участвуют: рикадгезин (14кДа), полипептид 34-38 кДа, транспортные белки, лектины, целлюлозные фибриллы, сукциноглюкан. Само по себе прикрепление не лимитирует процесс, но мутации по генам, его обеспечивающим, могут затрагивать и процесс переноса. Бактерии могут проходить через клеточную стенку, локально лизируя её, или через естественные отверстия, где отсутствует или растянута вторичная клеточная стенка (кончик корневого волоска). Для лизиса нужен VirB1, который может разрывать 1,4-β-гликозидную связь. С-конец этого белка располагается на наружной мембране бактерии, формируя агрегаты или короткие пилеобразные структуры на полюсе (Чумаков, 2001). Индукция начальных этапов происходит в сайте раневого повреждения растения. Несмотря на то, что легче трансформируются клетки из повреждённых тканей (удаление эпидермиса и клеточной стенки обнажает специфические рецепторные сайты для бактерий, а также выделяются соединения-индукторы), механизм переноса не требует поранения. Для индукции требуются химические черты ранения: выделение низкомолекулярных фенольных соединений (ацетосирингон), сахаров (глюкоза, глюкуроновая кислота), кислый рН. Сигналы распознаются специфическими трансмембранными хеморецепторными белками VirA и ChvE. Сахара связываются с периплазматическим доменом рецептора в виде комплекса с белком-продуктом СhvE. ChvE кодируется хромосомой бактерии и изменяет способность VirA отвечать на фенольные соединения. Ген VirA экспрессируется конститутивно. Белок VirA имеет гистидин-протеинкиназную активность и способность к автофосфорилированию. В отсутствие индуктора его киназная активность ингибирована. Стимуляция ацетосирингоном и сахарами приводит к автофосфорилированию VirA, в таком состоянии он является донором фосфата для VirG. Фосфорилированный VirG связывается с 12-нуклеотидной последовательностью vir-бокса и индуцирует транскрипцию остальных vir-генов. 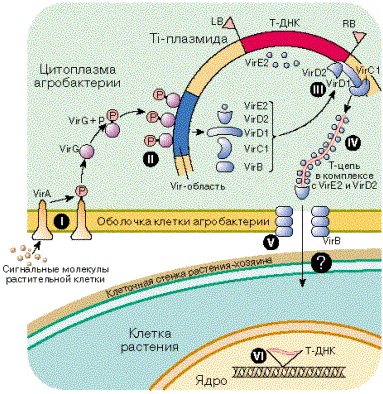 Рис. 3. Схема агробактериальной трансформации (Лутова, 2000).  VirD кодирует несколько продуктов, один из них — двухкомпонентная топоизомераза/эндонуклеаза. Т-ДНК фланкирована несовершенными прямыми повторами по 25 н. п. — сайты узнавания VirD-эндонуклеазы. Разрезание происходит между 3-м и 4-м основанием сайта. VirD2 ковалентно связывается с 5’-концом Т-нити, он содержит сигнал ядерной локализации (NLS) около С-конца. (NLS важен для опухолеобразования, а образование однонитевой Т-ДНК может происходить и без него) (Лутова, 1998). VirD2 доводит белок до ядра растительной клетки, узнаёт ядерную пору, встраивает ген в растительную хромосому. Продукты VirB (11 белков) формируют структуры, напоминающие половые ворсинки E. coli (Патрушев, 2004). VirB11 нужен для транспорта Т-ДНК из бактерии в растение. Это АТФаза, способная автофосфорилироваться; она находится на внутренней мембране клеток бактерий. Остальные VirB находятся на бактериальной оболочке или внутри мембраны, формируя канал для Т-ДНК (Лутова, 1998). VirE2 связывается с однонитевой Т-ДНК, покрывает её оболочкой, защищая её при переносе от эндонуклеаз; формируется так называемый Т-комплекс. VirE2 также содержит NLS. Без VirE2 однонитевая Т-ДНК остаётся в цитоплазме и не транспортируется в ядро растительной клетки. Перенос Т-ДНК в цитоплазму растительной клетки осуществляется за 30 мин. кокультивирования (Лутова, 1998). Инсерция Т-ДНК в растительную хромосому проходит многоступенчато. Существует гомология между растительной ДНК по обеим сторонам от сайта интеграции и наружным относительно точек вырезания Т-ДНК областям плазмиды. Механизм встраивания сходен с гомологичной рекомбинацией. При переносе могут возникать делеции и инсерции около концевых последовательностей. Гены Т-ДНК имеют собственные промоторы, транскрибируются ферментами хозяина. Если нет перестроек при интеграции, гены Т-ДНК и маркёры, введённые в неё, наследуются как менделевы признаки, моногенные и доминирующие. К 1976 году было известно, что 576 видов двудольных, 42 голосеменных и 5 однодольных способны подвергаться агробактериальной трансформации. Бактериальные детерминанты круга хозяев находятся в плазмиде и хромосоме; плазмидные — в Т-ДНК и vir-области. Получение трансгенных однодольных растений с помощью агробактериальной трансформации было долгое время затруднено, поскольку они характеризуются устойчивостью к этому патогену. Отсюда следует, что слабая способность к трансформации однодольных не является результатом отсутствия нужных сигнальных молекул. Эффективность индукции зависит от возраста, физиологического состояния, оптимальных условий опыта. Можно использовать синтетические сигналы и экссудаты чувствительных двудольных. Для инфекции и переноса в растение ДНК необходимо также связывание с пектином, которого мало у злаков. Таким образом, на трансформацию влияют: 1) физиология растения (возраст, тип ткани); 2) тип, источник, размер эксплантов; 3) условия кокультивации — состав сред; 4) физические факторы — температура, рН. Процесс трансформации мультигенно регулируется растением . 81. Баллистический метод генетической трансформации растений 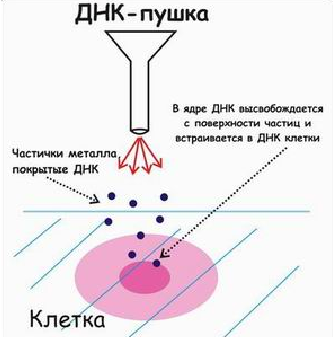 Баллистическая трансформация, использование для трансформирования кукурузы Наиболее активно применяемым методом прямого переноса генов является способ генетической трансформации растений с использованием установки «short gun» (дробовик), называемый био(бал)листической трансформацией. Он нашёл самое широкое применение именно для трансформации злаковых. Суть метода заключается в том, что на микрочастицы-носители из химически инертного металла (золото, вольфрам, платина или лёд), размером 0,6-1,2 мкм, осаждается ДНК, а затем они с помощью порохового заряда, сжатого гелия или электрического поля разгоняются до высоких скоростей (1000 м/сек) и поток частиц кратковременно направляют на поверхность клеток. Некоторые из них проникают внутрь клеток и попадают в ядро, где могут включиться в хромосомы растения. Что касается применения баллистического метода для трансформации кукурузы, то с его помощью можно переносить гены в клетки суспензионных культур, в первичный и пассируемый эмбриогенный каллус, в организованные ткани: примордии, незрелые зародыши, меристематические ткани. Первое время для получения трансгенных растений в качестве мишени при баллистической трансфекции широко использовали эмбриогенную суспензионную культуру клеток. Низкая степень агрегированности суспензии обеспечивала вероятность попадания микрочастиц с ДНК во все клетки мишени. Тем не менее, частота трансформации была очень низка, например, для получения 1 трансгенного растения бомбардировали 7-10 чашек эмбриогенной суспензионной культуры кукурузы. Эффективность трансформации для разных объектов кукурузы в экспериментах составляет от 1% до 3% (после оптимизации метода), в отдельных случаях достигает 18,1 %, но при этом не все растения экспрессировали полную конструкцию вводимых генов. Следует отметить, что число копий вводимого гена на растительный геном при бомбардировке достаточно неопределённо, причём многие из этих копий представлены в виде неполных последовательностей, что может приводить к нежелательным последствиям, в том числе и к «молчанию» генов. Молекулярный анализ трансгенных растений кукурузы, полученных методом баллистической трансфекции, показал, что число интегрированных фрагментов ДНК варьирует от 1 до 20 копий. Наиболее удачные растения получены с 1-4 копиями, и с 3-8 копиями. Ещё одним недостатком баллистического метода является ограничение размера вводимых генетических конструкций. Как правило, удаётся перенести ДНК размером не более 10 тысяч пар оснований. Плазмиды большего размера плохо закрепляются на металлических частицах или разрушаются при «бомбардировке» . Несмотря на недостатки, метод баллистической трансформации в настоящее время считается наиболее эффективным для злаковых растений среди методов прямого переноса генов. 82. Центральным компонентом генно-инженерной технологии является набор приемов для переноса генов из одной биологической системы в другую. К наиболее важным проблемам, для решения которых осуществляется генетическая трансформация растений, относятся повышение устойчивости растений к биотическим и абиотическим стрессам, улучшение качеств запасных белков зерна, повышение эффективности азотфиксации и расширение круга культурных растений, способных к симбиотической фиксации азота, а также создание сверхпродуцентов биологически активных веществ. Процесс трансформации начинается с выбора интересующего исследователя гена. Выбранный ген ставится под контроль регуляторного участка ДНК – промотора. В качестве промотора чаще всего используется регуляторный участок гена 35S белка из генома вируса мозаики цветной капусты. Большой интерес представляют так называемые индуцибельные промоторы, которые актививруют транскрипцию введенных генов в ответ на действие специфического индуктора (свет, повышенная температура, действие патогена). Для удобства контроля за процессом трансформации в переносимую конструкцию обычно включают маркерные гены, по экспрессии которых можно судить о том, произошло встраивание чужеродного гена в геном реципиента или нет. Маркерными часто являются гены устойчивости к различным антибиотикам или гербицидам. Используют также репортерные гены, экспрессия которых не дает клетке селективных преимуществ, но приводит к изменению фенотипа трансгенного растения. В настоящее время широко используемым репортерным геном является ген β–глюкуронидазы (GUS). Трансгенные клетки, экспрессирующие этот ген, при помещении на специфический субстрат окрашиваются в голубой цвет. Методы введения генетического материала в клетки растений: 1.Использование Ti –плазмид (высокоэффективная система, но применима только для двудольных растений); 2.Баллистический метод (используется для широкого круга растений и тканей; достаточно простой метод); 3.Использование векторов на основе вирусов (неэффективный способ доставки ДНК в растительные клетки); 4.Прямое введение генов в протопласты растений (может использоваться для введения генов только в протопласты растительных клеток); 5.Введение ДНК с помощью микроинъекций (имеет ограниченное применение, поскольку единовременно инъекцию можно сделать только в одну клетку); 6.Электропорация (применяется для введения генов только в протопласты, из которых могут быть регенерированы целые растения); 7.Слияние липосом (применяется для введения генов только в протопласты, из которых могут быть регенерированы целые растения). Многие методы основаны на использовании протопластов. Действительно, чужеродную генетическую информацию легче всего ввести в изолированные протопласты. Однако далее неизбежно возникает проблема регенерации растений из трансформированных протопластов. Для некоторых видов она до сих пор остается непреодолимой. При использовании агробактериальной трансформации, баллистического метода реципиентом чужеродных генов могут быть каллусные или суспензионные клетки, меристематические зоны, незрелые зародыши. Хотя эффективность трансформации невысока, существует реальная возможность получения трансгенных растений. В настоящее время у 120 видов растений существуют трансгенные формы. Получены растения, устойчивые к гербицидам, насекомым-вредителям, вирусам, грибам и бактериям, окислительному, солевому стрессу, растения с измененными сроками созревания плодов, модифицированной окраской цветков, повышенной пищевой ценностью. |
