1. общая этиология и патогенез расстройств функций системы кровообращения. Факторы риска в возникновении сердечной патологии управляемые и неуправляемые
 Скачать 2.8 Mb. Скачать 2.8 Mb.
|
39. Печёночная недостаточность: виды, причины, механизмы развития, проявления. Острая печёночная недостаточность, печёночная кома.Печеночная недостаточность — состояние, характеризующееся стойким снижением или полным выпадением одной, нескольких или всех функций печени, что приводит к нарушению жизнедеятельности организма в целом. Виды печеночной недостаточности 1. По масштабу повреждения:
2. По происхождению:
3. По скорости возникновения и развития:
4. По обратимости повреждения гепатоцитов:
Причины развития недостаточности печени могут быть собственно печёночными (гепатогенные — патологические процессы и/или воздействия, прямо повреждающие клетки печени) и внепечёночными (негепатогенные — патологические процессы, протекающие за пределами печени, но вторично повреждающие её).
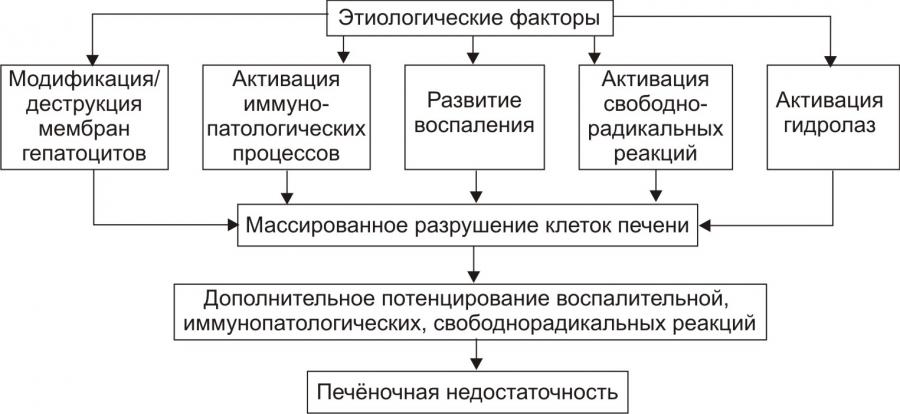 Рис.1. — Основные общие звенья патогенеза печёночной недостаточности. Белковый обмен. применительно к аминокислотам можно говорить о нарушении их соотношения и даже возможного увеличения общего количества. По-видимому, это связано с нарушением не столько синтетической, сколько регуляторной функции печени в отношении аминокислот. Снижение в плазме крови концентрации альбумина как результат печеночной недостаточности через падение ее колоидно-осмотического давления ведет к интерстициальному отеку. Многие поражения мезенхимы печени сопровождаются ростом количества γ-глобулинов, что приводит к развитию диспротеинемии. Печеночная недостаточность приводит к дефициту в крови факторов ее свертывания. Известно, что активированные формы факторов свертывания крови инактивируются преимущественно в печени. Поэтому при печеночной недостаточности раз начавшийся процесс свертывания крови идет аномально долго, распространенно и интенсивно, так как его не тормозит инактивация факторов свертывания печенью. Его результатом может быть коагулопатия потребления, т.е. нарушение свертывания крови вследствие дефицита его факторов, обусловленного избыточным потреблением при неограниченном свертывании Одним из наиболее устойчивых процессов в печени является преобразование аммиака в мочевину, даже при удалении до 90% печеночной ткани при явном выпадении целого ряда функций, мочевинообразовательная сохраняется. Липидныи обмен. При патологических процессах в печени происходит накопление в крови нерасщепленных жирных кислот, которые, проникая через ГЭБ, оказывают тяжелое токсическое воздействие на головной мозг. Одной из частых форм нарушения обмена жирных кислот является развитие холестаза. При этом наряду с желчными кислотами в крови накапливается холестерин и β липопротеиды. При алкогольной интоксикации накопление функции печени сопровождается резким увеличением транспорта жира, синтеза липопротеинов, подавлением активности липопротеинлипазы. Углеводный обмен. Недостаток углеводов приводит к нарушению синтеза белков, накоплению в клетках кислых продуктов обмена, что ведет к нарушению КОС. Метаболизм гормонов. При поражении печени мажет повышаться концентрация гормонов, которые инактивируются в печени: глюкокортикоиды, тироксин, АДГ, альдостерон (развивается вторичный гиперапьдостеронизм), эстрогены, инсупин (возможно развитие гипогликемии). Обмен витаминов. Печень является основным депо витаминов А, Д, К, РР, в ней содержатся в большом количестве витамины С, B1, B12, фолиевая кислота. Острая и молниеносная печеночная недостаточность представляют собой клинические синдромы патологии печени, характеризующиеся внезапным развитием тяжелого нарушения функций печени у здорового человека. Эти синдромы обычно сопровождаются энцефалопатией, выраженной коагулопатией и другими метаболическими расстройствами. У больных с острой печеночной недостаточностью может развиваться сердечно-сосудистая, дыхательная и почечная недостаточности. Прогноз при острой печеночной недостаточности намного хуже, чем при хронической, однако острое поражение печени может быть обратимым, выжившие больные могут полностью выздороветь. Осложнения, опасные для жизни пациентов с печеночной недостаточностью, — бактериальные и грибковые инфекции, отек головного мозга, сердечно-сосудистая, почечная и дыхательная недостаточности, расстройства электролитного обмена и кислотно-основного равновесия, коагулопатия. Печеночная кома представляет собой наиболее тяжелое проявление функциональной печеночно-клеточной и/или сосудистой недостаточности печени, характеризующееся токсическим поражением центральной нервной системы с глубокими нервно-психическими нарушениями, судорогами, потерей сознания и расстройством жизнедеятельности организма, относится к экстремальным его состояниям. Наиболее часто печеночная кома возникает при вирусном гепатите, токсической дистрофии печени, циррозе, остром расстройстве печеночного кровообращения и синдроме портальной гипертензии. При нарушении антитоксической функции гепатоцитов или при шунтировании крови из воротной в полые вены в ней накапливаются токсические продукты метаболизма, такие как аммиак, фенолы, токсические полипептиды, тирамин и др. Аммиак соединяется в головном мозге с α-кетоглутаровой кислотой, и в итоге образуется глутаминовая кислота. Таким образом аммиак блокирует участие α-кетоглутаровой кислоты в цикле Кребса. Тирамин, попадая в центральную нервную систему, стимулирует образование нейромедиаторов возбуждающего действия (допамина и норадреналина), что усугубляет неврологическую симптоматику. В пораженной печени снижается активность процессов разрушения альдостерона. Это приводит к вторичному гиперальдостеронизму и гипокалиемии. Нарушения углеводного, липидного и белкового обмена при заболеваниях печени могут вызывать сдвиг кислотно-основного состояния (обычно в кислую сторону при накоплении кислых метаболитов в крови), а также изменения терморегуляции. 40. Этиология и патогенез циррозов печени. Цирро́з пе́чени — тяжёлое заболевание печени, сопровождающееся необратимым замещением паренхиматозной ткани печени фиброзной соединительной тканью, или стромой. Этиология
Патогенез цирроза печени определяется этиологическими особенностями, а также механизмом самопрогрессирования цирроза, общим для всех форм этого заболевания. В патогенезе вирусного цирроза печени имеют значение персистирование вирусной инфекции и обусловленного ею иммуновоспалительного процесса, цитопатическое (гепатотоксическое) действие вирусов D и С, развитие аутоиммунных реакций. В развитии аутоиммунного цирроза печени основную роль играют аутоиммунные реакции, вызывающие резко выраженный иммуновоспалительный процесс с некрозами печеночной ткани. В патогенезе алкогольного цирроза печени ведущее значение приобретают повреждение гепатоцитов алкоголем и продуктом его метаболизма ацетальдегидом, развитие аутоиммунного воспалительного процесса (в ответ на отложение в печени алкогольного гиалина), стимуляция фиброзирования в печени под влиянием алкоголя. В происхождении кардиального (застойного) цирроза печени имеют значение уменьшение сердечного выброса, венозный ретроградный застой, уменьшение перфузионного давления крови, поступающей в печень, развитие гипоксии гепатоцитов, что приводит к атрофии и некрозу гепатоцитов, прежде всего в центральной части печеночных долек. Во всех случаях цирроза печени центральным в патогенезе является механизм самопрогрессирования цирроза и стимуляция образования соединительной ткани. Механизм самопрогрессирования цирроза печени заключается в следующем. Пусковым фактором в морфогенезе циррозов является гибель печеночной паренхимы. При постнекротическом циррозе печени возникают массивные или субмассивные некрозы паренхимы. На месте погибших гепатоцитов спадается ретикулиновый остов, образуется органический рубец. Сосуды портального тракта приближаются к центральной вене. Создаются условия для перехода крови из печеночной артерии и воротной вены в центральную вену, минуя синусоиды расположенных рядом неповрежденных участков печени. В нормальных условиях портальная вена и печеночная артерия через терминальную пластинку отдают свою кровь в синусоиды, расположенные между балками гепатоцитов в дольке, а затем кровь попадает из синусоидов в центральную (печеночную) вену. Ток крови в обход синусоидов неповрежденных участков печени приводит к их ишемизации, а затем и некрозу. При некрозе выделяются стимулирующие регенерацию печени вещества, развиваются узлы регенерации, которые сдавливают сосуды и способствуют дальнейшему нарушению кровотока в печени Продукты распада гепатоцитов стимулируют воспалительную реакцию, формируются воспалительные инфильтраты, которые распространяются из портальных полей до центральных отделов долек и способствуют развитию постсинусоидального блока. Воспалительный процесс при циррозе печени характеризуется интенсивным фиброзообразованием. Формируются соединительнотканные септы. Они содержат сосудистые анастомозы, соединяют центральные вены и портальные тракты, долька фрагментируется на псевдодольки. В псевдодольках изменено взаимоотношение портальных сосудов и центральной вены, в центре псевдодолек не обнаруживается центральной вены, а по периферии нет портальных триад. Псевдодольки окружены соединительнотканными септами, содержащими сосуды, соединяющие центральные вены с ветвями печеночной вены (внутрипеченочные порто-кавальные шунты). Кровь поступает сразу в систему печеночной вены, минуя паренхиму псевдодолек, это вызывает ишемию и некроз. Этому также способствует механическое сдавление венозных сосудов печени соединительной тканью. Узлы регенерации имеют собственный новообразованный портальный тракт, развиваются анастомозы между воротной веной и печеночной артерией и печеночной веной. В патогенезе всех видов цирроза печени большое значение имеет также активация перекисного окисления липидов, образование свободных радикалов и перекисей, которые повреждают гепатоциты и способствуют их некро 57. Патология гипоталамо-гипофизарной системы. Гиперфункция и гипофункция передней доли гипофиза. Типовые формы патологии аденогипофиза Нормальная функция гипофиза зависит от поступления гипоталамических релизинг-факторов и релизинг-ингибирующих факторов. Для секреции всех гормонов передней доли гипофиза (за исключением пролактина), необходима стимуляция гипоталамическими релизинг-факторами. Синтез пролактина дополнительно находится под ингибирующим контролем гипоталамического допамина. Синдромы избытка гипофизарных гормонов развиваются из-за нарушения связи гипофиз-гипоталамус или из-за автономно секретирующих групп клеток (как правило, опухоли). Синдромы гормональной недостаточности возникают в результате гипофункции гипоталамических релизинг-факторов или локальных повреждений в области sella turcica и ножки гипофиза. Гиперфункция передней доли гипофиза Гиперпитуитаризм – это избыток содержания и/или эффектов одного либо нескольких гормонов аденогипофиза. В большинстве случаев гиперпитуитаризм – это первичное парциальное поражение гипофиза, реже – патология, связанная с нарушением гипоталамо-гипофизарных функциональных взаимосвязей. Гипофизарный гигантизм и акромегалия Гигантизм – эндокринопатия, характеризующаяся гиперфункцией СТГ-РГ и/или СТГ, пропорциональным ростом конечностей и туловища. Объективных признаков патологии, кроме пропорционального увеличенных органов, не выявляется. Редко: нарушение зрения, снижение способности к обучению. Проявления преимущественно субъективны: утомляемость, головная боль, мышечные боли. При продолжающейся гиперпродукции СТГ-РГ и/или СТГ после созревания скелета формируется акромегалия. Акромегалия – эндокринопатия, характеризующаяся гиперфункцией СТГ-РГ и/или СТГ, диспропрорциональным ростом скелета, мягких тканей и внутренних органов. Этиология: опухоли аденогипофиза, опухоли гипоталамуса, эктопические опухоли продуцирующие СТГ или СТГ-РГ, нейроинфекции, интоксикации, черепно-мозговые травмы. Стадии:
Патогенеческие механизмы: первичная или вторичная парциальная гиперфункция ГГНСА (↑СТГ-РГ, ↑СТГ); Хронический избыточный синтез СТГ-РГ и/или СТГ приводит к чрезмерной активации анаболических процессов в органах и тканях, способных к интенсивному росту на данном этапе онтогенеза. Это значительно увеличивает пластические и энергетические потребности организма в молодом возрасте. Ткани-мишени в разные периоды онтогенеза имеют различную чувствительность к СТГ, что вызывает акромегалию у взрослых. Из-за избыточного разрастания соединительной ткани наступают дегенеративные изменения миофибрилл, что приводит к быстрой утомляемости. Так как ведущей причиной являются опухоли ЦНС, на фоне их экспансивного роста может происходить формирование сопутствующей неврологической симптоматики и нарушений зрения. Увеличение продукции СТГ приводит к потенциированию синтеза гормонов ЩЖ, что может сопровождаться тиреоидной патологией. Соматотропин обладает выраженным контринсулярным эффектом, что может приводить к развитию нарушений углеводного обмена. Абсолютная и относительная недостаточность синтеза и/или эффектов половых гормонов на фоне избытка СТГ приводит к гипогинетализму и нарушениям полового развития. Систематическое стрессорное воздействие (боли, половая дисфункция, ощущение снижения работоспособности), гипертиреоз, поражение нейронов коры и подкорки в сочетании с нарушениями минерального, углеводного и липидного обменов могут приводить к раннему формированию АГ, сопровождающейся нарушением функции сердца. Отставание увеличения спланхов от роста тела вцелом может сопровождаться недостаточностью функции органов (печень, сердце). Клиника: увеличены надбровные дуги, скулы, ушные раковины, нос, губы, язык, кисти рук и стопы, нижняя челюсть выступает вперед, увеличиваются промежутки между зубами, кожа утолщена, с грубыми складками, грудная клетка увеличена в объеме с широкими межреберьями. Гипертрофия ЛЖ, артериальная гипертензия. Гипертрофия внутренних органов без нарушения функции. Полинейропатии, миопатии, возможны эпилептоидные приступы. В 50% случаев диффузный или узловой зоб. Возможно развитие СД. При выраженном росте опухоли может происходить сдавление хиазмы, что сопровождается снижением остроты и ограничением полей зрения. Часто встречаются эректильная дисфункция, нарушения менструального цикла. Гипофизарный гиперкортицизм (болезнь Иценко-Кушинга) Болезнь Иценко-Кушинга – гипоталамо-гипофизарное заболевание, характеризующееся избыточной секрецией кортикотропина и последующей двусторонней гиперплазией надпочечников и их гиперфункцией (гиперкортицизм). Этиология: окончательно неустановлена. Гиперкортицизм – является клиническим синдромом, который проявляется гиперфункцией надпочечников. Следует различать понятия «болезнь Иценко-Кушинга» и «синдром Иценко-Кушинга», они используются для обозначения разных патологий Патогенез: В надпочечниках повышается концентрация глюкокортикоидов и гликогена, в меньшей степени – минералкортикоидов. Вненадпочечниковые эффекты проявляются гиперпигментацией и нарушениями психики. Увеличивается катаболизм белков и углеводов, что приводит к атрофическим изменениям мышц (в том числе сердечной мышцы), инсулинрезистентности, усилению глюконеогенеза в печени с последующим развитием стероидного диабета. Усиленный катаболизм белков способствует подавлению специфического иммунитета, в результате чего развивается вторичных иммунодефицит. Ускорение анаболизма жиров приводит к ожирению. Увеличение продукции минералкортикоидов приводит с одной стороны на нарушениям реабсорбции кальция в кишечнике, с другой – к ускоренной деградации костных структур, что приводит к остеопорозу. Под действием минералкортикоидов происходит активация РААС, что приводит к развитию гипокалиемии и АГ. Гиперсекреция андрогенов приводит к снижению синтеза гонадотропинов гипофиза и увеличению синтеза пролактина. В результате комплексных изменений обмена веществ снижается синтез ТТГ и СТГ. Повышена секреция СТГ-РГ, эндорфинов, меланоцитстимулирующего гормона. Клиника: диспластическое ожирение, трофические нарушения кожи, гиперпигментация, стрии, гнойные поражения, миопатия, системный остеопороз, симптомы нарушения белкового обмена, АГ, вторичная кардиомиопатия, энцефалопатия, симптоматический СД, вторичный иммунодефицит, нарушения половой функции, эмоциональная лабильность. |
