1 вопрос
 Скачать 0.6 Mb. Скачать 0.6 Mb.
|
|
Тканевая эмболия — эмболия клеточно-тканевыми структурами, возникающими при массивной травме тканей, особенно жировой, а также клетками злокачественных опухолей. Жировая эмболия развивается при попадании капелек жира, преимущественно в венозные сосуды большого круга кровообращения, в результате повреждения либо костного мозга, либо подкожной жировой клетчатки. Эмболия может развиваться в сосудах малого круга кровообращения, хотя отсюда эмболы могут вновь попасть в большой круг (вследствие хорошо развитых артерио-венозных анастомозов малого круга кровообращения и обилия широких, хорошо растягивающихся капилляров). Клеточная эмболия бывает вызвана преимущественно оторвавшимися клетками злокачественных опухолей и попавшими в крово- и лимфоток. Эмболия околоплодными водами возникает в результате попадания околоплодных вод в повреждённые сосуды матки на участке отделившейся плаценты. Обычно эмболия развивается в сосудах малого круга кровообращения. Для неё характерна выраженная активация фибринолитической системы крови, приводящая нередко к массивным кровотечениям. 2 вопрос Местные признаки воспаления, их патогенез. основные местные симптомы воспаления:
Покраснение – яркий клинический признак воспаления, связано с расширением артериол, развитием артериальной гиперемии и “артериализацией” венозной крови в очаге воспаления. Припухлость при воспалении обусловлена увеличением кровенаполнения ткани, образованием инфильтрата, вследствие развития экссудации и отека, набухания тканевых элементов. Жар, повышение температуры воспаленного участка, развивается вследствие усиленного притока теплой артериальной крови, а также в результате активации метаболизма, повышения теплопродукции и теплоотдачи в очаге воспаления. Боль – возникает в результате раздражения окончаний чувствительных нервов различными биологически активными веществами (гистамин, серотонин, брадикинин, некоторые простагландины и др.), сдвига рН внутренней среды в кислую сторону, механического сдавления рецепторов, нервных волокон воспалительным отеком. Нарушение функции на почве воспаления возникает, как правило всегда; иногда это может ограничиваться расстройством функций пораженной ткани, но чаще страдает весь организм, особенно когда воспаление возникает в жизненно важных органах. Нарушение функции воспаленного органа связано со структурными повреждениями, развитием боли, расстройством его нейроэндокринной регуляции. При хроническом воспалении и воспалении внутренних органов некоторые из указанных признаков могут отсутствовать. 3 вопрос Роль первичных и вторичных пирогенов в патогенезе лихорадки. Пирогенами (жаронесущими) называют такие вещества, которые, попадая в организм извне или образуясь внутри него, вызывают лихорадку. Пирогены повышают установочную точку температурного гомеостаза, т.е. имеет место динамическое равновесие между теплопродукцией и теплоотдачей. Первичные пирогены – главный этиологический фактор
Вторичные пирогены – основное звено патогенеза.
Первичные пирогены представляют собой: эндотоксины клеточных мембран (липополисахариды, белковые вещества и др.) различных грамположительных и грамотрицательных бактерий, различные АГ микробного и немикробного происхождения, различные экзотоксины, выделяемые м/о. Наиболее высокой пирогенной активностью обладают липополисахаридные комплексы, особенно Гр- бактерий. Первичные пирогены могут образовываться и в результате поражения собственных тканей организма: механическом повреждении тканей (ушибах, разрывах, раздавлении), некрозах (при инфаркте миокарда), асептическом воспалении, гемолизе. Роль: Первичные пирогены, проникая или образуясь в организме, лишь инициируют лихорадку, запускают ее. Они оказывают свое действие на центры терморегуляции опосредовано, через образование в организме вторичных пирогенных веществ. И уже вторичные пирогены, которые образуются в собственных клетках организма, действуя на центры терморегуляции вызывают лихорадку. 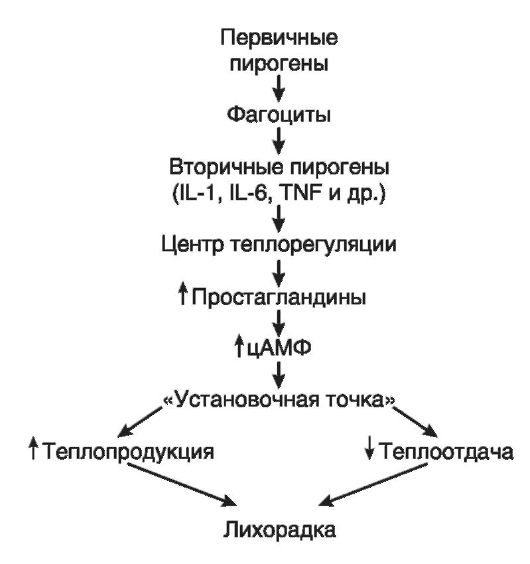 Развитие лихорадки является результатом воздействия вторичных пирогенов на центр теплорегуляции, локализующийся в преоптической зоне гипоталамуса. Действие пирогенов на нейроны гипоталамуса реализуется через образование простагландинов,которые в данном случае играют роль медиаторов. Предполагается следующий механизм образования простагландинов: вторичные пирогены активируют фосфолипазу А2, тем самым повышают активность аденилатциклазы, что сопровождается повышением образования цАМФ и перестройкой обмена веществ. Это, в свою очередь, приводит к изменению порогов чувствительности «холодовых» и «тепловых» нейронов к температурным влияниям и вызывает смещение «установочной точки» (set point)на более высокий уровень. 4 вопрос Механизмы долговременной адаптации при гипоксии. Причина включения механизмов долговременной адаптации к гипоксии: повторная или продолжающаяся недостаточность биологического окисления умеренной выраженности. Долговременная адаптация к гипоксии реализуется на всех уровнях жизнедеятельности: от организма в целом до клеточного метаболизма. Системы биологического окисления в тканях обеспечивают оптимальное энергетическое обеспечение функционирующих структур и уровень пластических процессов в них в условиях гипоксии. Это достигается благодаря:
Сердце при адаптации к гипоксии При долговременной адаптации к гипоксии увеличивается сила, а также скорость процессов сокращения и расслабления миокарда. В результате происходит возрастание объёма и скорости выбрасываемой в сосудистое русло крови — ударного и сердечного (минутного) выбросов. Эти эффекты становятся возможными благодаря:
В адаптированном организме сосудистая система способна обеспечивать такой уровень перфузии тканей кровью, который необходим для осуществления их функции даже в условиях гипоксии. В основе этого лежат следующие механизмы:
Органы и ткани Повышение экономичности функционирования.
Система регуляции (НС и гуморальная система) Возрастание эффективности и надежности механизмов регуляции
БИЛЕТ 27 1.Стадии тромбоза, механизмы ретракции первичного тромба. 2.Изменения в общей гемоциркуляции при воспалении. 3.Механизм перестройки центрального звена системы терморегуляции при лихорадке. 4.Патогенез гемической гипоксии. 1вопрос Стадии тромбоза,механизмы ретракции первичного тромба основные механизмы тромбообразования в виде триады Вирхова. 1. Повреждение сосудистой стенки, возникающее под действием физических (механическая травма, электрический ток), химических (NaCl, FeCl3, HgCl2, AgNO3) и биологических (эндотоксины микроорганизмов) факторов в результате нарушения ее питания и метаболизма. Указанными нарушениями, кроме того, сопровождаются атеросклероз, гипертоническая болезнь, аллергические процессы. Из поврежденной внутренней оболочки сосуда выделяются факторы свертывания крови, активирующие процесс тромбообразования. Локально угнетаются процессы фибринолиза, образования в эндотелии кровеносных сосудов простагландина I2 (простациклин), оказывающего в норме выраженное антиагрегационное действие на тромбоциты. При стрессовых состояниях способствует тромбообразованию адреналин, т. к. является мощным эндогенным ингибитором синтеза простациклина. 2. Нарушение активности свертывающей и противосвертывающей системы крови и сосудистой стенки. Повышение активности свертывающей системы крови вследствие повышения в ней концентрации прокоагулянтов (тромбин, тромбопластин), как и понижение активности противосвертывающей (уменьшение содержания в крови антикоагулянтов или увеличение активности их ингибиторов), в том числе фибринолитической, как правило, приводит к внутрисосудистому свертыванию крови (ВССК) и тромбозу. 3. Замедление кровотока и его нарушения (завихрения в области аневризмы). Процесс тромбообразования условно можно разделить на фазы: фазу адгезии, агрегации и агглютинации тромбоцитов (клеточная фаза) и фазу коагуляции (плазматическая фаза свертывания). Необратимые изменения тромбоцитов наступают через 2 — 3 мин с момента повреждения внутренней оболочки сосудов. При этом наблюдаются расширение их цитоплазмы, появление множественных псевдоподий, потеря тромбоцитарных гранул по краям агрегатов тромбоцитов, прилипание лейкоцитов и образование на их поверхности фибриновых волокон, способствующих консолидации первичной тромбоцитной пробки. Последующая дезинтеграция распространяется в глубь массы, чему способствует активация аутолитических ферментов, повышение проницаемости и растворение плазматических мембран. В результате создаются условия для повышенного проникновения из сыворотки крови в тромбоциты кальция, активации в них Са2+-зависимой АТФазы, дальнейшего сдвига соотношения АТФ/АДФ в сторону увеличения АДФ и, как следствие, дальнейшего и прогрессирующего усиления адгезии и агрегации. С момента распада тромбоцитов и выхода тромбоцитарных факторов свертывания крови в окружающую среду начинается следующий этап тромбоза — плазматическая фаза (фаза коагуляции крови). Физико-химическая и биохимическая сущность этой фазы заключается в нескольких последовательных превращениях по типу профермент—фермент. Некоторые из этих превращений имеют истинную ферментативную природу. На первом этапе фазы коагуляции крови происходит активация тромбопластина ткани и крови с переводом их в активный внешний и внутренний тромбопластин. На втором этапе образуется активный тромбин. На третьем этапе под влиянием тромбина осуществляется превращение фибриногена в фибрин с образованием сгустка. Фибрин в виде рыхло или компактно расположенных нитей представляет собой основную массу тромба. В ячейках образованной сети располагаются клетки крови (агрегированные тромбоциты, скопления лейкоцитов и эритроцитов). На заключительном этапе свертывания крови под действием тромбастенина (ретрактозима), который выделяется из интактных тромбоцитов, наступает сокращение (по типу сокращения актомиозина) фибриновых волокон и волоконец, обнаруженных в тромбоцитах .Происходит сжатие (ретракция) и уплотнение сгустка. Для нормального течения ретракции необходимо наличие ионов кальция, глюкозы, АТФ, физиологическое течение гликолиза, определенные соотношения между концентрацией тромбина и фибриногена, а также фибриногена и тромбоцитов. Механизм тромбообразования состоит из 4-х стадий: 1. фаза агглютинации тромбоцитов 2. коагуляция фибриногена, образование фибрина 3. агглютинация эритроцитов 4. преципитация – осаждение на сгусток всех основных белков плазмы. 2вопрос .Изменение в общей гемоциркуляции при воспалении 1Первой, очень кратковременной реакцией сосудов поврежденного участка ткани является ишемия, которая длится от трех — пяти секунд при легких поражениях и до нескольких минут (например, при тяжелом обморожении или ожоге). При ишемии артериолы и венулы сужаются, число функционирующих капилляров уменьшается, а кровоток замедляется. Защитное значение ишемии определяется возможным уменьшением кровопотери в первые секунды после повреждения сосудистой стенки. 2Следующей фазой сосудистой реакции при воспалении служит артериальная гиперемия, которая начинается с массированного расширения артериол, а затем — и венул. Возрастает число функционирующих капилляров, линейная и, особенно, объемная скорость кровотока, адекватно увеличиваются лимфообразование и [291] лимфоотток. Парциальное давление кислорода в ткани повышается, а артерио-венозная разница по кислороду понижается. Повышенное содержание окисленного гемоглобина в оттекающей крови и увеличение числа функционирующих капилляров обусловливают развитие одного из классических признаков воспаления — красноты («rubor»). Эти изменения влекут за собой увеличение скорости рассеивания тепла воспаленной тканью. Вместе с активацией метаболизма, особенно, в фагоцитирующих клетках, удельная теплопродукция которых при фагоцитозе возрастает, по данным К.Левина (1974), в 3-4 раза, эти микроциркуляторные изменения ответственны за локальное повышение температуры над очагом воспаления («calor»). Артериальная гиперемия вызывается совокупным действием ряда медиаторов воспаления, особенно,биогенных аминов и факторов комплемента. Дальнейшая тенденция сосудистых изменений состоит в прогрессирующем замедлении кровотока в воспалительном очаге. При расширенных венулах, артериолах и капиллярах и все еще быстром кровотоке формируется смешанная гиперемия — преходящая стадия, вскоре трансформируемая в венозную гиперемию. 3 Венозная гиперемия отличается замедлением кровотока, в особенности, ограничением венозного оттока. Происходит значительное расширение капилляров и венул и нарастание в них гидростатического давления. В то же время, диаметр артериол нормализуется. Понижается парциальное напряжение кислорода в воспалительном очаге и увеличивается артерио-венозная разница по кислороду. Изменяется оттенок красноты и поврежденный участок приобретает багрово-синюшный цвет. 4 Наконец, формируется полный стаз. Остановка движения крови в сосудах воспалительного очага имеет смешанный патогенез и сочетает черты истинного капиллярного и застойного венозного стаза. 3 вопрос Механизмы перестройки центрального звена системы терморегуляции при лихорадке Лихорадка- типовая терморегуляторная реакция организма на действие пирогенного фактора; характеризуется динамической перестройкой функции системы терморегуляции (т.е. повышение каллоригенного состояния метаболизма или результатом нарушения механизмов физической терморегуляции, т.е. снижением теплоотдачи),характеризующийся временным смещением установочной точки температурного гомеостаза на более высокий уровень , при обязательном сохранении самих механизмов терморегуляции, в отличии от гипертермии и вызывается действием пирогенных веществ (Ефремов А.В. 1993) В основе лихорадки лежит процесс перестройки терморегуляции, направленный на поддержание более высокой температуры тела. Поэтому к лихорадке нельзя относить иные случаи повышения температуры, развившейся вне связи с перестройкой центра терморегуляции на поддержание повышенной температуры: простую гипертермию, интоксикации, сопровождающиеся разобщением окислительного фосфорилирования и первичным ростом теплопродукции. Пирогены повышают установочную точку температурного гомеостаза, т.е. при этом устанавливается динамическое равновесие между теплопродукцией и теплоотдачей,такое состояние теплового баланса обеспечивает новый уровень функционирования системы теплопродукции: -повышение активности тепловых терморецепторов преоптической зоны переднего гипоталамуса, вызываемое повышенной температурой крови -температурная активация периферических термосенсоров внутренних органов. В связи с этим , повышенный уровень адренергических влияний балансируется возрастающими холинергическими воздействиями. Результатами указанных изменений является снижение эффективности процессов теплопродукции и повышение реакций теплоотдачи 4вопрос Патогенез гемической гипоксии Патогенез гемической (кровяной) гипоксии. Она возникает в результате уменьшения эффективной кислородной емкости крови при анемиях (постгеморрагические, гемолитические, дизэритропоэти-ческие), гидремии (гемодилюция в постгеморрагическом периоде, при трансфузии значительных масс физиологического раствора, переливании кровезаменителей) и при нарушении способности гемоглобина связывать, транспортировать и отдавать кислород тканям - качественных изменениях гемоглобина. Наиболее часто подобная форма гемической гипоксии наблюдается при отравлении окисью углерода (угарным газом, который образует в крови карбоксигемоглобин), метгемоглобинообразователями, при некоторых аномалиях молекулы гемоглобина, при отклонениях гомеостаза, приводящих к нарушениям в процессах оксигенации и деоксигенации гемоглобина, соответственно, в легких и тканях. Ухудшение кислородотранспортных свойств гемоглобина может быть связано с наследственными дефектами его молекулы, что сопровождается нарушениями его оксигенации в легких и деоксигенации в тканях. Наконец, изменение физических свойств эритроцитов (агрегация, сладжирование и т.п.) ухудшают перенос и отдачу кислорода. БИЛЕТ 28 1.Роль нарушений кровотока в патогенезе тромбоза. 2.Альтерация, виды и механизмы развития, проявления. 3.Основные типы температурных кривых. 4.Нарушения физиологических функций при острой и хронической гипоксии. 1вопрос Тромбоз (от греч. thrombosis — свертывание) — прижизнен ное свертывание крови в просвете сосуда или полостях сердца. Образующийся при этом сверток крови называют тромбом. Хотя тромбоз представляет собой один из важнейших меха низмов гемостаза, он может стать причиной нарушения крово снабжения органов и тканей с развитием инфарктов, гангрены. Патогенез. Патогенез тромбоза складывается из участия как местных, так и общих факторов. К местным факторам относят изменения сосудистой стенки, замедление и нарушение тока крови. Среди изменений сосудистой стенки особенно важно по вреждение внутренней оболочки сосуда, чаще всего обусловлен ное атеросклеретическими и воспалительными поражениями ее. К повреждению стенки сосуда ведут и ангионевротические рас стройства — спазмы артерий и артериол. Повреждение эндокар да при эндокардитах, инфарктах миокарда также сопровождает ся тромбообразованием. Замедление и нарушение (завихрение) тока крови в артериях обычно возникают вблизи атеросклеротических бляшек, в полости аневризмы, при спазме; в венах — при варикозном расшире нии. Роль нарушений тока крови в развитии тромбоза подтвер ждается наиболее частой их локализацией на месте ветвления со судов. О значении замедления тока крови для тромбообразования свидетельствует частое возникновение тромбов в венах при развитии сердечно-сосудистой недостаточности, при сдавлении вен опухолями, беременной маткой, иммобилизации конечности. К общим факторам патогенеза тромбоза относят на рушение регуляции свертывающей и противосвертывающей сис тем крови и изменение состава крови. Главная роль принадлежит нарушениям баланса между свертывающей и противосвертывающей системами в регуляции жидкого состояния крови в сосу дистом русле. Состояния повышенной свертываемости (гиперкоагуляция) часто являются следствием обширных хирургиче ских операций и травм, беременности и родов, некоторых лейко зов, сопровождающихся тромбоцитозом (истинной полицитемин и других миелопролиферативных заболеваний), спленэктомии, эндотоксемии, шока, реакций гиперчувствительности, злокачест венных опухолей. Среди изменений состава (качества) крови наибольшее значе ние имеет повышение вязкости. Оно может быть обусловленс эритроцитозом или полицитемией, возникающими при дегидра тации (чаще у детей), при хронических гипоксических состояниях (дыхательной недостаточности, цианотических врожденных пороках сердца), истинной полицитемии, увеличении содержания грубодисперсных фракций белков (например, при миеломной бо лезни). 2вопрос Альтерация - это главное звено, по сути - пусковой механизм. Альтерация может быть первичная или вторичная. Первичная альтерация развивается сразу после воздействия повреждающего фактора и формируется на уровне функционального элемента органа. Первичная альтерация может проявляться специфическими изменениями, а также неспецифическими изменениями, которые развиваются стереотипно независимо от свойств и особенностей действия патогенного фактора. Эти изменения связаны: 1) с повреждением мембранных структур, 2) с повреждением мембраны митохондрий, 3) с повреждением лизосом. Нарушения структуры мембраны клеток ведет к нарушению клеточных насосов. Отсюда теряется способность клетки адекватно реагировать изменением собственного метаболизма на изменения гомеостаза окружающей среды, изменяются ферментативные системы и митохондрии. В клетке накапливаются недоокисленные продукты обмена: пировиноградная, молочная и янтарная кислоты. Первоначально эти изменения являются обратимыми и могут исчезнуть, если этиологический фактор прекратил свое действие. Клетка полностью восстанавливает свои функции. Если же повреждение продолжается и в процесс вовлекаются лизосомы, то изменения носят необратимый характер. Поэтому лизосомы называют "стартовыми площадками воспаления" и именно с них начинается формирование вторичной альтерации. Вторичная альтерация обусловлена повреждающим действием лизосомальных ферментов. Усиливаются процессы гликолиза, липолиза и протеолиза. В результате распада белков в тканях увеличивается количество полипептидов и аминокислот; при распаде жиров возрастают жирные кислоты; нарушения углеводного обмена ведет к накоплению молочной кислоты. Все это вызывает физико-химические нарушения в тканях и развиваются гиперосмия с повышением концентрации ионов K+, Na+, Ca2+, Cl-; гиперонкия - повышение количества белковых молекул из-за распада крупных на более мелкие; гипериония H+ - в связи с диссоциацией большого количества кислот с высвобождением ионов водорода. И как следствие всего этого - развивается метаболический ацидоз в связи с повышением кислых продуктов обмена. В процесс вовлекаются все компоненты ткани и альтерация носит необратимый характер, итогом которого будет аутолиз клеток. Образуются вещества, которые могут не только усиливать, но и ослаблять альтерацию, оказывая влияние на различные компоненты воспаления, т.е. регулируя микроциркуляцию, экссудацию, эмиграцию лейкоцитов и пролиферацию клеток соединительной ткани. Воспаление (inflammatio) - это сложная местная защитно-приспособительная реакция соединительной ткани, сосудов и нервной системы целостного организма, выработанная в процессе эволюции у высокоорганизованных существ в ответ на повреждение, направлена на изоляцию и удаление повреждающего агента и ликвидацию последствий повреждения. Это типовой патологический процесс с изменением обмена веществ и кровообращения, фагоцитозом и пролиферацией. В основе любого воспаления лежит: 1) повреждение и 2) защитные реакции. Способность противостоять повреждению, способность к заживлению ран, к восстановлению по крайней мере некоторых утраченных тканей - важнейшее свойство живых организмов. И эти свойства определяются тем, что здоровый организм немедленно отвечает на повреждение рядом общих и местных реакций. Общие реакции обусловлены более или менее выраженными изменениями функционального состояния нервной, эндокринной и иммунной систем организма. Они сопровождаются изменениями реактивности всего организма в целом. Местные реакции, возникающие в зоне повреждения и в непосредственной близости от нее, характеризуют процесс, называемый воспалением. Воспаление делят на острое и хроническое. Острое воспаление (inflammatio acuta) развивается в связи с внезапным повреждением - ожогом, отморожением, механической травмой, некоторыми инфекциями. Его продолжительность обычно не превышает нескольких суток. Острое воспаление характеризуется выраженными экссудативными реакциями, в ходе которых вода, белки, форменные элементы крови (в основном лейкоциты) покидают кровоток и поступают в зону повреждения. Хроническое воспаление (inflammatio chronica) развивается, когда повреждающий агент действует в течение длительного времени. Хроническое воспаление продолжается недели, месяцы и годы. Оно характеризуется не столько экссудацией, сколько пролиферацией фибробластов и сосудистого эндотелия, а также скоплением в очаге воспаления специальных клеток - макрофагов, лимфоцитов, плазматических клеток и фибробластов. Большая часть наиболее тяжелых болезней человека характеризуется как раз хроническим воспалительным процессом - это лепра, ревматоидный артрит, туберкулез, хронический пиелонефрит, сифилис, цирроз печени и так далее. Хроническое воспаление обычно сопровождается необратимыми повреждениями нормальной паренхимы, дефекты которой заполняются фиброзной соединительной тканью, деформирующей пораженные органы. В оптимальном случае прекращение действия повреждающего агента сопровождается затуханием воспалительного ответа и полным устранением всех последствий самих воспалительных реакций - т.е. "полное разрешение воспаления". Это означает прекращение образования медиаторов и исчезновение их из зоны повреждения, прекращение эмиграции лейкоцитов, восстановление сосудистой проницаемости, удаление жидкости, белков, продуктов распада бактерий и клеток (в том числе нейтрофилов и макрофагов). Исчезновение медиаторов обусловлено отчасти их спонтанной диффузией из очага воспаления и частично инактивацией различными ферментами, причем система инактивации развивается в ходе самого воспаления. Если повышение проницаемости сосудов не было связано с грубым повреждением эндотелиальных клеток, то проницаемость быстро нормализуется после исчезновения медиаторов. Большая часть скопившейся в очаге воспаления жидкости удаляется с током лимфы. Отложения фибрина растворяются фибринолитическими ферментами крови, ферментами клеток воспаления и также удаляются по лимфатическим сосудам. Возможно, что по лимфатическим сосудам уходят и макрофаги. Часть макрофагов, нагруженных нетоксичными неразрушенными веществами, может оставаться долгое время в месте бывшего воспаления. Полное разрешение воспаления создает условия для полного восстановления структуры и функции поврежденных тканей. Однако это бывает только при относительно небольших ранениях органов и тканей, обладающих к тому же высокой способностью к регенерации - кожа, слизистые, паренхима внутренних органов. Неполное разрешение воспаления приводит к тому, что восстановление происходит при помощи рубцевания. Воспаление может быть: ● нормэргическое - при хорошей реактивности у здоровых лиц, ● гиперэргическое (очень бурное) - при аллергии или у холериков, ● гипоэргическое - как положительная гипо- и анергия при иммунитете и отрицательная гипо- и анергия при низкой реактивности, голодании, истощении регуляторных систем (нервной и эндокринной). 3вопрос Типы лихорадочных (температурных) кривых: 1) постоянная температурная кривая (febris continua) - колебания в пределах не более 1 градуса, 2) ремиттирующая - febris remittens - или послабляющая (колебания температуры в пределах 1,5 - 2 градусов), 3) перемежающаяся или интермиттирующая - febris intermittens- это правильное чередование нормальной температуры с периодами подъема, 4) возвратная - febris recurrens -5-7 дней лихорадка и 3-4 дня норма, т.е. промежутки между лихорадочным периодом и периодами нормы, как правило, не одинаковые. 5) изнуряющая или гектическая - febris hectica колебания температуры в течение суток доходят до 3-5 градусов (утром норма, вечером 40 градусов). При этом лихорадка может быть атипичной, когда утром температура выше, чем вечером. 1) субфебрильную - до 38 градусов, 2) умеренную - 38-39 градусов, 3) высокую - 39-40 градусов и 4) чрезмерную - гиперпиретическую (41 градус и выше). Во время лихорадки температура тела может доходить до 42 градусов. При превышении этой границы возникают глубокие нарушения функции ЦНС и может возникнуть угроза для жизни больного. 4вопрос Приспособительные и компенсаторные реакции. При воздействии факторов, вызывающих гипоксию, сразу же включаются реакции, направленные на сохранение гомеостаза. Различают реакции, направленные на приспособление к относительно кратковременной острой гипоксии (возникают немедленно) и реакции, обеспечивающие приспособление к менее выраженной, но длительно существующей или повторяющейся гипоксии. Реакции системы дыхания на гипоксию - это увеличение альвеолярной вентиляции за счет углубления и учащения дыхательных экскурсий и мобилизации резервных альвеол. Увеличение вентиляции сопровождается усилением легочного кровотока. Компенсаторная гипервентиляция может вызвать гипокапнию, которая в свою очередь компенсируется обменом ионов между плазмой и эритроцитами, усиленным выведением бикарбонатов и основных фосфатов с мочой. Реакции системы кровообращения выражаются учащением сердечных сокращений, увеличением массы циркулирующей крови за счет опорожнения кровяных депо, увеличения венозного притока, ударного и минутного ОС, скорости кровотока и перераспределения крови в пользу мозга и сердца. При адаптации к длительной гипоксии может происходить образование новых капилляров. В связи с гиперфункцией сердца и изменениями нейро-эндокринной регуляции может наступить гипертрофия миокарда, имеющая компенсаторно-приспособительный характер. Реакции системы крови проявляются повышением кислородной емкости крови за счет усиленного вымывания эритроцитов из костного мозга и активации эритропоэза за счет усиленного образования эритропоэтических факторов. Большое значение имеют свойства Hb связывать почти нормальное количество O2 даже при значительном снижении парциального давления O2 в альвеолярном воздухе и в крови легочных капилляров. Вместе с тем Hb способен отдавать большее количество O2 даже при умеренном снижении pO2 в тканевой жидкости. Усилению диссоциации O2Hb способствует ацидоз. Тканевые приспособительные механизмы - ограничение функциональной активности органов и тканей, непосредственно не участвующих в обеспечении транспорта O2, увеличение сопряженности окисления и фосфорилирования, усиление анаэробного синтеза АТФ за счет активации гликолиза. Увеличивается синтез глюкокортикоидов, которые стабилизируют мембраны лизосом, активируют ферментные системы дыхательной цепи. Увеличивается количество митохондрий на единицу массы клетки. БИЛЕТ 29 1.Механизмы развития ангиоспастической ишемии. 2.Медиаторы воспаления, виды и механизмы образования. 3.Патогенез третьей стадии лихорадки. 4.Механизмы развития гипероксической гипоксии. 1вопрос Ангиоспастическая ишемия возникает вследствие спазма артерий, вызванного эмоциональным воздействием (страх, волнение, гнев), физическими факторами (холод, травма, механическое раздражение), химическими агентами, биологическими раздражителями (токсины бактерий) и т.д. В основе спазма могут лежать нервные рефлекторные механизмы или непосредственное действие раздражителей на гладкие мышцы сосудов (влияние вазопрессина, ангиотензина II, эндотелина). 2вопрос Медиаторы воспаления различаются ● по времени их активности: ранние и поздние; ● по точке приложения: влияющие на сосуды или на клетки и ● по происхождению: гуморальные (плазменные) и клеточные. Источниками медиаторов воспаления могут быть белки крови и межклеточной жидкости, все клетки крови, клетки соединительной ткани, нервные клетки, неклеточные элементы соединительной ткани. Различают преформированные и вновь образующиеся медиаторы. Преформированные медиаторы синтезируются постоянно без всякого повреждения, накапливаются в специальных хранилищах и высвобождаются немедленно после повреждения (например - гистамин). Синтез других медиаторов начинается после повреждения, как ответная мера. Такие медиаторы называются вновь образующимися (например простагландины). Повреждение ткани сопровождается активацией специальных протеолитических систем крови, что ведет к появлению в очаге воспаления различных пептидов, выполняющих роль медиаторов воспаления. Вазоактивные кинины образуются так же при активации фибринолитической системы активированным фактором Хагемана, который превращает циркулирующий в крови неактивный плазминоген в активный фермент плазмин. Плазмин расщепляет фибрин (а своевременное переваривание фибрина необходимо для успешного заживления ран). При этом образуются пептиды, способные расширять сосуды и поддерживать увеличенную сосудистую проницаемость. Плазмин активирует систему комплемента. Система комплемента, включающая около 20 различных белков, активируется кроме фактора Хагемана еще двумя путями: классическим - это комплекс антиген-антитело и альтернативным - это липополисахариды микробных клеток. В воспалении участвуют С3а и С5а компоненты комплемента, которые опсонизируют и лизируют бактерии, вирусы и патологически измененные собственные клетки; способствуют дегрануляции тучных клеток и базофилов с высвобождением медиаторов. Компоненты комплемента вызывают также адгезию, агрегацию и дегрануляцию клеток крови, выход лизосомальных ферментов, образование свободных радикалов, ИЛ-1, стимулируют хемотаксис, лейкопоэз и синтез иммуноглобулинов. Медиаторы плазменного и клеточного происхождения взаимосвязаны и действуют по принципу аутокаталитической реакции с обратной связью и взаимным усилением. 3Вопрос Патогенез 3 стадии (снижения температуры) проявляется клинически потоотделением. Потоотделение является основным видом отдачи тепла в период снижения температуры и возврата ее к норме. Температура тела может падать быстро (критически) и медленно (литически). Быстрое падение температуры может быть опасным, особенно у лиц пожилого возраста, перенесших инфаркт миокарда или имеющих кардиосклероз. Кризис может привести к коллапсу от острой сердечной недостаточности. 4вопрос Гипероксическая гипоксия (в авиации, при кислородотерапии) - могут быть 2 формы кислородного отравления - легочная и судорожная. Патогенез легочной формы связывают с исчезновением "опорной" функции иннертного газа, токсическим действием O2 на эндотелий сосудов легких - повышением их проницаемости, вымыванием сурфактанта, спадением альвеол и развитием ателектаза и отека легких. Судорожная форма связана с резким возбуждением всех отделов ЦНС, особенно ствола мозга + нарушение тканевого дыхания. Гипероксическая гипоксия развивается в результате патогенно высокого парциального давления кислорода (pO2) во вдыхаемом воздухе. Это приводит к значительному повышению напряжения О2 в различных тканях организма, что и становится основным звеном патогенеза гипероксической гипоксии. В патогенезе данной гипоксии основное место отводят следующим факторам: - токсическому действию как на клеточные, так и интерстициальные структуры организма кислорода, его свободных радикалов и перекисей; - недостатку (угнетению) антиоксидантной системы (SH-содержащих энзимов, глутатионов, пероксидазы, каталазы, супероксид-дисмутазы и др.); - снижению в спинном и головном мозге содержания тормозных медиаторов — глицина и ГАМК (нередко обусловливающему развитие судорожного синдрома, т.н. кислородной эпилепсии); - угнетению синтеза ДНК и РНК в тканях, а значит угнетению и извращению образования и действия внутриклеточных белков и различных пептидных ФАВ, в том числе гормонов; - повреждению клеточных и субклеточных мембран различных тканей и органов (мозга, печени, почек и, особенно, лёгких) и т.д. БИЛЕТ 30 1.Общие механизмы формирования претромботических состояний. 2.Основные саногенетические реакции при воспалении. 3.Основные виды нарушения теплового баланса организма, механизмы развития и последствия. 4.Устойчивость отдельных органов и тканей к кислородному голоданию. Факторы, определяющие индивидуальную чувствительность организма к гипоксии. 1вопрос Претромботическое состояние системы гемостаза (ПССГ), так называемая «тромботическая болезнь», – это состояние организма, которое характеризуется склонностью к повышенному внутрисосудистому свертыванию крови и тромбообразованию. Данный патологический процесс обусловлен нарушениями регуляторных механизмов системы гемостаза, приводящими к изменениям свойств и функционирования отдельных ее звеньев. 1) дефицит ингибиторов коагуляционного звена системы гемостаза (антитром- бнна III, альфа-2-макроглобулина, протеина С, протеина S); 2) увеличение в крови уровня фибриногена, факторов VII и VIII, фактора Виллебранда; 3) повышение функциональной активности тромбоцитов; 4) снижение фибринолитической актив ности крови; 5) снижение антитромбогенной активности сосудистой стенки. Повы шенная наклонность к тромбогенезу, обусловленная указанными изменениями в системе гемостаза, наблюдается при различных по этиологии и клиническим прояв лениям заболеваниях, а также некоторых состояниях организма 2.вопрос Покраснение является следствием артериальной гиперемии, и, следовательно, не может иметь патогенетического смысла, поскольку артериальная гиперемия ведет к усилению насыщения тканей кислородом, увеличению приноса с кровью питательных веществ, интенсивному удалению обменных шлаков. Припухлость, то есть увеличение воспаленного участка в объеме и сдавление вследствие этого окружающих тканей, носит несомненно защитный характер, поскольку при этом в первую очередь сдавливаются наиболее мягкие образования, к которым относятся вены и лимфатические сосуды. Их сдавление препятствует оттоку крови и лимфы от очага воспаления, а следовательно, не дает возможности воспалительному агенту диссеминировать по организму. Другими словами, осуществляется локализация причинного фактора в месте его воздействия. Боль представляет собой сигнал для организма об определенном неблагополучии в каком-либо из его регионов. Она заставляет щадить пораженный орган, а для человека является причиной обращения к врачу на самой ранней стадии процесса, пока последний еще не вызвал необратимых изменений в органах и тканях. Согласно образному выражению врачей древности: «Боль - это сторожевой пес здоровья». Ограничение функции воспаленного участка переводит его в щадящий режим деятельности, что способствует менее интенсивному протеканию воспалительной реакции и меньшей степени альтерации тканей. Таким образом, можно утверждать, что кардинальные признаки воспаления либо имеют выраженный защитно-приспособительный характер, либо в их основе лежат соответствующие саногенетические реакции. Теперь рассмотрим значимость основных компонентов воспаления. Альтерация, хотя и приводит к гибели определенного количества клеток, но именно она «запускает» всю воспалительную реакцию, направленную на локализацию, уничтожение или удаление вредоносного агента. Альтерация является для клеток и тканей сигналом о наступившем неблагополучии и включает ряд механизмов, направленных на то, чтобы снизить интенсивность повреждения, локализовать его и восполнить возникший дефект. Экссудация приводит к возникновению воспалительного отека, который, сдавливая вены и лимфатические сосуды, препятствует диссеминации воспалительного агента. Экссудация также является пусковым моментом процессов миграции лейкоцитов, то есть самой первой стадией процесса фагоцитоза, без которой он невозможен, поскольку для того, чтобы лейкоциты вышли из просвета сосуда и направились бы в эпицентр воспаления, необходимо повышение проницаемости стенок сосудов и замедление кровотока. Пролиферация в целом направлена на восполнение возникшего в процессе воспалительной реакции тканевого дефекта: она является фактором несомненно положительным, направленным на достижение полного выздоровления. В очаге воспаления существенно меняется энергетический обмен, в частности, процессы анаэробного расщепления углеводов начинают преобладать над процессами их аэробного метаболизма. С точки зрения энергетического баланса клеток это, действительно, менее для них выгодно. Однако для такой стадии фагоцитоза, как передвижение лейкоцитов к объекту, усиление анаэробных процессов образования энергии является необходимым. Наконец, образование в очаге воспаления биологически активных веществ интенсифицирует динамику воспаления, что ведет к более быстрому и выгодному для организма его завершению. 3.вопрос Действие различных факторов может привести к изменению теплового баланса организма, что проявляется либо гипертермическими, либо гипотермическими состояниями (схема). Гипертермические состояния характеризуются повышением, а гипотермические — понижением температуры тела, соответственно выше и ниже нормы. Чаще эти отклонения носят временный, обратимый характер (например, при лихорадке и гипертермических реакциях). Однако если патогенный агент обладает высоким повреждающим действием, а адаптивные механизмы организма недостаточны, то указанные состояния могут перейти гомеостатический порог и даже обусловить смерть человека. 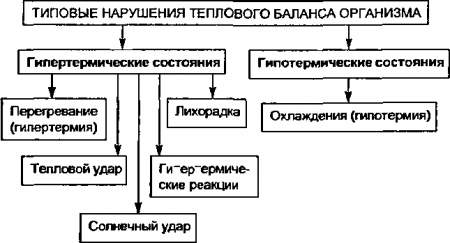 ГИПЕРТЕРМИЧЕСКИЕ СОСТОЯНИЯ И ИХ ВИДЫ ГИПЕРТЕРМИЯ Гипертермия, или перегревание организма, — типовая форма расстройства теплового обмена, возникающая в результате действия высокой температуры окружающей среды или нарушения процессов теплоотдачи организма. Она характеризуется срывом механизмов теплорегуляции и проявляется повышением температуры тела выше нормы. • высокая температура окружающей среды; • факторы, препятствующие теплоотдаче, что сопровождается увеличением образования доли так называемой свободной энергии, выделяющейся в виде тепла; • влияние разобщителей процессов окисления и фосфорилирования в митохондриях клеток, что может быть следствием: — первичного расстройства механизмов терморегуляции, например при кровоизлиянии в область гипоталамуса, участвующего в регуляции температурного режима организма; — нарушения процессов отдачи тепла в окружающую среду, например у тучных людей, при ношении влагонепроницаемой одежды или высокой влажности воздуха. Эти факторы могут действовать содружественно и повышать возможность возникновения гипертермии. Различают две стадии гипертермии — компенсации (адаптации) и декомпенсации (деадаптации) механизмов терморегуляции организма. Стадия компенсации характеризуется активацией экстренных механизмов адаптации организма к перегреванию. Эти механизмы направлены на увеличение теплоотдачи и снижение теплопродукции. В результате температура тела хотя и повышается, однако остается в пределах верхней границы нормального диапазона. Стадия декомпенсации характеризуется срывом и неэффективностью как центральных, так и местных механизмов терморегуляции. Это обусловливает нарушение температурного гемостаза организма, что является главным звеном патогенеза стадии. |
