Билет 1 Этиология, патогенез и последствия кишечной непроходимости
 Скачать 0.64 Mb. Скачать 0.64 Mb.
|
|
патогенез В большинстве случаев в основе дыхательной недостаточности лежит развитие кислородного голодания организма в результате гиповентиляции альвеол легких, приводящей к снижению РО2 и повышению РСО в альвеолярном воздухе, снижению градиента давления этих газов на альвеолокапиллярной мембране и, следовательно, газообмена между альвеолярным воздухом и кровью легочных капилляров. В результате этих процессов при ОДН нарушается распределение кислоро да по органам и тканям. механизмы компенсации Н. М. Рябова (1974) различает четыре типа компенсаторной гипервентиляции при острой дыхательной недостаточности.
3. Основные проявления наследственной тубулярной патологии. Наследственные тубулопатии могут сопровождаться полиурией (почечный несахарный диабет, почечная глюкозурия); ставать причиной деформации костей скелета (фосфат-диабет, болезнь де-Тони-Дебре-Фанкони); протекать с выраженным нефролитиазом (синдром Дента, алкапурия, ксантинурия, глицинурия, гипероксалурия, цистинурия); вызывать повышение артериального давления (синдром Барттера); провоцировать снижение концентрации магния в крови (семейная гипомагниемия, синдром Иггельмана). БИЛЕТ 6 1. Общая этиология заболеваний печени, примеры. Общая этиология и патогенез нарушений функций печени Среди многочисленных этиологических факторов наибольшее значение имеют: 1. Инфекционные агенты, в первую очередь гепатотропные вирусы (А, В, С, D, Е, F, G, TTV и др.). Идентификация этих вирусов стала возможной благодаря методу иммуноферментного анализа с определением антигенов и антител, полимеразной цепной реакции с определением РНКили ДНК-вирусов. Меньшую роль играют вирусы Эпштейна-Барр, цитомегаловирус, вирус простого герпеса, вирус Коксаки и др. Некоторые инфекции (бруцеллез, лептоспироз, сальмонеллез и др.) также могут вызывать нарушение функций печени, но это рассматривается уже как вторичный синдром.
2. Острая или хроническая алкогольная интоксикация. 3. Гепатотоксические вещества-ксенобиотики: • промышленные яды (производные бензола, свинца, ртути, толуола, фосфорорганические соединения, хлороформ, четыреххлористый углерод, кислоты, нитрокраски, щелочи и др.); • лекарственные препараты (антибиотики, сульфаниламиды, наркотические, снотворные и противовоспалительные средства - бруфен, индометацин, парацетамол и др.); • грибной яд - фаллоидин, фаллоин, содержащийся в бледной поганке; • афлатоксины (плесневые грибы); • красители, бытовые химические вещества; 4. Паразитарные, опухолевые поражения печени. 5. Нарушение оттока желчи. 6. Нарушение кровоснабжения, длительный венозный застой в печени (гипоксия гепатоцитов). Наибольшее клиническое значение имеет развитие портальной гипертензии - стойкого повышения давления в сосудах системы воротной вены выше нормы (выше 6 мм рт.ст.). Наиболее частые причины: ♦ цирроз печени; ♦ шистосомоз; ♦ опухоли печени; ♦ гемохроматоз; ♦ блокада притока крови по портальным сосудам (например, в результате сдавления, окклюзии, аневризм, тромбозов ствола воротной или селезёночной вены); ♦ препятствие оттоку крови от печени (например, при сердечной недостаточности; при тромбозе, эмболии, сдавлении нижней полой вены).
7. Наследственные нарушения метаболизма (при болезни Вильсона-Коновалова, гемохроматозе, недостаточности а1-антитрипсина). Повреждение печени может быть первичным (например, при вирусных гепатитах) либо вторичным (вследствие генерализованных заболеваний - туберкулеза, алкогольной болезни, сепсиса и др.). 2. Основные типы патологического дыхания, их характеристика. брадипноэ - редкое, менее 12 дыхательных движений в минуту, дыхание. Рефлекторное уменьшение частоты дыхания наблюдается при повышении артериального давления (рефлекс с барорецепторов дуги аорты), при гипероксии в результате выключения хеморецепторов, чувствительных к понижению раО2. При стенозировании крупных дыхательных путей возникает редкое и глубокое дыхание, называемое стенотическим. Брадипноэ возникает при гипокапнии, развивающейся при подъеме на большую высоту (горная болезнь). Угнетение дыхательного центра и развитие брадипноэ может иметь место при длительной гипоксии (пребывание в условиях разреженной атмосферы, недостаточность кровообращения и др.), действии наркотических веществ, органических поражениях головного мозга; полипноэ (тахипноэ) - частое, более 24 дыхательных движений в минуту, поверхностное дыхание. Этот вид дыхания наблюдается при лихорадке, функциональных нарушениях деятельности центральной нервной системы (например, истерии), поражениях легких (пневмония, застой в легких, ателектаз), болях в грудной клетке, брюшной стенке (боль приводит к ограничению глубины дыхания и увеличению его частоты, развивается щадящее дыхание). Тахипноэ способствует развитию альвеолярной гиповентиляции в результате преимущественной вентиляции анатомически мертвого пространства;
гиперпноэ - глубокое и частое дыхание. Отмечается при повышении основного обмена: при физической и эмоциональной нагрузке, тиреотоксикозе, лихорадке. Если гиперпноэ вызвано рефлекторно и не связано с повышением потребления кислорода и выведения СО2, то гипервентиляция приводит к гипокапнии, газовому алкалозу. Это возникает вследствие интенсивной рефлекторной или гуморальной стимуляции дыхательного центра при анемиях, ацидозе, снижении содержания кислорода во вдыхаемом воздухе. Крайняя степень возбуждения дыхательного центра проявляется в виде дыхания Куссмауля; апноэ - отсутствие дыхания, но обычно подразумевается временная остановка дыхания. Может возникнуть рефлекторно при быстром подъеме артериального давления (рефлекс с барорецепторов), после пассивной гипервентиляции пациента под наркозом (снижение раСО2). Апноэ может быть связано с понижением возбудимости дыхательного центра (при гипоксии, интоксикациях и др.). Торможение дыхательного центра вплоть до его остановки может возникать при действии наркотических препаратов (эфир, хлороформ, барбитураты и др.), при понижении содержания кислорода во вдыхаемом воздухе. Нарушения ритма дыхательных движений Типы периодического дыхания. Периодическим дыханием называется такое нарушение ритма дыхания, при котором периоды дыхания чередуются с периодами апноэ. К нему относятся дыхание Чейна-Стокса и дыхание Биота 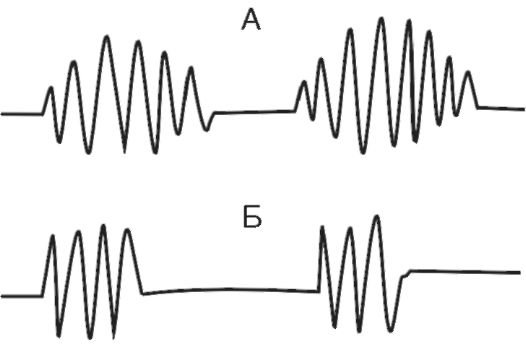
(рис. 16-4). При дыхании Чейна- Стокса паузы (апноэ - до 5-10 с) чередуются с дыхательными движениями, которые сначала нарастают по глубине, затем убывают. При дыхании Биота паузы чередуются с дыхательными движениями нормальной частоты и глубины. В основе патогенеза периодического дыхания лежит понижение возбудимости дыхатель- ного центра Рис. 16-4. А - дыхание Чейна-Стокса; Б - дыхание Биота . Оно может возникать при органических поражениях головного мозга - травмах, инсультах, опухолях, воспалительных процессах, при ацидозе, диабетической и уремической комах, при эндогенных и экзогенных интоксикациях. Возможен переход в терминальные типы дыхания. Иногда периодическое дыхание наблюдается у детей и людей старческого возраста во время сна. В этих случаях нормальное дыхание легко восстанавливается при пробуждении. В основе патогенеза периодического дыхания лежит снижение возбудимости дыхательного центра (или другими словами - повышение порога возбудимости дыхательного центра). Предполагают, что на фоне пониженной возбудимости дыхательный центр не реагирует на нормальную концентрацию углекислого газа в крови. Для возбуждения дыхательного центра требуется большая его концентрация. Время накопления этого раздражителя до пороговой дозы определяет длительность паузы (апноэ). Дыхательные движения создают вентиляцию легких, СО2 вымывается из крови, и дыхательные движения вновь замирают. Терминальные типы дыхания. К ним относятся дыхание Куссмауля (большое дыхание), апнейстическое дыхание и гаспингдыхание.
Дыхание Куссмауля - большое, шумное, глубокое дыхание («дыхание загнанного зверя»), характерное для пациентов с нарушением сознания при диабетической, уремической комах, при отравлении метиловым спиртом. Дыхание Куссмауля возникает в результате нарушения возбудимости дыхательного центра на фоне гипоксии мозга, ацидоза, токсических явлений. Глубокие шумные вдохи с участием основной и вспомогательной дыхательной мускулатуры сменяются активным форсированным выдохом. Апнейстическое дыхание (рис. 16-5) характеризуется продолжительным вдохом и изредка прерывающимся, форсированным коротким выдохом. Длительность вдохов многократно превышает продолжительность выдохов. Развивается при поражении пневмотаксического комплекса (передозировка барбитуратов, травмы головного мозга, инфаркт моста мозга). Такой вид дыхательных движений возникает в эксперименте после перерезки у животного обоих блуждащих нервов и ствола на границе между верхней и средней третью моста. После подобной перерезки устраняются тормозные влияния верхних отделов моста на нейроны, отвечающие за вдох. Рис. 16-5. А - эупноэ; Б - апнейстическое дыхание; В - гаспингдыхание 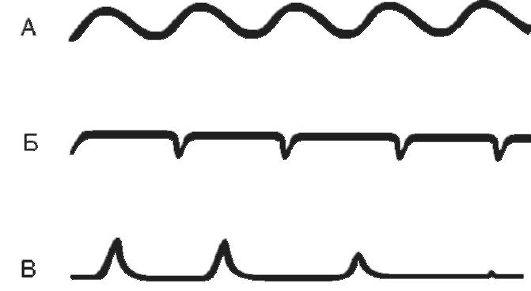 Гаспинг-дыхание (от англ. gasp - ловить воздух ртом, задыхаться) возникает в самой терминальной фазе асфиксии (т.е. при глубокой гипоксии или гиперкапнии). Оно встречается у недоношенных детей и при многих патологических состояниях (отравлениях, травмах, кровоизлияниях и тромбозах ствола головного мозга). Это единичные, редкие, убывающие по силе вдохи с длительными (по 10-20 с) задержками дыхания на выдохе. В акте дыхания при гаспинге участвуют не только диафрагма и дыхательные мышцы грудной клетки, но и мускулатура шеи и рта. Источником импульсов при данном виде дыхательных движений являются клетки каудальной части продолговатого мозга при прекращении функции вышележащих отделов мозга.
Различают еще диссоциированное дыхание - нарушение дыхания, при котором наблюдаются парадоксальные движения диафрагмы, асимметрии движения левой и правой половины грудной клетки. «Атаксическое» уродливое дыхание Грокко-Фругони характеризуется диссоциацией дыхательных движений диафрагмы и межреберных мышц. Это наблюдается при нарушениях мозгового кровообращения, опухолях мозга и других тяжелых расстройствах нервной регуляции дыхания. 3. Этиология и патогенез острой почечной недостаточности. Острая почечная недостаточность (ОПН) - это быстро возникающее, потенциально обратимое, резкое снижение функции почек, сопровождающееся появлением гиперазотемии и многих других нарушений гомеостаза и функций органов.
Различают три формы ОПН: 1) преренальную, характеризующуюся нарушением почечной гемодинамики без повреждения паренхимы почек; 2) ренальную, связанную с повреждением аппарата почечных канальцев; 3) постренальную, обусловленную остро возникающей окклюзией мочевыводящих путей. Этиология ОПН Преренальная ОПН возникает при значительном снижении перфузии почечных сосудов, обусловленном острой системной гипотонией (шок, коллапс), снижением объема экстрацеллюлярной жидкости (кровопотеря, обезвоживание), уменьшением эффектив- ного объема кровотока при обширных отеках и водянках (цирроз печени, сердечная недостаточность). Реналыная ОПН относятся такие воздействия, которые обусловливают не только снижение клубочковой фильтрации, но и резко выраженное нарушение функции канальцев вследствие развития в них дистрофических изменений вплоть до острого некроза. По этиологии различают два типа острого канальцевого некроза (ОКН) - ишемический и нефротоксический. Причинами первого из них может быть резкое снижение системного артериального давления, особенно в сочетании с ДВС-синдромом и сладжем, при тех же состояниях, которые играют роль в развитии преренальной ОПН, но более резко выраженных и длительно действующих; нередко такое состояние может развиться после обширных хирургических операций, особенно осложненных сепсисом. Нефротоксический ОКН развивается при прямом повреждающем действии на эпителий канальцев промышленных ядов (соли ртути, меди, платины, висмута, хрома, серебра, урана, мышьяка), радиоконтрастных средств, лекарственных препаратов (аминогликозидные антибиотики, нестероидные противовоспалительные средства, цисплатин, сульфаниламиды! и др.), грибных и змеиных ядов, бактериальных токсинов (при сепсисе, анаэробной инфекции). Кроме того, к факторам, вызывающим ренальную ОПН, относят блокаду почечных канальцев миоглобином при рабдомиолизе (краш-синдром, чрезмерные физические нагрузки, приступы судорог и др.), гемоглобином (при резко выраженном гемолизе), легкими цепями иммуноглобулинов (при миеломе), уратами (при чрезмерно выраженном распаде нуклеопротеидов в связи с противоопухолевой терапией). Примерно в 15-25% случаев ренальная ОПН обусловлена воспалительными процессами в почечной паренхиме, такими, как острый гломерулонефрит и пиелонефрит, интерстициальный нефрит, васкулит и др.
Постренальной ОПН являться нарушение проходимости обоих мочеточников (закупорка камнями, кровяными сгустками и др.), рак мочевого пузыря, простаты и др. Патогенез ОПН Основными патогенетическими факторами при развитии ОПН являются резкое снижение клубочковой фильтрации и повреждение канальцевого эпителия в связи с ишемией или действием нефротоксинов, что сопровождается нарушением процессов реабсорбции, секреции и экскреции (рис. 19-3). Снижение фильтрации может быть обусловлено спазмом почечных артериол в связи с падением системного артериального давления (централизация кровообращения); нарушением их проходимости из-за сладжа эритроцитов или образования микротромбов (ДВС-синдром), замедлением кровотока и снижением фильтрационного давления при обезвоживании. Констрикция почечных артериол может быть результатом внутрипочечной перестройки кровотока, происходящей независимо от состояния системного кровообращения: вследствие пониженной реабсорбции натрия из-за повреждения эпителия канальцев повышается концентрация его в канальцевой жидкости. Это стимулирует через рецепторы, заложенные в macula densa, продукцию ренина и ангиотензина-II, который вызывает констрикцию афферентных артериол почечных клубочков, что сопровождается шунтированием крови на уровне кортикомедуллярной зоны. В патогенезе расстройств почечного кровообращения важную роль играет нарушение равновесия между NO, расширяющим сосуды, и эндотелином, вызывающим их спазм. Различные нефротоксины в большинстве случаев оказывают прямое повреждающее действие на эпителий канальцев, вызывая нарушение ферментативно-обменных реакций, окислительных процессов, структуры и функции клеточных мембран. В повреждении и гибели канальцевого эпителия играет роль нарушение внутриклеточного гомеостаза кальция (содержание его в цитоплазме возрастает). Это сопровождается повреждением митохондрий, усилением перекисного окисления липидов (ПОЛ) и активацией фосфолипаз, в том числе фосфолипазы А2. Под действием последней высвобождается арахидоновая кислота. При ее расщеплении образуются тромбоксаны и лейкотриены, являющиеся хематтрактантами для нейтрофилов, повреждающих клетки своими лизосомальными ферментами и активными радикалами кислорода. 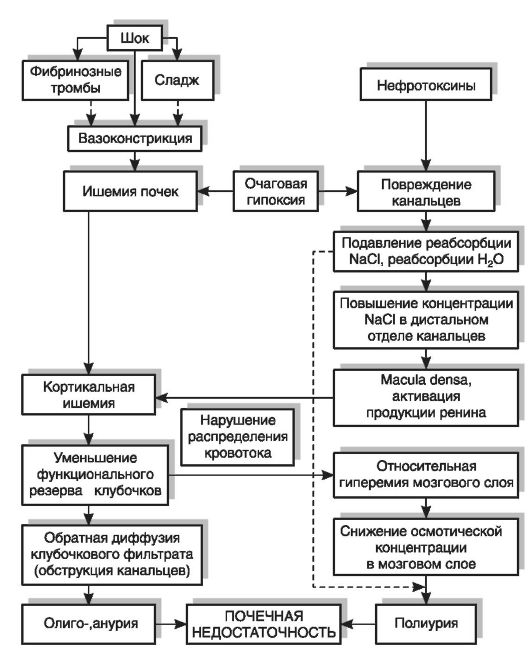
В патогенезе ОПН при остром гломерулонефрите играют роль нарушения кровообращения в клубочках и интерстициальной ткани, заполнение капсулы Боумена экссудатом и пролиферирующими клетками, отек интерстиция, повышение внутрипочечного давления, нарушение проходимости канальцев в результате обтурации кровяными сгустками. В механизме развития постренальной ОПН главную роль играет повышение внутрипочечного давления в связи с наличием препятствия для оттока мочи |
