Билет 1 Этиология, патогенез и последствия кишечной непроходимости
 Скачать 0.64 Mb. Скачать 0.64 Mb.
|
|
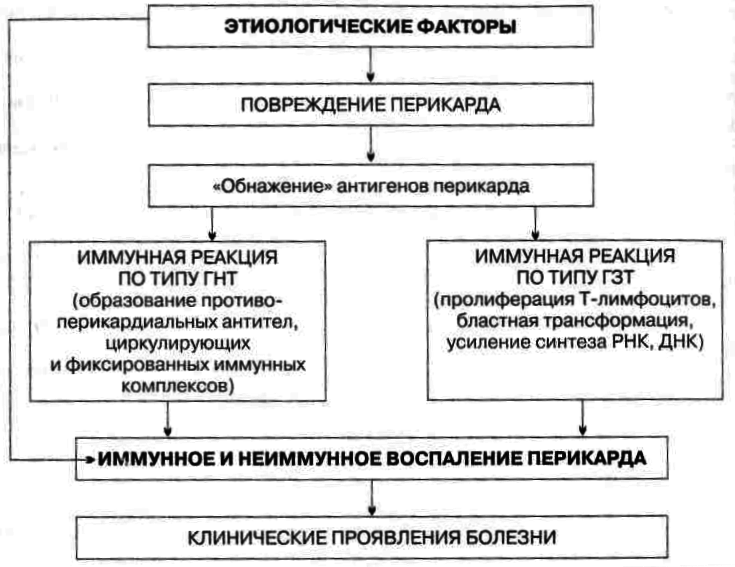
2. Пароксизмальная тахикардия, особенности механизмов развития, проявления. Методы купирования приступа пароксизмальной тахикардии. Пароксизмальная тахикардия – приступы эктопической наджелудочковой (предсердной, предсердно-желудочковой) или желудочковой тахикардии, характеризующиеся регулярным ритмом с частотой около 140 – 240 ударов в минуту, внезапным началом и внезапным окончанием. Патофизиологической основой заболевания является в большинстве случаев циркуляция импульса, реже – повышение автоматизма участков проводящей системы дистальнее синусового узла. Пароксизм обычно ощущается больным как приступ сердцебиения с отчетливым началом и окончанием, продолжительностью от нескольких секунд до не скольких дней. Приступу может предшествовать появление или учащение экстрасистол того же уровня. Во время приступа при пальпации пульса и аускультации выявляют частый правильный ритм. Наджелудочковая, особенно предсердная, тахикардия часто сопровождается различными проявлениями вегетативной дисфункции – потливостью, обильным мочеиспусканием в конце приступа, увеличением перистальтики кишечника, небольшим повышением температуры тела. Затянувшиеся приступы сопровождаются слабостью, обмороками, неприятными ощущениями в области сердца, а при наличии заболевания сердца – стенокардией, появлением или нарастанием сердечной недостаточности. Массаж каротидного синуса при наджелудочковой тахикардии иногда позволяет сразу нормализовать ритм, хотя бы кратковременно При желудочковой тахикардии в отличие от наджелудочковой, массаж каротидного синуса и другие ваготропные воздействия не влияют на ритм. На ЭКГ при наджелудочковой тахикардии ритм частый правильный, видны неизмененные желудочковые комплексы, перед которыми при предсердной тахикардии может быть различим слегка деформированный зубец Р. Зубец Р может быть неразличим при предсердно-желудочковой тахикардии. Предсердная тахикардия нередко сопровождается нарушением предсердно-желудочковой и (или) внутрижелудочковой проводимости, чаще по правой ножке пучка Гиса. При желудочковой тахикардии видны значительно деформированные комплексы QRST. Предсердия могут возбуждаться ретроградно или независимо от желудочков в правильном ритме, но зубец Р в основном накладывается на желудочковые комплексы и поэтому не всегда различим, если возбуждение, пришедшее из предсердий, случайно захватывает желудочки или часть желудочков после выхода из рефрактерного состояния. В большинстве случаев пароксизмы наджелудочковой тахикардии – проявление нейроциркуляторной дистонии, однако они встречаются при любых заболеваниях сердца. Пароксизмы провоцируются нагрузкой (эмоциональной, физической), курением, алкоголем, гипоксией. Пароксизмы предсердной тахикардии, особенно в сочетании с предсердно-желудочковой блокадой, могут быть проявлением интоксикации сердечными гликозидами, выраженного дефицита калия. Пароксизмы наджелудочковой тахикардии наблюдаются при синдроме слабости синусного узла и синдроме Вольффа – Паркинсона – Уайта. Пароксизмы желудочковой тахикардии почти всегда связаны с серьезным заболеванием сердца (острый инфаркт миокарда, аневризма сердца, миокардит, тяжелый порок и др., интоксикация сердечными гликозидами или хинидином) и расцениваются как угрожающее состояние. Они тяжелее переносятся больными, чем пароксизмы наджелудочковой тахикардии, чаще приводят к тяжелой артериальной гипотензии, нарушению кровоснабжения органов, нарастанию ишемии миокарда и сердечной недостаточности 3. Печеночная кома, виды и механизмы развития, последствия. Печёночная кома. Финалом прогрессирующей печёночной недостаточности является кома. Она характеризуется потерей сознания, подавлением или значительным снижени ем выраженности рефлексов и расстройствами жизнедеятельности организма (включая нарушения дыхания и кровообращения), чреватыми смертью. Причины: 1. Шунтовая кома («обходная»). Причина шунтовой комы: инток сикация организма продуктами метаболизма, а также экзогенными веществами, в норме обезвреживающимися гепатоцитами. Это является результатом по падания их в общий кровоток, минуя печень, по портокавальным анастомо зам. Последние развиваются в связи с портальной гипертензией. 2. Паренхиматозная кома. Причина печёночно-клеточной (паренхиматозной) комы: интоксикация организма в связи с повреждением и гибелью значи тельной массы печени (например, при её травме, некрозе, удалении). В ре зультате этого нарушаются все функции печени. Наибольшее патогенное зна чение при этом имеет утрата дезинтоксикационной функции. Патогенез: • Гипогликемия. Является результатом нарушения гликогенеза и гликогенолиза. • Ацидоз (метаболический, на финальных стадиях дополнительно развивается респираторный и выделительный ацидоз). • Дисбаланс ионов в клетках, интерстициальной жидкости и в крови (в крови нарастает [К+], в клетках — [Na+], [Ca2+], [Н+]). • Интоксикация организма — эндотоксинемия (особенно продуктами бел кового и липидного метаболизма, а также непрямым билирубином, что обус ловлено нарушением его трансформации и конъюгации с глюкуроновой кис лотой). • Нарушения центральной, органотканевой и микрогемоциркуляции как следствие сердеяной недостаточности, нарушения тонуса артериол, развтите феномена сладжа. • Полиорганная недостаточность – нарушение функции сердца, дыхательного и кардиовазомоторного центров. Приводит к смешанной гипоксии, прекращению сердечной деятельности, дыхания, смерть. БИЛЕТ 16 1. Гипертоническая болезнь, причины и механизмы развития. Гипертоническая болезнь - патология сердечно-сосудистого аппарата, развивающаяся в результате дисфункции высших центров сосудистой регуляции, нейрогуморального и почечного механизмов и ведущая к артериальной гипертензии, функциональным и органическим изменениям сердца, центральной нервной системы и почек. Распространенность гипертонической болезни среди женщин и мужчин приблизительно одинаковая -10-20%, чаще заболевание развивается в возрасте после 40 лет, хотя гипертония нередко встречается даже у подростков. Гипертоническая болезнь способствует более быстрому развитию и тяжелому течению атеросклероза и возникновению опасных для жизни осложнений. Наряду с атеросклерозом гипертония является одной из самых частых причин преждевременной смертности молодого трудоспособного населения. Ведущее проявление гипертонической болезни - стойко высокое артериальное давление, т. е. АД, не возвращающееся к нормальному уровню после ситуативного подъема в результате психоэмоциональных или физических нагрузок, а снижающееся только после приема гипотензивных средств. Согласно рекомендациям ВОЗ, нормальным является артериальное давление, не превышающее 140/90 мм рт. ст. Превышение систолического показателя свыше 140-160 мм рт. ст. и диастолического - свыше 90—95 мм рт. ст., зафиксированное в состоянии покоя при двукратном измерении на протяжении двух врачебных осмотров, считается гипертонией. Различают первичную (эссенциальную) артериальную гипертонию (или гипертоническую болезнь) и вторичную (симптоматическую)артериальную гипертензию. Симптоматическая гипертензия составляет от 5 до 10% случаев гипертонии. Вторичная гипертензия служит проявлением основного заболевания: болезней почек (гломерулонефрита, пиелонефрита, туберкулеза, гидронефроза, опухолей, стеноза почечной артерии), щитовидной железы (тиреотоксикоза), надпочечников (феохромоцитомы, синдрома Иценко-Кушинга, первичного гиперальдостеронизма), коарктации или атеросклероза аорты и др. Первичная артериальная гипертония развивается как самостоятельное хроническое заболевание и составляет до 90% случаев артериальных гипертензий. При гипертонической болезни повышенное давление является следствием дисбаланса в регулирующей системе организма. Механизм развития гипертонической болезни В основе патогенеза гипертонической болезни лежит увеличение объема минутного сердечного выброса и сопротивления периферического сосудистого русла. В ответ на воздействие стрессового фактора возникают нарушения регуляции тонуса периферических сосудов высшими центрами головного мозга (гипоталамусом и продолговатым мозгом). Возникает спазм артериол на периферии, в т. ч. почечных, что вызывает формирование дискинетичесного и дисциркуляторного синдромов. Увеличивается секреция нейрогормонов ренин-ангиотензин-альдостероновой системы. Альдостерон, участвующий в минеральном обмене, вызывает задержку воды и натрия в сосудистом русле, что еще более увеличивает объем циркулирующей в сосудах крови и повышает АД. При артериальной гипертензии увеличивается вязкость крови, что вызывает снижение скорости кровотока и обменных процессов в тканях. Инертные стенки сосудов утолщаются, их просвет сужается, что фиксирует высокий уровень общего периферического сопротивления сосудов и делает артериальную гипертензию необратимой. В дальнейшем в результате повышения проницаемости и плазматического пропитывания сосудистых стенок происходит развитие элластофиброза и артериолосклероза, что в конечном итоге ведет к вторичным изменениям в тканях органов: склерозу миокарда, гипертонической энцефалопатии, первичному нефроангиосклерозу. Степень поражения различных органов при гипертонической болезни может быть неодинаковой, поэтому выделяют несколько клинико-анатомических вариантов гипертонии с преимущественным поражением сосудов почек, сердца и мозга. 2. Типы патологической желудочной секреции. Связь секреторных и моторных нарушений. В основе нарушений пищеварения в желудке находятся парциальные, а чаще сочетанные расстройства секреторной, моторной, всасывательной, барьерной и защитной функций желудка . Характеристика расстройств секреторной функции желудка приведена на рисунке. 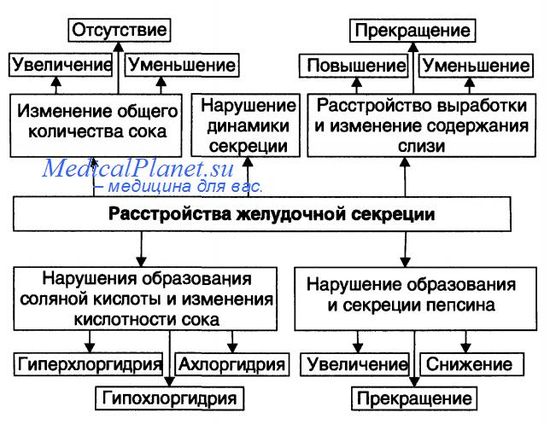 В целом указанные нарушения обусловливают несоответствие динамики и/или уровня секреции различных компонентов желудочного сока текущим реальным потребностям в них. • Нарушения динамики и общего объёма секреции желудочного сока. В зависимости от особенностей изменения секреторной функции желудка выделяют несколько её типов: тормозной, возбудимый, инертный, астенический. - Тормозной тип секреции желудочного сока. Увеличенный латентный период секреции (между пищевой стимуляцией желудка и началом секреции), сниженная интенсивность нарастания и активности секреции, укороченная длительность секреции, уменьшенный объём секрета. При крайней степени торможения секреции развивается ахилия — практическое отсутствие желудочного сока. - Возбудимый тип секреции желудочного сока. Укороченный латентный период начала секреции, интенсивное нарастание секреции, увеличенная длительность процесса секреции, повышенный объём желудочного сока. - Инертный тип секреции желудочного сока. Увеличенный латентный период, замедленное нарастание секреции, медленное её прекращение, увеличенный объём желудочного сока. - Астенический тип секреции желудочного сока. Укороченный латентный период начала сокоотделения, интенсивное начало и быстрое снижение секреции, малый объём желудочного сока. - Хаотический тип секреции желудочного сока. Характерно отсутствие каких-либо закономерностей динамики и объёмов секреции, периодов её активации и торможения в течение продолжительного времени (нескольких месяцев и лет). Общее количество сока, как правило, увеличено. Типовые расстройства секреторной функции желудка • Виды расстройств желудочной секреции. К расстройствам желудочной секреции относятся гиперсекреция, гипосекреция и ахилия. + Гиперхлоргидрия — увеличение количества желудочного сока, повышение его кислотности и переваривающей способности. Скорость перемещения химуса из желудка в кишечник замедляется, так как для нейтрализации сильно кислого содержимого желудка в 12-перстной кишке требуется больше времени, чем в норме. Создаются условия для длительного спазма пилоруса, в результате чего возникает боль. Также повышается количество желудочного сока, мышцы желудка перерастягиваются, их тонус повышается, что также приводит к болевому синдрому, возникают антиперистальтические волны. У больных возникают отрыжка кислым, изжога, рвота желудочным содержимым, купирующая болевой синдром при уменьшении тонуса желудочных мышц и приносящая облегчение больному. В результате частой рвоты теряются нутриенты, в кишечник поступает мало химуса, перистальтика ослабляется и развивают - Основные причины: увеличение массы секреторных клеток желудка (детерминируется генетически), активация влияний блуждающего нерва (например, при невротических состояниях или конституциональной ваготонии), повышение синтеза и/или эффектов гастрина, гипертрофия и/или гиперплазия энтерохромаффинных (энтероэндокринных) клеток (например, при гипертрофическом гастрите), перерастяжение антрального отдела желудка, действие некоторых ЛС (например, ацетилсалициловой кислоты или кортикостероидов). - Возможные последствия: замедление эвакуации пищевой массы из желудка, эрозии и изъязвления слизистой оболочки желудка, сопровождающийся изжогой гастроэзофагеальный рефлюкс, нарушения пищеварения в кишечнике. + Гипохлоргидрия — уменьшение объёма желудочного сока, снижение его кислотности и расщепляющей эффективности. . Тонус мышц желудка снижен, химус перемещается из желудка в 12-перстную кишку быстро большими порциями, так как он имеет почти щелочную реакцию и не нуждается в нейтрализации. Пилорический сфинктер постоянно открыт. При поступлении в кишечник большого количества необезвреженного химуса и присоединении инфекции стимулируется перистальтика кишечника, что приводит к диарее. С низким уровнем гастрина в крови коррелирует снижение тонуса нижнего пищеводного сфинктера, что проявляется отрыжкой воздухом, отчасти кислым, прогорклым, тухлым. При зиянии пилоруса развивается дуодено-гастральный рефлюкс. Основные причины: уменьшение массы секреторных клеток (например, при гипо- и атрофической форме хронического гастрита или распадающейся опухоли желудка), снижение эффектов блуждающего нерва (например, при неврозах или конституциональной симпатикотонии), снижение образования гастрина, дефицит в организме белков и витаминов, действие ЛС, снижающих или устраняющих эффекты блуждающего нерва (например, блокаторов холинорецепторов или активаторов холинэстераз) . + Ахилия — состояние, характеризующееся практически полным отсутствием желудочной секреции. Причина ахилии — значительное снижение или прекращение секреторной функции желудка. Ахилия функционального происхождения обусловлена наличием длительного угнетения как нервно-железистого аппарата самого желудка, так и нервных центров, регулирующих его работу. Снятие торможения с этих центров может привести к полному или частичному восстановлению секреторного процесса. 3. Наследственные гипербилирубинемии, виды и особенности патогенеза. (функциональный), или доброкачественная, гипер-билирубинемия, относится к группе заболеваний, развивающихся на фоне генетически обусловленных энзимопатий, характеризуются нарушением обмена билирубина и проявляются хронической или перемежающейся желтухой без выраженной изменения структуры и функции печени и клинических признаков повышенного гемолиза и холестаза. зависимости от особенностей нарушения билирубинового обмена выделяют следующие формы доброкачественных гипербилирубинемий, как синдромы Жильбера, Дабина-Джонсона, Ротора и Криглера-Найяра. К пигментные гепатозы относят постгепатитный доброкачественную гипербилирубинемию, возникающий вследствие перенесенного вирусного гепатита и также генетически детерминированной. . В настоящее время доказано, что так называемые доброкачественные (функциональные) гипербилирубинемии протекают на фоне поражения печени дистрофического характера с соответствующими ультраструктурные изменения в гепатоцитах, обусловленными генетически детерминированными энзимопатии. В МКБ-10 наследственные пигментные гепатозы представлены в рубрике Е80. Е80 нарушения обмена порфирина и билирубина. Е80.4 - синдром Жильбера. Е80.5 - синдром Криглера - Найяра. Е80.6 - Другие нарушения обмена билирубина. Синдром Жильбера известен под несколькими названиями: "физиологическая гипербилирубинемия", "семейная негемолитич-на желтуха", "доброкачественная гипербилирубинемия" и характеризуется повышением в крови уровня непрямого билирубина. Он был описан AN Gilbert и P.S. Lereboulet в 1900-1907 pp. под названием простой семейной желтухи, которая характеризовалась доброкачественностью, перемежающимся характером, отсутствием гемолиза и нарушением проходимости желчных путей. Этиология . Заболевание всегда носит наследственный характер и передается по аутосомно-доминантному типу, что обусловлено дефектом в зоне S-гена, контролирующего активность глюкуронилтрансферазы. Возникновению его способствуют такие факторы, как переохлаждение, переутомление, употребление медикаментов (например, экстракта мужского папоротника), интеркуррентные инфекции. У трети больных заболевание развивается вследствие перенесенного вирусного гепатита и также генетически обусловленным. В пользу этого утверждения есть ряд свидетельств: поражение, как и при чисто семейной форме, мужчин молодого возраста, относительная частота, значительная резистентность глюкуронидазнои активности печени, что делает маловероятным ее изолированное повреждение. Тогда говорят о доброкачественной постгепатитный гипербилирубинемию или постгепатитный форму синдрома Жильбера, понимая при этом, что вирусный гепатит играет роль фактора, который манифестирует (обнаруживает) наследственный дефект. Патогенез . Желтуха при синдроме Жильбера преимуществу такими факторами: нарушением как захват свободного билирубина из плазмы клетками печени, так и, пожалуй, внутриклеточного транспортировки этого пигмента в гепатоцитах, что доказано исследованиями с билирубином 14 С; торможением процесса с " соединения билирубина с глюкуроновой кислотой. с помощью билирубина 51 Сг установлено, что в происхождении желтухи при синдроме Жильбера определенное значение имеет укорочение жизни эритроцитов. время даже тяжелые поражения паренхимы печени при остром вирусном гепатите или хронических заболеваниях печени (хронический гепатит, цирроз печени) не приводят к нарушению глюкуронидазнои функции печени, что свидетельствует об очень высоком ее резерв, а снижение активности глюкуронилтрансферазы в ткани печени, сравниваемое с тем, что наблюдается при синдроме Жильбера, видзначает?? Ся при гепатоцеребральной дистрофии, а также в некоторых случаях терминальной печеночной недостаточности. Это позволяет отрицать этиологической роли вирусного гепатита в развитии синдрома Жильбера, отводя ему значение фактора, который только обнаруживает генетически обусловленную недостаточность глюкуронилтрансферазы. В случае синдрома повышенный гемолиз имеет по сравнению с другими нарушениями обмена билирубина второстепенное значение, а при гемолитической желтухе ускоренная гибель эритроцитов и повышенное образование пигмента являются ведущими патогенными звеньями. Гемолитический процесс при синдроме Жильбера носит приобретенный характер, это вторичное явление, хорошо известное при различных заболеваниях печени, протекающих с желтухой. В некоторых случаях периодически нарушается экскреция билирубина через мембраны гепатоцитов в желчные канальцы, это приводит к повышению в крови уровня и прямого билирубина. Но этот механизм при синдроме Жильбера повреждается редко, преимущественно в случае очень длительного течения. БИЛЕТ 17 1. Патология перикарда, формы, этиология, патогенез. ПЕРИКАРДИТ — воспалительное заболевание околосердечной сумки и наружной оболочки сердца, являющееся чаще всего местным проявлением какого-либо общего заболевания (туберкулез, ревматизм, диффузные забо левания соединительной ткани) или сопутствующее заболевание миокардаи эндокарда. Классификация. В настоящее время различные формы патологического процесса в перикарде подразделяют на основе клинико-морфологических признаков [Гогин Е.Е., 1979]. I. Перикардиты. А. Острые формы: 1) сухой или фибринозный; 2) выпотной или экссудативный (серозно-фибринозный и геморрагический), проте кающий с тампонадой сердца или без тампонады; 3) гнойный и гнилостный. Б. Хронические формы: 1) выпотной; 2) экссудативно-адгезивный; 3) адгезивный («бессимптомный», с функциональными нарушения ми сердечной деятельности, с отложением извести, с экстраперикардиальными сращениями, констриктивный). II. Накопление в полости перикарда содержимого невоспалительно го происхождения (гидро-, гемо-, пневмо- и хилоперикард). III. Новообразования: солитарные, диссеминированные, осложнен ные перикардитом. IV. Кисты (постоянного объема, увеличивающиеся). 02. Этиология Причины, ведущие к развитию болезни, разнообразны:
Из представленной классификации следует, что: 1) Перикардит может быть самостоятельным заболеванием с определен ной клинической картиной; 2) Перикардит может быть частью другого заболевания, и клиническая картина будет складываться из признаков, присущих этому заболеванию (например, ревматоидному артриту или СКВ), и симптомов самого пери кардита; Выраженность симптомов перикардита может варьировать: так, в клинической картине могут доминировать симптомы перикардита или пе рикардит будет не более как одним из прочих синдромов болезни, ни в коем мере не определяющих прогноз и особенности лечебной тактики. 03. Патогенез Механизмы развития болезни неоднородны и обусловлива ются следующими факторами: 1) непосредственным токсическим воздействием на перикард, напри мер, при метаболическом или лучевом поражении; 2) гематогенным или лимфогенным распространением инфекции; 3) непосредственным воздействием патологического процесса на перикард (например, прорастание опухоли легкого или средостения, распространение гнойного процесса с плевры или прорыв в полость перикарда абсцесса легкого, влияние субэпикардиального некроза миокарда на перикард при остром инфаркте миокарда); 4) аллергическим механизмом (по типу аутоагрессии — «антительный» иммунокомплексный механизм повреждения перикарда, Таким образом, существуют два основных пути повреждения перикар да — непосредственное воздействие патогенного агента и развитие воспа ления на иммунной основе. 2. Недостаточность пищеварения: определение понятия, механизмы развития и последствия обеспечивает достаточного усвоения поступающей в организм пищи. Как следствие недостаточности пищеварения развиваются:
Может развиваться при нарушении работы всего пищеварительного тракта или даже его отделов К нарушению пищеварения могут привести: ; погрешности в питании (прием чрезмерно горячей пищи, сухоеде-ние и т.д.); Возбудители некоторых инфекций – сальмонеллеза, колибактериоза, кормовые токсикоинфекции и т.д. Попадание в ЖКТ ядов, солей тяжелых металлов, ядов растительного происхождения и т.д. ; врожденные аномалии пищеварительного тракта; ; послеоперационные состояния; ; ионизирующая радиация (особенно чувствительны дети); ; отравление солями тяжелых металлов или ядами растительного происхождения; ; злоупотребление алкоголем и табакокурение; ; инфекционные заболевания (дизентерия, брюшной тиф и др.); ; психоэмоциональные факторы; ; опухоли. Недостаточность пищеварения может развиваться при нарушении работы всего пищеварительного тракта или его отделов. Вследствие нарушения всасывания развивается недостаточность пищеварения. ПАТОГЕНЕЗ КЛИНИЧЕСКИХ ПРОЯВЛЕНИЙ НЕДОСТАТОЧНОСТИ ПИЩЕВАРЕНИЯ
3. Почечная гипертензия, виды, особенности механизмов развития Почечная гипертензия – артериальная гипертензия, патогенетически связанная с патологией почек. Почечная гипертензия относится к вторичным (симптоматическим) гипертензиям, встречается в 5 -10% всех случаев артериальной гипертензии. Характерными признаками заболевания помимо повышения артериального давления (выше 140/90 мм рт.ст.) является стойкое повышение диастолического давления, молодой возраст больных, высокая частота злокачественного течения гипертензии, низкая эффективность медикаментозного лечения. Классификация На практике часто используется классификация, согласно которой все почечные гипертензии разделяются на три большие группы. Ренопаренхиматозные гипертензии – возникают вследствие одностороннего или двустороннего диффузного поражения паренхимы (тканей) почек, в том числе при:
Помимо этого, паренхиматозная почечная гипертензия может возникнуть вследствие воспалительных стриктур мочеточников или уретры, при мочекаменной болезни, при механическом сдавлении мочевыводящих путей (опухоли, кисты, спайки). Реноваскулярные гипертензии – возникают вследствие поражения одной или обеих почечных артерий. Частота выявления данной патологии составляет 1% всех больных артериальной гипертензией. Возникает при:
Смешанные почечные гипертензии– возникают при сочетанном поражении ткани и сосудов почек (при нефроптозе, опухолях и кистах почек, врожденных аномалиях почек и их сосудов). Как и почему развивается почечная гипертензия Механизм развития почечной гипертензии связывают с тремя основными моментами:
Пусковым моментом для развития почечной гипертензии является уменьшение почечного кровотока и клубочковой фильтрации, как вследствие диффузных изменений паренхимы, так и при поражении сосудов почек. В ответ на снижение почечного кровотока в почках увеличивается реабсорбция натрия (а вслед за ним и воды). Задержка натрия и воды приводит к увеличению объема внеклеточной жидкости и компенсаторной гиперволемии, что в свою очередь сопровождается повышением концентрации натрия в стенке сосудов. Избыток натрия вызывает набухание сосудистой стенки и повышение ее чувствительности к ангиотензину и катехоламинам (альдостерону). Активация РААС также является одним из значимых звеньев развития почечной гипертензии. Ренин – протеолитический фермент, выделяемый почками. Сам по себе ренин не оказывает прессорного действия, однако, соединяясь с а2-глобулином сыворотки крови, он превращается в высокоактивное вещество – ангиотензин-ll. Ангиотензин-llобладает способностью прямо повышать уровень артериального давления, а также усиливает выделение надпочечниками гормона альдостерона, который стимулирует реабсорбцию ионов натрия в почках. Одновременно с описанными выше механизмами компенсаторные возможности почек, направленные на понижение артериального давления (путем активации выделения простагландинов и ККС) постепенно истощаются. Таким образом, возникает порочный круг, в результате которого развивается стойкое повышение артериального давления. БИЛЕТ 18 1. Основные теории патогенеза экстрасистолий. Экстрасистолия - внеочередное сокращение сердца. Зкстрасистолы, исходящие из синусового узла, называются номотопными. Однако и в этом случае источником экстрасистолы являются не клетки водителя ритма (пейсмекера), а расположенные в его окружении клетки, обладающие латентным автоматизмом, но не проявляющие пейсмекерной активности в нормальных условиях. Пейсмекерной активностью называют способность клеток к спонтанной деполяризации. Обычно пейсмекерная активность атриовентрикулярного узла, ножек пучка Гиса и волокон Пуркинье подавляется импульсами, исключая синусовый узел. Эктопические экстрасистолы имеют источник внеочередного возбуждения, локализующийся в миокарде за пределами проводящей системы сердца. Аналогичная ситуация часто складывается в очаге ишемии при инфаркте миокарда. В зависимости от локализации эктопического очага различают предсердные, атриовентрикулярные, левожелудочковые, правожелудочковые и перегородковые экстрасистолы. Одиночные экстрасистолы не вызывают серьезных расстройств гемодинамики и клинически проявляются ощущением «перебоев» в работе сердца. Однако множественные и особенно политопные экстрасистолы, т.е. исходящие из нескольких эктопических центров, могут вызвать серьезные нарушения гемодинамики по двум причинам. Во-первых, многие экстрасистолы гемодинамически малоэффективны, поскольку процесс внеочередного сокращения может возникнуть в период, когда сердце еще не успело полностью расслабиться и, следовательно, конечный диастолический объем желудочков в этот момент остается сниженным, так же как и ударный объем. Во-вторых, после экстрасистолы следует компенсаторная пауза, т.е. удлиненная диастола, в период которой миокард находится в состоянии рефрактерности и не чувствителен к импульсу, поступающему из синусового узла. Наиболее выраженные нарушения гемодинамики наблюдаются при желудочковых экстрасистолах. Желудочковые экстрасистолы - преждевременные желудочковые сокращения, обусловленные наличием очага автоматизма в желудочках. Этиологические факторы желудочковых экстрасистолий: ИБС и ее осложнения (в частности, острый инфаркт миокарда), кардиомиопатии, нарушения электролитного и кислотно-щелочного баланса, гипоксия, эндокринные заболевания (тиреотоксикоз), инфекции, прием некоторых лекарств (сердечные гликозиды и антиаритмические средства). Желудочковые экстрасистолы могут регистрироваться и у практически здоровых людей. Так, например, по данным суточного мониторирования ЭКГ, желудочковые экстрасистолы отмечаются в 70-80% случаев у лиц в возрасте старше 60 лет, причем наиболее часто обнаруживаются бессимптомные желудочковые экстрасистолы. Электрокардиографически желудочковые экстрасистолы характеризуются (см. рис. 15-13) появлением преждевременных комплексов QRS, отличающихся от нормальных комплексов шириной более 0,12 с, деформацией, наличием предшествующего укороченного интервала R-R (рис. 15-14). Зубец Т, как правило, увеличен и так же, как сегмент S-T, расположен дискордантно, т.е. направлен в другую сторону по отношению к самому высокоамплитудному зубцу комплекса QRS. Экстрасистолическому комплексу QRS не предшествует зубец Р. Клинически желудочковые экстрасистолы проявляются как ощущение сердцебиения или дискомфорт в груди, ощущение перебоев в работе сердца (в связи с наличием компенсаторных пауз после желудочковых экстрасистол). Среди желудочковых экстрасистол наиболее часто встречаются единичные, реже множественные, парные, политопные (возникающие из разных отделов миокарда) экстрасистолы, бигеминия (состояние, когда каждой нормальной систоле сопутствуют желудочковые экстрасистолы). Появление парных желудочковых экстрасистол увеличивает риск смерти. Особую опасность представляют ранние желудочковые экстрасистолы, при которых эктопический импульс приходится на так называемую ранимую фазу сердечного цикла. Ранимая фаза сердечного цикла - это интервал времени, когда процесс реполяризации еще полностью не завершился, сердце находится в состоянии относительной рефрактерности и любой экстрастимул, в том числе эктопический импульс, имеющий желудочковую локализацию, может вызвать появление не только желудочковой экстрасистолы, но и желудочковой фибрилляции, которая может закончиться гибелью пациента. Электрокардиографически ранимая фаза почти полностью соответствует зубцу Т, поэтому подобные экстрасистолы называют «экстрасистола R на T» (R на Т). Появление ранних желудочковых экстрасистол является негативным прогностическим признаком, поскольку часто предшествует внезапной сердечной смерти. 2. Основные виды нарушений аппетита, патогенез, последствия. Аппетит - это желание приема пищи. В отличие от голода, который возникает при истощении запаса пищевых веществ в организме ниже определенного уровня, аппетит может сохраняться даже после удовлетворения голода. На аппетит влияют эмоции, наличие или отсутствие привлекающих, либо отвлекающих стимулов. Сытость означает отсутствие желания есть. Основываясь на данных Кэннона, выявившего связь между чувством голода и появлением сильных ритмических сокращений желудка, Карлсон предположил, что органом, посылающим в ЦНС необходимую информацию о голоде или сытости, является желудок. Карлсон предвосхитил широко распространенную в настоящее время точку зрения о том, что к голоду и сытости непосредственное отношение имеет концентрация глюкозы в крови. Несмотря на привлекательность этой точки зрения есть факты, противоречащие ей. На основании многочисленных экспериментальных работ была предложена рабочая гипотеза о роли отдельных областей гипоталамуса в регуляции потребления пищи. Вентромедиальные ядра служат передаточным (релейным) пунктом, объединяющим поток информации о насыщении. Разрушение этой области мешает восприятию сигналов насыщения, что ведет к гиперфагии (т.е. перееданию) и в конечном счете к ожирению. В латеральной области гипоталамуса находится "облегчающий пищевой центр", который функционирует как интегрирующее звено всех сложных зрительных, слуховых, обонятельных, тактильных и прочих рефлексов, связанных с пищевым поведением. Согласно "классической" теории, информация о насыщении поступает в вентромедиальную часть регуляторного механизма, а из вентромедиальных ядер исходят сигналы, тормозящие латеральные пищевые центры. Тем не менее, предполагают, что экстрагипоталамические механизмы в большей мере определяют пищевое поведение, чем гипоталамические. Например, общее истощение организма при опухолевых процессах, развивается независимо от гипоталамических механизмов. Сформулирована гипотеза установочной точки, или аппестата - баростата, на основе липостатической теории регуляции потребления пищи. Согласно этой теории, регуляция количества потребляемой пищи связана с механизмом контроля запасов липидов в жировой ткани. Не ясно, регистрируют ли баростат постоянно меняющуюся физическую активность или же обусловленное этой активностью снижение запасов жира. На регулятор потребления пищи влияет физиологическое состояние голода, а также комплекс сенсорных сигналов, которые могут оказывать положительное действие, усиливая пищевое поведение, либо, напротив, подавлять соответствующие рефлексы. Следует отметить, что в регуляции процессов потребления пищи участвует и целый ряд нейромедиаторов : так, внутричерепное введение норадреналина активирует пищевой рефлекс у животных, но в то же время симпатомиметики группы анфетамина ингибируют потребление пищи (за что их называют аноректиками). Наиболее явными активаторами пищевого поведения считаются альфа-адреномиметики и опиоидные пептиды (типа бета-эндорфинов) . К ингибиторам же относятся - бета-адреномиметики, серотонин, холецистокинин, инсулин . и некоторые другие гормоны. Одним из весьма из распространенных нарушений аппетита является его отсутствие - анорексия. Чаще речь идет о так называемой нервной анорексии, которая встречается в основном у девочек пубертатного возраста и молодых женщин (очень редко у мальчиков). Это тяжелое состояние, которое, если его не прервать, может закончиться смертью. Обычно нервная анорексия . сопровождается потерей массы тела, аменореей, запором, брадикардией, снижением температуры тела, низким артериальным давлением. Сам термин "анорексия" в данном случае не совсем точен, ибо эти люди постоянно думают о еде, создают вокруг нее сложные фантастические ритуалы, ограничивая свою диету определенными продуктами. Большинство проявлений этого состояния связано с гипоталамусом. Анорексию как таковую могут вызывать избыток белка и несбалансированные смеси аминокислот. Механизм этого явления точно не известен, но его реализация не зависит от гипоталамуса. Анорексия часто возникает при заболеваниях печени (гепатит), но механизм этого феномена тоже неизвестен, авитаминозах, дегидратации, инфекционных заболеваниях. Повышение аппетита (гиперфагия, булимия) . - своеобразное болезненное состояние, сопровождающее сахарный диабет, некоторые болезни обмена веществ. В США, где стандарт голливудских кинозвезд принят достаточно широко, тучные люди пытаются бороться с булимией сознательно вызванной рвотой в комбинации с диуретиками и слабительными. Гиперфагию можно вызвать у животных систематическими инъекциями инсулина или глюкокортикоидами. Необходимо отметить, что повышенный аппетит без адекватной обратной связи заканчивается ожирением, со всеми негативными последствиями. Если с аппетитом все в порядке, то следующее звено в системе пищеварения, где возможны нарушения - полость рта, где происходит прежде всего механическая обработка пищи. Ее нарушения возможны при патологии зубочелюстного аппарата, нарушении актов жевания и глотания. Жевание является функцией рта, в которой участвуют все его отделы: губы, язык, зубы, челюстные суставы, слюнные железы, всевозможные рецепторы слизистой и жевательные мышцы. Нарушение этой функции возникает при повреждении или отсутствии зубов, патологии жевательной мускулатуры, поражении височно-нижнечелюстных суставов. Если опорное состояние зубов недостаточно против жевательной нагрузки, то говорят о травматической окклюзии и о нарушении артикуляционного равновесия. В этом случае нарушается равновесие между жевательной нагрузкой и сопротивлением ткани пародонта. Под влиянием жевательной нагрузки наступает гибель пародонта. В деснах в результате повышения давления наступает расстройство кровообращения, застой. Со временем в результате хронического воспаления соединительная ткань десен пролиферирует, десны набухают, возникает картина гиперпластического гингивита. Длительная и значительная перегрузка вызывает частичную гибель кости. В результате сжатия периодонта возникает кровотечение, тромбоз, воспаление, а затем некроз и гиалиновое перерождение. Все это влияет на развитие парадонтоза. Следует отметить, что в полости рта присутствует большое количество микроорганизмов, в том числе и патогенных. Их бурный рост на фоне ослабленного иммунитета может привести к оральному сепсису. Вместе с тем в полости рта есть и защитные факторы, например, лизоцим - фермент, содержащийся в слюне. Он способен разрушать мембраны микробных клеток. Кроме того, в полость рта ежеминутно мигрируют до 250 тысяч лейкоцитов, главным образом, нейтрофилов. Защитную роль играют иммуноглобулины слюны. Вот мы и подошли вплотную к патологии слюнных желез, которые выполняют секреторную и инкреторную функцию. Слюна смачивает пищу, формирует пищевой комок и ферментирует углеводы ( действие альфа-амилазы, которая в большом количестве выделяется околоушной железой). В слюне также содержатся альфа-глюкозидаза, протеазы (калликреин-саливаин), нуклеазы (РНК и ДНК-азы), фосфатазы, пероксидазы, карбоангидраза. Слюна гипотонична по отношению к крови. Омывая зубы и слизистую оболочку рта, слюна оказывает защитное и трофическое действие. Ферменты слюны могут вызывать как физиологические (регулируя микроциркуляцию в полости рта), так и патологические реакции (воспаление под действием кининов, а избыток нуклеаз приводит к развитию дистрофии). В норме выделяется 0.5-2 литра слюны. 3. Гломерулонефрит, понятие, основные виды. Гломерулонефрит. По современным представлениям - это генетически обусловлен ное иммуноопосредованное воспаление с преимущественным исход ным поражением клубочков и последующим вовлечением в патологи ческий процесс всех почечных структур. Установлена связь ГН с опре деленным фенотипом HLA-системы. ГН можно рассматривать как па тологический процесс, локализующийся в исходно дефектном органе и реализованный под действием различных (возможно, неспецифиче ских) раздражителей. Классификация ГН проводится по морфологиче скому принципу, правда, с иммунологическим критерием: 1. Иммунокомплексный ГН. 1. Мезенгиально-пролиферативный ГН, в который нужно вклю чить также острый ГН, Ig А -нефропатию (болезнь Берже). 1.1 Мезангиальные нефриты. 1.2 Мемранозный ГН. 1.3 Мембранозно-пролиферативный ГН. 2. ГН с антительным механизмом: 2.1 Экстракапиллярный ГН 2.2 Синдром Гуспасчера. В этиологии показано участие нефрогенных стрептококков, бело го стафилококка, бычьей коринебактерии, энтерококка, тифозной сальмонеллы, бледной трепонемы, диплококков. Выявляются и виру сы: цитомегаловирус, вирус герпеса, гепатита В, Эпштейн-Барр, пара зиты - малярийный плазмодий, шистосома, токсоплазмы. Показано также и участие медикаментов, ядов, чужеродной сыворотки, эндоген ных антигенов: ядерный, щеточной каймы, тиреоглобулин, иммуноглобулины, опухолевый и эмбриональный карциноматозный. В патогенезе установлен иммунный ответ, осуществляющийся путем межмолекулярных взаимодействий антигена и компонентов МНС (большого комплекса гистосовместимости). Комбинация антиге на и молекулы комплекса распознается рецептором Т-лимфоцита. Эти три элемента: антиген, комплекс-кодирующая молекула и рецептор Т-лимфоцита обеспечивают самостоятельную специфичность иммунного ответа. Далее проявляются пассивный занос ИК (иммунных комплек сов) в клубочек и их осаждение, циркуляция антител, реагирующих со структурным антигеном или с «пусковым» негломерулярным аутологичным или экзогенным антигеном. Эта реакция индуцирует образова ние иммунных депозитов в ткани почек. Возможен вариант реакции с фиксированным антигеном самой базальной мембраны, так называе мый анти-ГБМ-антительний ГН. Возникновение клубочковых и тубуло-интерстициальных повреждений обусловлено либо участием Т-клеток - киллеров, либо макрофагальной реакцией, либо другими ме ханизмами. На генетическую предрасположенность накладывается воздействие ан тигена, а сам антиген может быть эндо - или экзогенным. Далее формируется обычная иммунная реакция с образованием ПК, запус кающего нарушения микроциркуляции с развитием микротромбозов и микронекрозов, - т.е. формируется неспецифическое воспаление. Под влиянием хемотаксических факторов полиморфноядерные лейкоциты концентрируются в клубочке, более того, отслаивая эндотелий, опсо-нируя и фагоцитируя ИК, они освобождают из фосфолипидов клеточ ных мембран простагландины, лейкотриены, гистамин, катионные бел ки, факторы коагуляции, ферменты. Все это приводит к повреждению клубочков, деполимеризации гликопротеинов ГБМ, увеличению ее проницаемости и способствуют ее повреждению. Проблема хронического гломерулонефрита (ХГН) занимает центральное место в нефрологии. Примерно у трети нефрологических больных диагностируется ХГН, который и является частой причиной развития почечной недостаточно сти. Острый гломерулонефрит (ОГН) - его главный виновник - стрептококк группы А. Доказа тельства причастности стрептококка к ОГН - наличие нефритогенного антигена как специфического компонента стрептококка и стимуляция стрептококковой инфекцией аутоантигенной реактивности организма. По патогенезу ОГН - классический образец иммунокомплексного вос паления. У 90% больных повышается уровень IgG и IgМ, у 93% -гипокомплементемия, у 60% криоглобулины, содержащие антитела к некоторым формам аутологичного IgG и циркулирующие ИК, содер жание последних коррелирует с тяжестью заболевания и наличием ви димых депозитов в ткани не только почки, но и селезенки. БИЛЕТ 19 1. Механизмы долговременной адаптации при перегрузках сердца. Интракардиальные механизмы компенсации функции сердца. К ним относятся компенсаторная гиперфункция и гипертрофия сердца. Эти механизмы являются неотъемлемыми компонентами большинства приспособительных реакций сердечно-сосудистой системы здорового организма, но в условиях патологии могут превратиться в звено патогенеза хронической сердечной недостаточности. Компенсаторная гиперфункция сердца выступает как важный фактор компенсации при пороках сердца, артериальной гипертензии, анемии, гипертонии малого круга и других заболеваниях. В отличие от физиологической гиперфункции она является длительной и, что существенно, непрерывной. Несмотря на непрерывность, компенсаторная гиперфункция сердца может сохраняться в течение многих лет без явных признаков декомпенсации насосной функции сердца. Увеличение внешней работы сердца, связанное с подъемом давления в аорте (гомеометрическая гиперфункция), приводит к более выраженному возрастанию потребности миокарда в кислороде, чем перегрузка миокарда, вызванная повышением объема циркулирующей крови (гетерометрическая гиперфункция). Иными словами, для осуществления работы в условиях нагрузки давлением мышца сердца использует гораздо больше энергии, чем для выполнения той же работы, связанной с нагрузкой объемом, а следовательно, при стойкой артериальной гипертензии гипертрофия сердца развивается быстрее, чем при увеличении объема циркулирующей крови. Например, при физической работе, высотной гипоксии, всех видах клапанной недостаточности, артериовенозных фистулах, анемии гиперфункция миокарда обеспечивается за счет увеличения минутного объема сердца. При этом систолическое напряжение миокарда и давление в желудочках возрастают незначительно, и гипертрофия развивается медленно. В то же время при гипертонической болезни, гипертензии малого круга, стено- зах клапанных отверстий развитие гиперфункции связано с повышением напряжения миокарда при незначительно измененной амплитуде сокращений. В этом случае гипертрофия прогрессирует достаточно быстро. 2. Причины и механизмы развития нарушений альвеолярной вентиляции. АЛЬВЕОЛЯРНАЯ ГИПОВЕНТИЛЯЦИЯ Гиповентиляция альвеол воздухом (альвеолярная гиповентиляция) — типовая форма нарушения внешнего дыхания, при которой реальный объём вентиляции альвеол за единицу времени ниже необходимого организму в данных условиях. • Причины. † Расстройства биомеханики внешнего дыхания. Среди расстройств биомеханики внешнего дыхания различают расстройства обструктивные и рестриктивные. ‡ Обструктивный тип альвеолярной гиповентиляции. Обструктивный тип альвеолярной гиповентиляции заключается в снижении проходимости дыхательных путей. В связи с этим повышается сопротивление движению воздушного потока, снижается объём вентиляции соответствующих областей лёгких, возрастает работа дыхательных мышц, увеличивается энергообеспечение (энергорасход) аппарата внешнего дыхания. Даже сравнительно небольшая обструкция бронхов может существенно повысить их сопротивление воздушному потоку и увеличить работу дыхательных мышц (например, уменьшение диаметра бронха на 1/3 способно привести к увеличению сопротивления движению воздуха на 300–500%). |