Патфиз ч.3. Патфиз ч. Частнаяпатология
 Скачать 13.12 Mb. Скачать 13.12 Mb.
|
|
Эндокринная система — совокупность анатомически, гистологически и цитологически дифференцированных структур, вырабатывающих гормоны. Определённые эндокринные клетки системы синтезируют и выделяют в жидкие среды организма (кровь, лимфу, межклеточную жидкость, ликвор и другие) молекулы конкретного гормона. ЭНДОКРИННЫЕ ЖЕЛЕЗЫ В большинстве случаев гормоны синтезируются в анатомически автономных структурах — эндокринных железах, или железах внутренней секреции. К ним относятся гипофиз, эпифиз (шишковидная железа), щитовидная железа, околощитовидные железы, надпочечники (рис. 27–1). 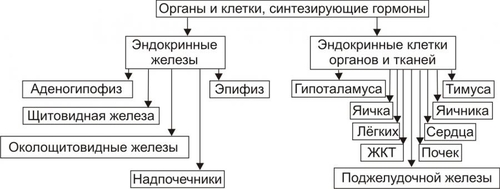 Рис. 27–1. Органы и клетки, синтезирующие гормоны. ЭНДОКРИННЫЕ КЛЕТКИ ОРГАНОВ И ТКАНЕЙ Ряд гормонов продуцируется совокупностью клеток или отдельными клетками, не организованными анатомически в виде железы. Эти клетки находятся в различных тканях и органах (рис. 27–1). К ним относятся нейросекреторные клетки гипоталамуса, эндокринные клетки островков Лангерханса поджелудочной железы ( ГОРМОН Термин «гормон» применяют для обозначения секретируемого клетками во внутреннюю среду организма БАВ, связывающегося с рецепторами клеток–мишеней и изменяющего режим их функционирования. Таким образом, гормоны выступают в роли регуляторов активности клеток. • К гормонам относятся продуцируемые эндокринными клетками БАВ. • В широком смысле гормонами являются и некоторые другие БАВ: вырабатываемые иммунной системой, факторы роста, цитокины. • Химическая структура БАВ различна. Основные их классы: олигопептиды (например, нейропептиды), полипептиды (например, инсулин), гликопротеины (например, ТТГ), стероиды (например, альдостерон и кортизол), производные тирозина (например, йодсодержащие гормоны щитовидной железы: трийодтиронин — Т3 и тироксин — T4), производные ретиноевой кислоты, эйкозаноиды (например, Пг и простациклины). РЕЦЕПТОРЫ ГОРМОНОВ И ВТОРЫЕ ПОСРЕДНИКИ Рецептор гормона — белковая молекула, расположенная на поверхности цитолеммы, в цитоплазме или в ядре, которая специфически взаимодействует с определённым гормоном и передает сигнал вторым посредникам. Подробнее о рецепторах и гормонах см. раздел «Межклеточные информационные сигналы» в главе 4 «Патология клетки», а также в приложении «Справочник терминов». ВАРИАНТЫ ВОЗДЕЙСТВИЯ ГОРМОНОВ НА КЛЕТКИ–МИШЕНИ По расстоянию от клетки–продуцента гормона до клетки–мишени различают эндокринный, паракринный и аутокринный варианты регуляции. • Эндокринная, или дистантная регуляция. Секреция гормона происходит во внутреннюю среду. Клетки–мишени могут отстоять от эндокринной клетки сколь угодно далеко. Пример: секреторные клетки эндокринных желёз, гормоны из которых поступают в систему общего кровотока. • Паракринная регуляция. Продуцент биологически активного вещества и клетка–мишень расположены рядом. Молекулы гормона достигают мишени путём диффузии в межклеточном веществе. Например, в париетальных клетках желёз желудка секрецию H+ стимулируют гастрин и гистамин, а подавляют соматостатин и Пг, секретируемые рядом расположенными клетками. • Аутокринная регуляция. При аутокринной регуляции клетка–продуцент гормона имеет рецепторы к этому же гормону (другими словами, клетка–продуцент гормона в то же время является его мишенью). Примеры: эндотелины, вырабатываемые клетками эндотелия и воздействующие на эти же эндотелиальные клетки; Тлимфоциты, секретирующие интерлейкины, имеющие мишенями разные клетки, в том числе и Тлимфоциты. МЕХАНИЗМЫ НЕЙРОЭНДОКРИННОЙ РЕГУЛЯЦИИ Функция эндокринной системы, как правило, тесно связана с нервной деятельностью. В связи с этим сложилось представление о нейроэндокринной регуляции. В общем виде речь идёт о сочетанной деятельности корковых и подкорковых структур, эндокринных клеток и их мишеней, осуществляющей регуляцию конкретных функций организма. В результате формируются саморегулирующиеся контуры. РЕГУЛЯТОРНЫЕ КОНТУРЫ Типичный пример регуляторного контура — половая функция женского организма. В этом иерархическом контуре можно выделить следующие звенья, или уровни: нейроны коры большого мозга, подкорковые структуры, нейроэндокринные клетки гипоталамуса, эндокриноциты передней доли гипофиза, эндокринные клетки половых органов и клетки–мишени половых гормонов. • Сигналы каждого звена (уровня) оказывают регуляторное воздействие на следующее звено контура в направлении «сверху вниз». • Каждое звено контура направляет гуморальные или нервные сигналы к вышерасположенным уровням (чаще — по принципу отрицательной обратной связи — подавляя активность этих уровней). • Кроме того, в структурах мозга формируются относительно автономные генераторы ритма. Примером функционирования такого саморегулирующегося нейроэндокринного контура является регуляция овариально-менструального цикла. ОВАРИАЛЬНО-МЕНСТРУАЛЬНЫЙ ЦИКЛ Овариально-менструальный цикл контролируют гипофизарные гонадотропины — фолликулостимулирующий (ФСГ, фоллитропин) и лютеинизирующий (ЛГ, лютропин). Эту эндокринную функцию передней доли гипофиза регулирует гипоталамический гонадолиберин — люлиберин. В свою очередь гормоны яичника (эстрогены, прогестерон, а также ингибин) вовлечены в регуляцию синтеза и секреции гонадотропинов гипофиза и люлиберина гипоталамуса. Таким образом, циклические изменения яичника и эндометрия — иерархическая (гипоталамус • Гонадолиберин. Секреция гонадолиберина имеет пульсирующий характер: пики усиленной секреции гормона продолжительностью несколько минут сменяются 1–3часовыми интервалами относительно низкой секреторной активности. Частоту и амплитуду секреции гонадолиберина регулирует уровень эстрогенов и прогестерона. • Фолликулярная стадия цикла. Резкое падение содержания эстрогенов и прогестерона в конце каждого цикла (вследствие инволюции менструального жёлтого тела) стимулирует нейросекреторные клетки гипоталамуса к выделению гонадолиберина с пиками усиленной секреции гормона продолжительностью несколько минут с интервалом в 1 час. В первую очередь гормон секретируется из пула, запасённого в гранулах, а затем — тотчас по окончании синтеза. Такой режим секреции гонадолиберина активирует гонадотрофные клетки аденогипофиза. • Лютеиновая стадия цикла. Жёлтое тело активно продуцирует половые гормоны. На фоне высокого содержания эстрогенов и прогестерона интервал между пиками усиленной секреции гонадолиберина увеличивается до 2–3 часов, что недостаточно для стимуляции секреции гонадотропных гормонов. • Фоллитропин † Секреция. В фолликулярную стадию (в начале цикла) на фоне пониженного содержания в крови эстрогенов и прогестерона гонадолиберин стимулирует секреторную активность клеток, синтезирующих ФСГ. Эстрогены (с пиком за сутки до овуляции) и ингибин подавляют продукцию ФСГ. † Мишени фоллитропина — фолликулярные клетки. ФСГ (действуя вместе с эстрадиолом) увеличивает плотность рецепторов фоллитропина в мембране клеток гранулёзы, тем самым усиливая своё действие на мишень. † Функция. ФСГ стимулирует пролиферацию фолликулярных клеток и рост фолликула. Активирует в клетках ароматазу и усиливает секрецию эстрогенов. Инициирует встраивание рецепторов ЛГ в мембране фолликулярных клеток и секрецию ингибина в конце фолликулярной стадии. • Лютропин † Секреция. В конце фолликулярной стадии на фоне высокой концентрации эстрогенов блокируется продукция ФСГ и одновременно стимулируется секреция лютропина. Пик лютропина наблюдается за 12 часов до овуляции. Сигналом для снижения уровня ЛГ является начало секреции клетками гранулёзы прогестерона. † Мишени. Рецепторы ЛГ имеют клетки theca фолликулов и клетки гранулёзы. После активации фоллитропином в клетках появляются рецепторы лютропина. † Функция. Лютеинизация фолликулярных клеток и клеток внутренней теки. Стимуляция синтеза андрогенов в клетках theca. Индукция секреции прогестерона клетками гранулёзы. Активация протеолитических ферментов гранулёзы. На пике ЛГ завершается первое деление мейоза. • Эстрогены и прогестерон † Секреция эстрогенов клетками гранулёзы постепенно нарастает в фолликулярную стадию и достигает пика за сутки до овуляции. Продукция прогестерона начинается в клетках гранулёзы до овуляции; основной источник прогестерона — жёлтое тело. В лютеиновую стадию овариального цикла синтез эстрогенов и прогестерона значительно усиливается. † Мишени. К половым гормонам чувствительны нейросекреторные клетки гипоталамуса, гонадотрофные клетки, фолликулярные клетки яичника, клетки слизистых оболочек матки, яйцевода, влагалища, альвеолярные клетки молочных желёз. † Функции. Одновременное повышение содержания в крови прогестерона и эстрогенов увеличивает интервал между фазами усиленной секреции гонадолиберина до 2—3 часов, что блокирует продукцию гонадотропных гормонов, а следовательно, рост и созревание очередного фолликула. При резком снижении содержания в крови половых гормонов пики секреции гонадолиберина разделены одночасовым интервалом. На этом фоне в аденогипофизе активируется секреция ФСГ (начинается фолликулярная стадия цикла). Эстрогены контролируют пролиферативную фазу менструального цикла (восстановление функционального слоя эндометрия), а прогестерон — секреторную фазу (подготовку эндометрия к имплантации). Снижение содержания в крови эстрогенов и прогестерона сопровождается отторжением функционального слоя эндометрия и маточным кровотечением (менструальная фаза). Эстрогены и прогестерон в сочетании с пролактином, хорионическим соматомаммотропином у беременной стимулируют дифференцировку секреторных клеток молочной железы. ОБЩАЯ ЭТИОЛОГИЯ И ОБЩИЙ ПАТОГЕНЕЗ ЭНДОКРИННЫХ РАССТРОЙСТВ Различают центрогенный, первично железистый и постжелезистый варианты инициальных звеньев патогенеза эндокринных расстройств. • Центрогенные инициальное звено. Обусловлено нарушением механизмов нейрогуморальной регуляции желёз внутренней секреции со стороны нейронов коры большого мозга и/или гипоталамогипофизарной системы. Как правило, являются следствием расстройств функций коры головного мозга, гипоталамуса, аденогипофиза, нейрогипофиза. Причины. † На уровне коры большого мозга. ‡ Дефекты развития и органические повреждения головного мозга (чаще в результате кровоизлияния, роста опухолей, образования гранулём, травм). ‡ Действие токсинов и инфекционных агентов (например, этанола, наркотиков, микробных эндо и экзотоксинов). ‡ Нарушения ВНД (как правило, невротические состояния, затянувшиеся стрессреакции, психозы). † На уровне гипоталамуса и гипофиза. ‡ Генные дефекты (мутации генов либеринов, статинов, адено- и нейрогипофизарных гормонов, а также ферментов синтеза этих БАВ ). ‡ Прямое повреждение (например, при росте и/или распаде опухоли, кровоизлияниях, сотрясении, сдавлении). ‡ Воздействие токсичных веществ экзо и/или эндогенного происхождения инфекционной либо неинфекционной природы (например, этанола, столбнячного токсина, нейротропных ЛС). Расстройства функций коры головного мозга и гипоталамогипофизарной системы приводят к нарушениям образования нейрогормонов гипоталамуса (либеринов, статинов, АДГ), а также тропных гормонов аденогипофиза. Последнее в свою очередь вызывает расстройства функций желёз и клеток внутренней секреции, регулируемых тропными гормонами аденогипофиза. • Первично железистые расстройства. Вызваны расстройствами синтеза и/или инкреции гормонов эндокринными железами и отдельными эндокринными клеткам (рис. 27–2). 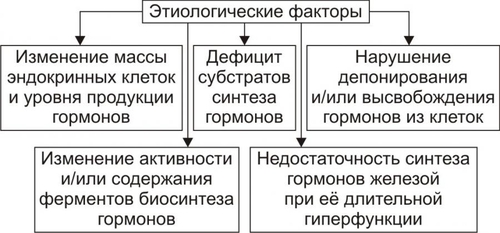 Рис. 27–2. Типовые механизмы эндокринопатий: первично железистые расстройства. • Постжелезистые эндокринопатии. Обусловлены различными нарушениями транспорта гормона, его рецепции и пострецепторными событиями в клетке–мишени. Наиболее клинически значимые варианты постжелезистых эндокринопатий приведены на рис. 27–3. 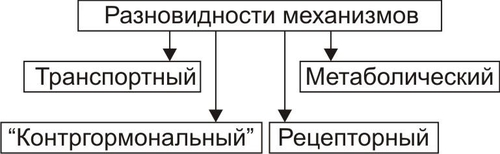 Рис. 27–3. Типовые механизмы эндокринопатий: постжелезистые расстройства. † Транспортный. Заключается в чрезмерном снижении или повышении связывания гормонов с их транспортными белками. В результате уменьшается или возрастает уровень свободного, активного гормона (например, инсулина, кортизола, йодсодержащих гормонов щитовидной железы). † «Контргормональный». Этот механизм включает несколько вариантов, приводящих к снижению или устранению эффектов гормонов. ‡ Транспортные белки. Не связанные с ними гормоны быстро инактивируются в крови. ‡ АТ. Найдены, например, по отношению к инсулину, АКТГ, СТГ. ‡ Ферменты. Увеличение активности инсулиназы, глутатионредуктазы или глутатионтрансферазы приводит к разрушению инсулина; а моноаминооксидазы и/или катехолометилрансферазы — адреналина. ‡ Изменение конформации молекул гормонов. Наблюдается в условиях выраженного ацидоза в клетках и интерстициальной жидкости или взаимодействия с гормонами токсинов, солей тяжёлых металлов, свободных радикалов. ‡ Гормоны–антагонисты. Избыток в крови катехоламинов, кортизола, глюкагона, СТГ, тиреоидных гормонов противодействует реализации эффектов инсулина. † Рецепторный (реактивный). Связан с нарушением взаимодействия гормона с его рецептором. Выделяют несколько разновидностей этого механизма. ‡ Изменение числа рецепторов гормона (их увеличение или уменьшение), а также отклонение от нормального соотношения высоко и низкоаффинных рецепторов. ‡ Образование противорецепторных АТ (например, к рецепторам инсулина или ТТГ). ‡ Блокада рецепторов негормональными лигандами, имеющими структуры, сходные с фрагментом молекулы гормона. Описано в отношении, например, рецепторов инсулина, инсулиноподобных факторов роста, тиреоидных гормонов. ‡ Перекрестный эффект гормона. (например, СТГ может активировать рецепторы пролактина, в результате развивается галакторея). † Метаболический. Этот механизм заключается в нарушениях метаболизма гормонов. Например, ‡ расстройства деградации в гепатоцитах инсулина и стероидных гормонов (при этом торможение катаболизма глюкокортикоидов приводит к подавлению синтеза АКТГ); ‡ чрезмерное дейодирование тироксина. § Дейодирование наружного кольца тироксина, частично происходящее в щитовидной железе, осуществляется преимущественно в печени и приводит к образованию гормонально более активного Т3. § Дейодирование внутреннего кольца тироксина происходит в щитовидной железе, преимущественно в печени и частично в почке, в результате образуется реверсивный (обратный) Т3 (3,3',5'-трийодтиронин, rT3 (от англ. reverse]), имеющего незначительную физиологическую активность. Таким образом, в основе большинства эндокринопатий находится дефицит конкретного гормона. Это определяет один из основных принципов лечения таких заболеваний — заместительную терапию. НАРУШЕНИЯ ФУНКЦИЙ ГИПОТАЛАМО-ГИПОФИЗАРНОЙ СИСТЕМЫ В состав гипоталамо-гипофизарной системы входят: • передняя доля гипофиза (имеет эпителиальное происхождение, вместе с туберальной и промежуточной долями образует аденогипофиз, осуществляет синтез тропных гормонов и экспрессию гена проопиомеланокортина); • перикарионы нейросекреторных нейронов гипоталамуса (синтез рилизинг-гормонов, антидиуретического гормона — АДГ, окситоцина, нейрофизинов, орексинов); • гипоталамо-гипофизарный тракт (транспорт гормонов по аксонам нейросекреторных нейронов); • аксо-вазальные синапсы (секреция АДГ и окситоцина в капилляры задней доли гипофиза, секреция рилизинг-гормонов в капилляры срединного возвышения); • портальная система кровотока между срединным возвышением и передней долей гипофиза. ТИПОВЫЕ ФОРМЫ ПАТОЛОГИИ АДЕНОГИПОФИЗА Критерии классификации типовых форм расстройств аденогипофиза представлены на рис. 27–4. 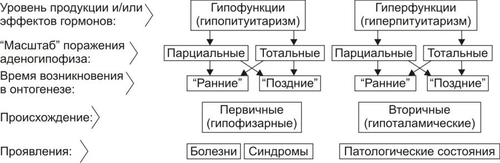 Рис. 27–4. Типовые формы гипофизарных эндокринопатий. • По уровню продукции гормона (определяют по его содержанию в жидкостях организма) и/или по выраженности его эффектов различают гипофункциональные состояния (гипопитуитаризм) и гиперфункциональные состояния (гиперпитуитаризм). • По «масштабу» поражения аденогипофиза и характеру расстройств в организме выделяют тотальный (нарушение продукции и/или эффектов действия всех гормонов аденогипофиза), парциальный (расстройство синтеза и/или эффектов одного гормона аденогипофиза) и субтотальный (расстройство синтеза и/или эффектов нескольких гормонов аденогипофиза) гипо- и гипопитуитаризм. • По времени возникновения эндокринопатии в онтогенезе: «ранние» (выявляются до завершения периода полового созревания) и «поздние» формы (развиваются после завершения периода полового созревания). • По происхождению эндокринопатий: первичные (гипофизарные, т.е. вызванные прямым повреждением аденогипофиза) и вторичные (гипоталамические — нейрогенные, центрогенные — обусловлены нарушением церебропитуитарного звена механизма нейроэндокринной регуляции). • По проявлениям (клиническим, биохимическим и др.). По этому критерию выделяют конкретные болезни, синдромы, патологические состояния (например, болезнь ИценкоКушинга, синдром гипофизарного ожирения, гиперпролактинемия, гипофизарная кахексия — болезнь Симмондса). ОТДЕЛЬНЫЕ ФОРМЫ ПАТОЛОГИИ АДЕНОГИПОФИЗА Практически любая нозологическая форма патологии аденогипофиза может быть расценена как гипер- или гипопитуитарная. ГИПОПИТУИТАРИЗМ Гипопитуитаризм — недостаточность содержания и/или эффектов одного либо более гормонов аденогипофиза. • Причины гипопитуитаризма Наиболее частые причины гипопитуитаризма приведены на рис. 27–5. 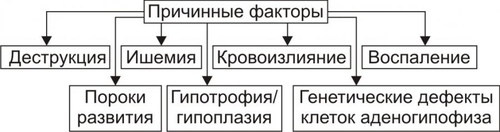 Рис. 27–5. Наиболее частые причины недостаточности аденогипофиза (гипопитуитаризма). † Разрушение аденогипофиза (полное или частичное) новообразованиями (злокачественными, доброкачественными, метастазами других опухолей) или множественными кистами, при хирургических вмешательствах (например, при удалении аденомы или кисты гипофиза), вследствие облучения аденогипофиза (например, при радиотерапии рядом расположенных опухолей или новообразований самого аденогипофиза), в результате реакций иммунной аутоагрессии (например, лимфоцитарный аутоагрессивный гипофизит). † Кровоизлияние в ткань гипофиза (например, у пациентов с артериальной гипертензией или в результате травмы). † Ишемия гипофиза, приводящая к его некрозу (является одной из наиболее частых причин гипопитуитаризма). † ВПР (аплазия гипофиза, энцефалоцеле основания мозга). † Генетические дефекты. Приводят к нарушению образования СТГ или (чаще) также и гонадотропных гормонов и ТТГ. † Воспалительные процессы (например, при туберкулёзе или сифилисе). † Гипотрофия и/или гипоплазия аденогипофиза (синдром «пустого турецкого седла»). • Виды гипопитуитаризма Основные виды аденогипофизарной недостаточности представлены на рис. 27–6. 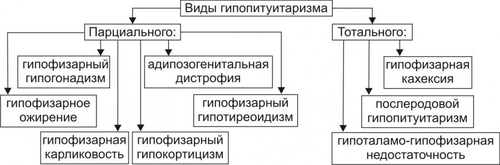 Рис. 27–6. Наиболее частые виды недостаточности аденогипофиза (гипопитуитаризма). † Парциальный гипопитуитаризм. «Чистых» парциальных форм аденогипофизарной недостаточности не встречается. Как правило, у каждого пациента лишь доминируют признаки недостаточности одного из гормонов аденогипофиза. ‡ Гипофизарная карликовость (гипофизарный нанизм, микросомия, наносомия). Развивается при дефиците СТГ и/или соматолиберина (см. статьи «Гормоны роста» и «Соматолиберин» в приложении «Справочник терминов»). ‡ Гипофизарный гипогонадизм (гипофизарный евнухоидизм) развивается при дефектах ФСГ, лютропина и их рецепторов (см. статьи «Гормоны гонадотропные», «Гонадолиберин» и «Гипогонадизм» в приложении «Справочник терминов»). ‡ Гипофизарное (нейроэндокринное) ожирение (см. раздел «Ожирение» в главе 10 «Нарушения липидного обмена» и статью «Лептин» в приложении «Справочник терминов»). ‡ Нарушения половой дифференцировки (подробнее см. в статьях «Нарушения половой дифференцировки», «Гермафродитизм», «Недостаточность ферментов» приложения «Справочник терминов». † Пангипопитуитаризм. Понятие «тотальный гипопитуитаризм (пангипопитуитаризм)» применяют при повреждении 75–90% паренхимы аденогипофиза. Примеры этой патологии: послеродовый гипопитуитаризм (синдром Шеана) и гипофизарная кахексия (болезнь Симмондса). • Проявления и механизмы гипопитуитаризма Гипопитуитарные синдромы клинически весьма вариабельны, зависят от масштаба и степени поражения гипофиза, основной патологии и многих других факторов. Однако, всегда имеются три группы признаков: полигормональной недостаточности, нейросоматических расстройств и психических нарушений (рис. 27–7). 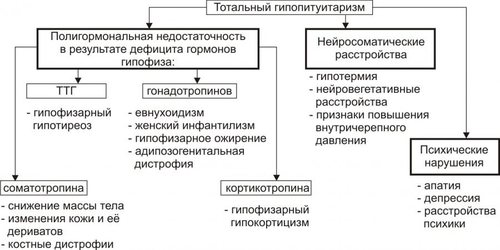 Рис. 27–7. Основные проявления тотального гипопитуитаризма. † Признаки полигормональной недостаточности. Являются результатом дефицита конкретных аденогипофизарных гормонов. ‡ СТГ. § Прогрессирующая потеря массы тела (в среднем 2–6 кг в месяц, в тяжёлых случаях — до 25–30 кг). § Изменения кожи и её производных (сухость, морщинистость кожи, ломкость волос и ногтей). § Дистрофические и дегенеративные изменения костной ткани (декальцификация, остеопороз, повышенная ломкость, выпадение зубов). ‡ ТТГ. Развитие гипотиреоза (что проявляется вялостью, апатией, гиподинамией, снижением интеллекта и физической активности, дистрофическими изменениями в органах). ‡ Гонадотропины. Характеризуется признаками евнухоидизма и инфантилизма. § Атрофия внутренних и наружных половых органов. § Инволюция характерных половых признаков (у женщин — молочных желёз; у мужчин — яичек, предстательной железы, пениса; у тех и других — исчезновение характерного оволосения). Указанные расстройства потенцируются дефицитом андрогенных стероидов коры надпочечников. § Утрата полового чувства, снижение половой потенции. § Отсутствие лактации и восстановления менструации у женщин при развитии синдрома после родов. Послеродовая недостаточность или отсутствие лактации усиливается дефицитом пролактина. ‡ АКТГ. Развитие гипофизарного гипокортицизма, проявляющегося дефицитом глюко и минералокортикоидов, а также андрогенных стероидов. Для гипокортицизма характерны общая слабость, мышечная гипотония, гиподинамия, снижение резистентности организма к возбудителям инфекций, артериальная гипотензия, гипогликемия на фоне относительного гиперинсулинизма, диспептические расстройства (отсутствие аппетита, тошнота и рвота, боли в животе в связи со спазмом ГМК кишечной трубки). † Нейросоматические расстройства. ‡ Обусловленные поражением ядер гипоталамуса: гипотермия (редко — субфебрильное повышение температуры) и вегетативные расстройства (преходящие гипогликемия, полиурия, гипотензивные реакции, коллапсы, тетанические судороги и др.). ‡ Вызванные повышением внутричерепного давления (при внутричерепном росте новообразования или кровоизлиянии): ограничение полей зрения, снижение остроты зрения, головные боли. † Психические нарушения. Наблюдаются при всех указанных выше разновидностях гипоталамогипофизарной недостаточности. Чаще всего они характеризуются апатией и безучастным отношением к происходящему вокруг, депрессией, снижением эмоционального уровня оценки событий, психическими расстройствами (например, галлюцинациями, параноидным психозом). ГИПЕРПИТУИТАРИЗМ Гиперпитуитаризм — избыток содержания и/или эффектов одного либо более гормонов аденогипофиза. • Причины. В большинстве случаев гиперпитуитаризм является результатом аденомы передней доли гипофиза (реже злокачественных опухолей, патологии гипоталамуса, сопровождающейся гиперпродукцией либеринов и/или гипопродукцией статинов. • Виды гиперпитуитаризма. Гиперпитуитаризм характеризуется, как правило, парциальной патологией (рис. 27–8). 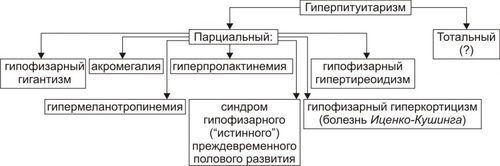 Рис. 27–8. Наиболее частые виды гиперпитуитаризма. † Гипофизарный гигантизм. Макросомия — чрезмерное увеличение роста, размеров тела и внутренних органов — по времени возникновения в онтогенезе является ранней формой эндокринопатии. ‡ Инициальные звенья патогенеза: центрогенные (результат поражений нейронов коры и/или гипоталамуса, приводящих к гиперпродукции соматолиберина и СТГ и/или снижению выработки соматостатина), первичножелезистые (гипофизарное; следствие повышенного синтеза СТГ ацидофильными клетками аденогипофиза), постжелезистые (среди них наиболее часто встречается рецепторный, обусловленный повышенной чувствительностью тканей и органов к СТГ). ‡ Проявления и их механизмы (рис. 27–9). 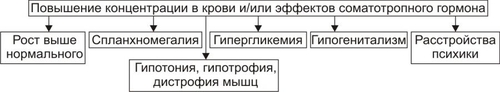 Рис. 27–9. Основные проявления гипофизарного гигантизма. § Увеличение роста, превышающее норму (обычно, выше 200 см у мужчин и 190 см у женщин). Описаны случаи роста 190 см в 10 лет и 250 см в 18 лет. Механизмы: интенсивное эпифизарное и периостальное увеличение размера костей (главным образом — линейного) под действием СТГ. § Несоответствие величины и массы внутренних органов размерам тела (чаще органы также увеличены — спланхномегалия; реже — относительно уменьшены в сравнении со значительно возросшим ростом). В связи с этим возможно развитие функциональной недостаточности отдельных органов (например, сердца и печени). Ведущий механизм развития: разная чувствительность клеток, органов и тканей к СТГ. В органах с высокой чувствительностью интенсивно гипертрофируется паренхима и фиброзная ткань. § Непропорциональное развитие мышц. При возникновении заболевания степень развития мышц обычно соответствует размерам тела. Затем начинает отставать. Развивается слабость мышц, их гипотония, нередко — гипотрофия. При физической нагрузке наступает быстрое утомление. Механизм: дегенеративные изменения миофибрилл, разрастание соединительной ткани. § Гипергликемия, нередко СД. Механизмы: прямое гипергликемизирующее действие СТГ и развитие относительного или абсолютного гипоинсулинизма на фоне повышенного уровня СТГ. § Гипогенитализм. Характеризуется недоразвитием внутренних и внешних половых органов, нередко бесплодием. Механизм: недостаточность синтеза и/или эффектов гонадотропинов. § Психические расстройства (эмоциональная неустойчивость, раздражительность, нарушение сна, снижение умственной работоспособности, психастения). Возможные механизмы: поражение нейронов коры и подкорковых центров, определяющих эмоциональное состояние индивида; длительная негативная стрессреакция, вызванная у пациента фактом заболеванием; гипертиреоз, который нередко сочетается с гигантизмом. † Акромегалия (от гр. akros — крайний, отдалённый, megas — огромный) — диспропорциональное увеличение размера отдельных частей тела (чаще кистей рук, стоп, внутренних органов), сочетающееся с существенными нарушениями жизнедеятельности организма. По времени возникновения в онтогенезе — поздняя форма эндокринопатии. Она развивается после завершения окостенения эпифизарных хрящей. В основе механизмов развития большинства проявлений акромегалии лежит повышение уровня и/или эффектов СТГ. ‡ Инициальные звенья патогенеза. Те же, что и при гипофизарном гигантизме (см. выше). ‡ Проявления и их механизмы представлены на рис. 27–10. 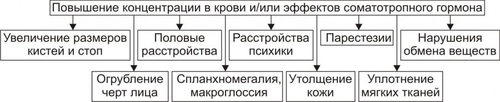 Рис. 27–10. Проявления акромегалии. § Увеличение размеров кистей и стоп за счёт периостального роста костей, стимулируемого СТГ. § Огрубение черт лица (увеличение нижней челюсти, носа, надбровных дуг, скул; формирование толстых кожных складок). § Увеличение размеров внутренних органов (сердца, лёгких, печени, почек, селезёнки). На раннем этапе болезни функция их адекватна, но постепенно развиваются признаки полиорганной недостаточности, сочетающиеся с гиперплазией элементов соединительной ткани. § Утолщение кожи, уплотнение мягких тканей в связи с разрастанием их соединительнотканных элементов. § Увеличение языка (макроглоссия) с отпечатками зубов на нём. § Расстройства обмена веществ: - Углеводного. Характеризуются стойкой гипергликемией (более чем у 50% пациентов) и нередко — СД (примерно у 10% больных). - Жирового. Проявляются повышением в крови уровня холестерина, лецитина, ВЖК, кетоновых тел, ЛП. Механизм: липолитическое, анаболическое, контринсулярное действие избытка СТГ. § Половые расстройства (снижение полового влечения, импотенция; у женщин — дисменорея и нередко галакторея). Механизмы: недостаточность синтеза и/или эффектов гонадотропинов, при галакторее — гиперсекреция пролактина. § Парестезии, особенно в области кистей и стоп (акропарестезии). Механизмы: сдавление нервных стволов, проходящих в костных каналах или углублениях, в связи с периостальным утолщением костей, гипертрофией и уплотнением мягких тканей. † Гиперпролактинемия (см. в статьях «Пролактин» и «Гиперпролактинемия» приложения «Справочник терминов»). † Синдром гипофизарного преждевременного полового развития. Характеризуется появлением отдельных или всех вторичных половых признаков, в некоторых случаях — наступлением половой зрелости (у девочек до 8-, у мальчиков до 9летнего возраста). Развивается вследствие преждевременной секреции гонадолиберинов или гиперсекреции гонадотропинов. ТИПОВЫЕ ФОРМЫ ПАТОЛОГИИ НЕЙРОГИПОФИЗА Патологии нейрогипофиза приводит к нарушениям водного баланса (см. главу 11 «Нарушения баланса воды») в результате АДГ-эндокринопатий (недостаточность или избыточность эффектов АДГ). К ним относятся центральные формы несахарного диабета (недостаточность эффектов АДГ) и синдром неадекватной секреции АДГ (избыточность эффектов АДГ). НЕСАХАРНЫЙ ДИАБЕТ Несахарный диабет (несахарное мочеизнурение) развивается в результате недостаточности эффектов АДГ. Характеристика разных форм заболевания (этиология, клинические проявления, лечение) приведена в статье «Диабет несахарный» приложения «Справочник терминов». Патогенез. Инициальные звенья патогенеза представлены на рис. 27–11. 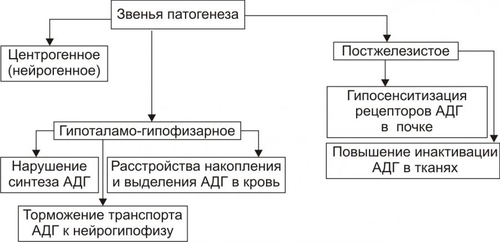 Рис. 27–11. Основные звенья патогенеза несахарного диабета. Основные проявления несахарного диабета и их механизмы приведены на рис. 27–12. 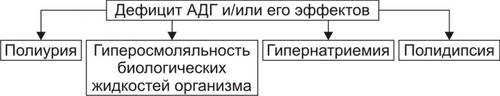 Рис. 27–12. Основные проявления несахарного диабета. • Полиурия. Суточный диурез составляет обычно 3–15 л, иногда до 20–30 л. При этом моча имеет очень низкую осмоляльность. Механизм: недостаточность эффектов АДГ обусловливает снижение реабсорбции жидкости в дистальных отделах канальцев почек. Это приводит к выведению почками большого количества неконцентрированной мочи (относительная плотность всех порций равна обычно 1,000–1,005). • Гиперосмоляльность плазмы крови (более 290 мосм/кг H2O) внутриклеточной и других биологических жидкостей. Механизмы: повышенная фильтрация в клубочках почек жидкости при нормальной реабсорбции ионов, неорганических и органических соединений, гипогидратация клеток и тканей, гемоконцентрация, обусловленная полиурией. • Гипернатриемия. Механизмы: активация выработки, высвобождения и эффектов альдостерона в условиях нарастающей значительной гипогидратации организма и развития гиповолемии. Это ведёт к увеличению реабсорбции Na+ в почках и увеличению его содержания в плазме крови. • Полидипсия — повышенное потребление жидкости, обусловленное патологически усиленной жаждой. Количество выпиваемой пациентами жидкости колеблется от 3 до 15, иногда 30 л в сутки. При отсутствии возможности восполнения утраты жидкости развивается угрожающая жизни гиперосмоляльная гипогидратация организма. Механизм: активация нейронов центра жажды гипоталамуса вследствие гиперосмоляльности плазмы крови и гипогидратации клеток организма. Известно, что дефицит уже 1–2% воды в организме формирует ощущение жажды, особенно при гиперосмоляльности крови. СИНДРОМ НЕАДЕКВАТНОЙ СЕКРЕЦИИ АДГ Синдром неадекватной секреции АДГ (СНАДГ) развивается вследствие избыточности эффектов АДГ и характеризуется олигурией и отёками. Характеристика синдрома приведена в статье «Синдром неадекватной секреции АДГ» (приложение «Справочник терминов»). Патогенез. Ведущую роль в развитии СНАДГ играют два взаимосвязанных инициальных звена: центрогенное и первично-железистое. • Центрогенное. Характеризуется нейрогенной корковоподкорковой стимуляцией образования АДГ в гипоталамусе и его транспорта в нейрогипофиз. • Первичножелезистое. В данном случае речь идет о двух вариантах патогенеза: избыточной продукции и нейросекреции АДГ нейронами гипоталамуса и эктопической секреции АДГ (например, мелкоклеточными карциномами лёгких). Проявления СНАДГ и их механизмы представлены на рис. 27–13. 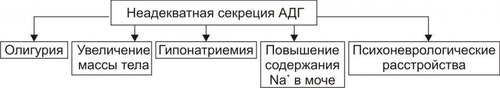 Рис. 27–13. Основные проявления синдрома неадекватной секреции АДГ. • Олигурия. Механизм: значительная активация реабсорбции жидкости в дистальных отделах почечных канальцев под влиянием АДГ. АДГ взаимодействует с V2–рецепторами эпителия дистальных отделов канальцев и собирательных трубочек почек. Это обусловливает образование цАМФ, встраивание водных каналов в цитолемму и торможение экскреции жидкости, что приводит к увеличению реабсорбции воды и снижению диуреза. • Нарастание массы тела. Механизм: задержка жидкости в организме (гипергидратация). Вода накапливается в тканях и сосудистом русле, что и увеличивает массу тела. Важно, что отёки при этом не развиваются в связи с уменьшением [Na+] в интерстиции. • Гипонатриемия. Считается кардинальным признаком синдрома. [Na+] снижается до 130–135 мэкв/л, а осмоляльность плазмы до 270 носмоль/кг. • Повышение содержания натрия в моче (обычно более 20 мэкв/л). Механизм: гипергидратация организма, стимулирующая экскрецию Na+ почками. • Психоневрологические расстройства. Характеризуются апатией, вялостью, нарушением сознания, нередко судорогами. Механизм: набухание нейронов мозга, что характерно для состояния так называемого «водного отравления». НАРУШЕНИЯ ФУНКЦИЙ НАДПОЧЕЧНИКОВ Надпочечники — парные эндокринные железы — состоят из коркового вещества (мезодермального происхождения) и мозгового (нейроэктодермального генеза). Фактически это две железы: кора (на долю коры приходится около 80% массы железы) и мозговая |
