Патфиз ч.1. Патфиз ч. Гл. 1 Введение в предмет Гл. 2 Общая нозология
 Скачать 9.21 Mb. Скачать 9.21 Mb.
|
|
Интенсивность СПОЛ регулируется соотношением факторов, активирующих (прооксидантов) и подавляющих (антиоксидантов) этот процесс (рис. 4–5). К числу наиболее активных прооксидантов относятся легко окисляющиеся соединения, индуцирующие появление свободных радикалов, в частности нафтохиноны, витамины A и D, восстановители — НАДФН2, НАДН2, липоевая кислота, продукты метаболизма Пг и катехоламинов. 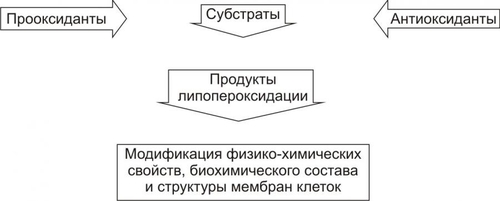 Рис. 4–5. Компоненты системы перекисного окисления липидов. Этапы. Процесс СПОЛ можно условно разделить на три этапа (см. рис. 4–7 и рис. 4–8): 1) кислородная инициация («кислородный» этап — образование активных форм кислорода); 2) генерация свободных радикалов органических и неорганических веществ (свободнорадикальный этап); 3) продукция перекисей и гидроперекисей липидов (перекисный этап). Активные формы кислорода Начальным звеном СПОЛ при повреждении клетки является, как правило, образование так называемых активных форм кислорода: • синглетного (1O2); • супероксидного радикала (O2–); • перекиси водорода (Н2О2); • гидроксильного радикала (OH–). Супероксидный радикал O2– генерируют лейкоциты (особенно интенсивно при фагоцитозе), митохондрии в процессе окислительных реакций, разные ткани при метаболической трансформации катехоламинов, синтезе Пг и других соединений. Пероксид водорода H2О2 образуется при взаимодействии (дисмутации) радикалов O2– в цитозоле клеток и матриксе митохондрий. Этот процесс катализирует супероксиддисмутаза (СОД): O2– + O2– + 2H+ Радикал O2– и H2O2 оказывают прямое повреждающее действие. Наряду с этим, под влиянием ионов железа, присутствующих как в цитозоле, так и в биологических жидкостях, радикал O2– и H2O2 могут трансформироваться (с участием каталазы) в весьма агрессивный и обладающий высоким патогенным эффектом гидроксильный радикал OH–. H2O2 + Fe2 + O2– + H2O2 Гидроксильные радикалы OH– активно вступают в реакции с органическими соединениями, главным образом липидами, а также нуклеиновыми кислотами и белками. В результате образуются другие активные радикалы и перекиси. При этом реакция может приобрести цепной лавинообразный характер (рис. 4–6). Однако, это происходит не всегда. Чрезмерной активации свободнорадикальных и перекисных реакций препятствуют факторы антиоксидантной защиты клеток. 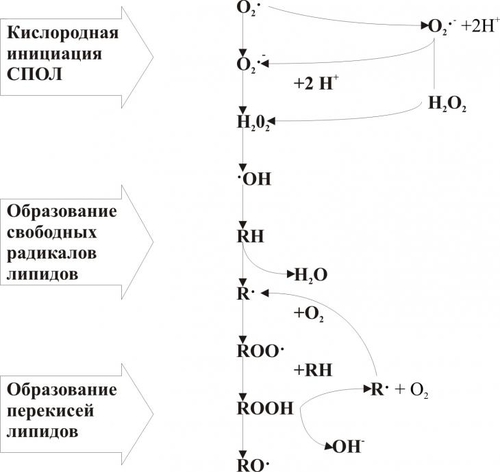 Рис. 4–6. Этапы свободнорадикального перекисного окисления липидов. АНТИОКСИДАНТНАЯ ЗАЩИТА КЛЕТОК В клетках протекают процессы и действуют факторы, которые ограничивают или даже прекращают свободнорадикальные и перекисные реакции, т.е. оказывают антиоксидантный эффект. Одним из таких процессов является взаимодействие радикалов и гидроперекисей липидов между собой, что ведёт к образованию «нерадикальных» соединений. Ведущую роль в системе антиоксидантной защиты клеток играют механизмы ферментной, а также неферментной природы, главные из которых представлены в табл. 4–2 и на рис. 4–7. Таблица 4–2. Звенья антиоксидантной системы и её некоторые факторы
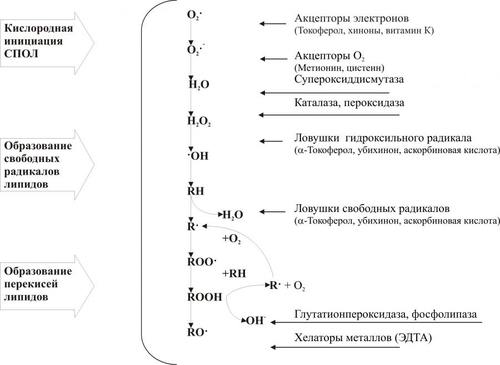 Рис. 4–7. Уровни действия антиоксидантных факторов клетки. Чрезмерная активация свободнорадикальных и перекисных реакций — один из главных факторов повреждения клеточных мембран и ферментов. Решающее значение при этом имеют изменения физикохимических свойств липидов и появление структурных дефектов мембран. • Изменения физикохимических свойств липидов мембран ведут к изменениям конформации липопротеиновых и белковых комплексов и в связи с этим — ингибированию активности ферментных систем. • Образование структурных дефектов в мембранах — так называемых простейших каналов (кластеров) — обусловливает существенное повышение их проницаемости, приводящее к неконтролироемому транспорту через них в клетки и из клеток в интерстиций органических и неорганических веществ. Указанные процессы, в свою очередь, приводят к нарушениям важных для жизнедеятельности клеток процессов — рецепции и передачи гуморальных воздействий, трансмембранного переноса ионов и молекул, возбудимости, генерации и проведения нервных импульсов, обмена веществ, межклеточных взаимодействий и др. Накопление в мембране липидных гидроперекисей приводит к их объединению в мицеллы, создающие трансмембранные каналы проницаемости, по которым возможен неконтролируемый ток катионов и других молекул в клетку и из неё, что, как правило, фатально для клетки. Увеличение образования продуктов СПОЛ и параллельно с этим — кластеров может привести к фрагментации мембран (этот процесс получил название детергентного действия продуктов СПОЛ) и к гибели клетки. АКТИВАЦИЯ ГИДРОЛАЗ Cостав и состояние мембран могут модифицировать не только свободнорадикальные и липопероксидные процессы, но также и мембраносвязанные, свободные (солюбилизированные) и лизосомальные липазы, фосфолипазы и протеазы. Под влиянием патогенных факторов активность этих ферментов и/или их содержание в клетке могут значительно повыситься (например, при развитии ацидоза, способствующего выходу ферментов из лизосом и их последующей активации). В результате интенсивному гидролизу подвергаются фосфолипиды и белки мембран, а также ферменты. Это сопровождается значительным повышением проницаемости мембран и снижением активности ферментов. ДЕТЕРГЕНТНЫЕ ЭФФЕКТЫ АМФИФИЛОВ В результате активации липопероксидных реакций и гидролаз (главным образом липаз и фосфолипаз) в клетке накапливаются гидроперекиси липидов, свободные жирные кислоты, фосфолипиды, в частности глицерофосфолипиды, фосфатидилхолины, фосфатидилэтаноламины, фосфатидилсерины. Эти соединения получили название амфифильных в связи с их способностью проникать и фиксироваться как в гидрофобной, так и в гидрофильной зоне мембран. Накопление в клетке амфифилов в большом количестве сопровождается массированным внедрением их в мембраны, что ведёт к формированию обширных кластеров и микроразрывов в них. РАССТРОЙСТВА ПРОЦЕССА РЕПАРАЦИИ МЕМБРАН При воздействии повреждающих факторов репаративный ресинтез альтерированных или утраченных липидных, белковых, липопротеидных, гликопротеидных и других молекул мембран, а также их синтез de novo существенно подавляются. Эффективность восстановления мембран становится недостаточной. Это потенцирует степень и масштаб повреждения мембранного аппарата клеток. НАРУШЕНИЯ КОНФОРМАЦИИ МАКРОМОЛЕКУЛ Модификации нормальной конформации (пространственной структуры, формы) макромолекул . ПЕРЕРАСТЯЖЕНИЕ И РАЗРЫВ МЕМБРАН Перерастяжение и разрыв мембран набухших клеток и мембранных органоидов в связи с их гипергидратацией — важный механизм повреждения и гибели как органоидов, так и клетки в целом. Гипергидратация является следствием значительного увеличения осмотического и онкотического давления в клетках. Это в свою очередь обусловлено избытком в них гидрофильных молекул органических соединений (молочная и пировиноградная кислоты, альбумины, глюкоза и др.), а также ионов, накопившихся в связи с расстройствами метаболизма. ДИСБАЛАНС ИОНОВ И ВОДЫ Дисбаланс ионов и воды в клетке, как правило, развивается вслед за или одновременно с расстройствами энергетического обеспечения и повреждением мембран и ферментов. В результате существенно изменяется трансмембранный перенос многих ионов. В наибольшей мере это относится к K+, Na+, Ca2+, Mg2+, Cl–, т.е. ионам, которые принимают участие в таких жизненно важных процессах, как возбуждение, проведение потенциалов действия (ПД), электромеханическое сопряжение и др. Ионный дисбаланс характеризуется изменением соотношения отдельных ионов в цитозоле и нарушением трансмембранного соотношения ионов как по обе стороны плазмолеммы, так и внутриклеточных мембран. ПРОЯВЛЕНИЯ ИОННОГО ДИСБАЛАНСА Проявления ионного дисбаланса многообразны. Наиболее существенны для функционирования и самого существования клеток изменения ионного состава, определяемые разными мембранными АТФазами и дефектами мембран. Катионы Вследствие нарушения работы Na+,K+АТФазы плазмолеммы происходит: • накопление в цитозоле клетки избытка Na+; • потеря клеткой K+; При нарушении работы Na+Ca2+–ионообменного механизма плазмолеммы (обмен двух Na+, входящих в клетку, на один Ca2+, выходящий из неё), а также Ca2+АТФаз происходит увеличение содержания Ca2+ в цитозоле (рис. 4–8). 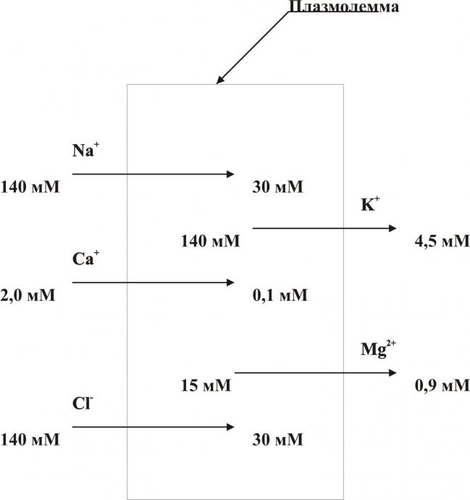 Рис. 4–8. Направление градиентов и содержание отдельных ионов (на примере кардиомиоцитов). Анионы Нарушения трансмембранного распределения катионов сопровождаются изменением содержания в клетке и анионов Cl–, OH–, HCO3– и др. (рис. 4–9). 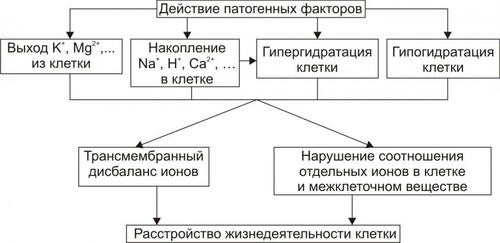 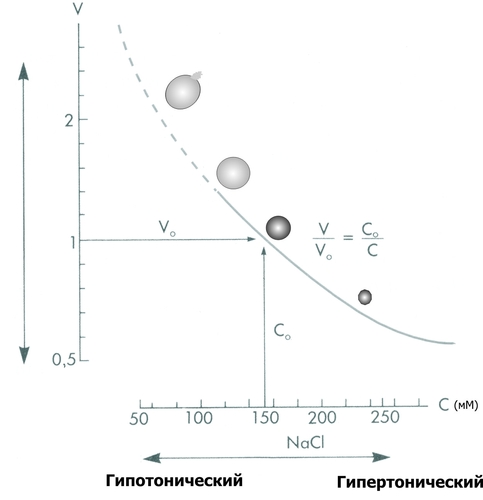 Рис. 4–9. Дисбаланс ионов и воды в клетке при её повреждении. ПОСЛЕДСТВИЯ ИОННОГО ДИСБАЛАНСА Важными последствиями ионного дисбаланса являются изменения объёма клеток и клеточных органоидов (гипо– и гипергидратация), а также нарушения электрогенеза в возбудимых клеточных элементах (например, в кардиомиоцитах, нейронах, скелетных мышечных волокнах, гладкомышечных клетках — ГМК). Состояние взвешенных в растворе NaCl эритроцитов. По абсциссе: концентрация (С) NaCl (ммоль/л); по ординате: объём клеток (V). При концентрации NaCl 154 ммоль/л объём клеток такой же, как и в плазме крови (изотонический раствор NaCl), При увеличении концентрации NaCl (гипертонический раствор NaCl) вода выходит из эритроцитов, и они сморщиваются. При уменьшении концентрации NaCl (гипотонический раствор NaCl) вода входит в эритроциты, и они набухают. При гипотоничности раствора, примерно в 1,4 раза превышающей значение изотонического раствора, происходит разрушение мембраны. [5]. НАРУШЕНИЯ ЭЛЕКТРОГЕНЕЗА Нарушения электрогенеза в виде изменений характеристик МП и ПД имеют существенное значение, поскольку они нередко являются одним из важных признаков наличия и характера повреждения клеток. Примером могут служить изменения ЭКГ при повреждении клеток миокарда, электроэнцефалограммы при нарушении структуры и функций нейронов головного мозга, электромиограммы при изменениях в мышечных клетках. Патогенез такого рода повреждений возбудимых клеток приведён на рис. 4–11. 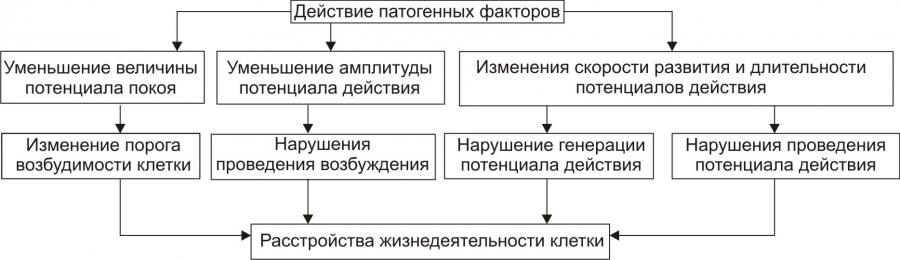 Рис. 4–10. Изменения электрофизиологических свойств возбудимой клетки при её повреждении. ГЕНЕТИЧЕСКИЕ НАРУШЕНИЯ Повреждения генома и/или механизмов экспрессии генов, репликации и репарации ДНК, клеточного цикла — существенные механизмы альтерации, имеющие фатальные последствия. Эти повреждения играют существенную роль при малигнизации клеток и процессах онкогенеза. На рис. 4–11 приведены основные изменения генетической программы клеток, происходящие под влиянием повреждающих факторов. 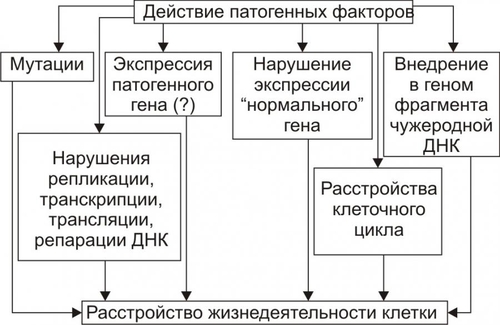 Рис. 4–11. Нарушения генетической программы и/или механизмов её реализации при повреждении клетки. ПРИЧИНЫ Повреждение клетки и её гибель могут произойти при прямом или опосредованном действии на генетический аппарат клетки патогенных агентов различного характера. Нарушения структуры ДНК и/или её деградация часто являются пусковым звеном насильственной гибели клетки. 1 МЕХАНИЗМЫ К числу наиболее существенных механизмов нарушения генетической информации клетки относятся: • мутации; • неконтролируемая дерепрессия генов (например, онкогенов или генов апоптоза); • подавление активности жизненно важных генов (например, программирующих синтез ферментов); • трансфекция (внедрение в геном чужеродной ДНК, например ДНК вируса герпеса или опухоли); • нарушения репарации ДНК. ПОСЛЕДСТВИЯ Все последствия повреждения генома, а также механизмов реализации генетической программы рассмотреть невозможно. Ниже приведены лишь некоторые, имеющие наибольшее значение в патологии человека. • Энзимопатии (нарушения структуры и функции энзимов и ферментативного катализа, что фатальным образом сказывается на всех сторонах жизнедеятельности клеток; например, многие из тысяч моногенных заболеваний являются следствием дефекта генов, кодирующих структуру ферментов). • Нарушения клеточного цикла (дефекты даже одного из сотен факторов, регулирующих клеточный цикл, неизбежно приводят к расстройству пролиферации клеток, в том числе — к бесконтрольному размножению повреждённой клетки и формированию малигнизированных клонов). • Активация онкогенов (этот процесс является ключевым звеном канцерогенеза). • Неконтролируемая активация апоптоза (приводящая, например, к иммунодефицитным состояниям или гипотрофии тканей и органов). РАССТРОЙСТВА РЕГУЛЯЦИИ ВНУТРИКЛЕТОЧНЫХ ПРОЦЕССОВ Нарушения жизнедеятельности клетки могут быть результатом расстройств одного или нескольких уровней реализации регуляторных механизмов. Некоторые из них приведены на рис. 4–13. 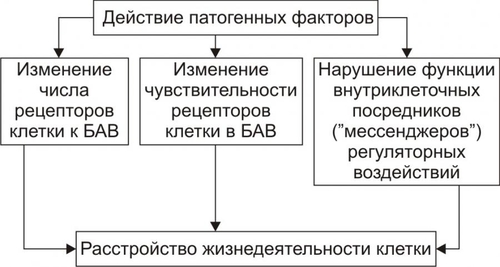 Рис. 4–12. Механизмы нарушения регуляции клетки при её повреждении. МЕЖКЛЕТОЧНЫЕ ИНФОРМАЦИОННЫЕ СИГНАЛЫ Все виды информационных межклеточных взаимодействий описаны в рамках концепции «сигнал–ответ», основы которой заложил Пауль Эрлих. Межклеточные информационные взаимодействия укладываются в следующую схему: сигнал Сигналы Передачу сигналов от клетки к клетке осуществляют сигнальные молекулы (первые посредники), вырабатываемые в одних клетках и специфически воздействующие на другие — клетки–мишени. Специфичность воздействия сигнальных молекул определяют рецепторы клетки–мишени, связывающие только собственные лиганды. Все сигнальные молекулы (лиганды) — в зависимости от их физико-химической природы — подразделяют на полярные (гидрофильные) и аполярные (жирорастворимые). Гидрофильные молекулы (например,нейромедиаторы, цитокины, пептидные гормоны, Аг) не проникают через плазматическую мембрану и связываются с рецепторами плазмолеммы (мембранные рецепторы). Жирорастворимые молекулы (например,стероидные и тиреоидные гормоны) проникают через плазмолемму и связываются с рецепторами внутри клетки (ядерные рецепторы). Рецепторы. Описаны три класса клеточных рецепторов: мембранные, ядерные и сиротские. Мембранные рецепторы — гликопротеины. Они контролируют проницаемость плазмолеммы путём изменения конформации белков ионных каналов (например,нхолинорецептор), регулируют поступление молекул в клетку (например,холестерина при помощи рецепторов ЛНП), связывают молекулы внеклеточного матрикса с элементами цитоскелета (например,интегрины), регистрируют присутствие информационных сигналов (например, нейромедиаторов, квантов света, обонятельных молекул, Аг, цитокинов, гормонов пептидной природы). Мембранные рецепторы регистрируют поступающий к клетке сигнал и передают его внутриклеточным химическим соединениям, опосредующим конечный эффект (вторые посредники). Функционально мембранные рецепторы подразделяют на каталитические, связанные с ионными каналами и оперирующие через Gбелок. |
