Патфиз ч.1. Патфиз ч. Гл. 1 Введение в предмет Гл. 2 Общая нозология
 Скачать 9.21 Mb. Скачать 9.21 Mb.
|
|
АПОПТОЗ Апоптоз является еще одним — своеобразным вариантом гибели отдельных клеток.
Апоптоз — программируемая гибель клетки. В этом его принципиальное отличие от некроза. Другое важное отличие апоптоза от некроза состоит в том, что программу апоптоза запускает информационный сигнал, тогда как некроз клеток развивается под непосредственным влиянием повреждающего агента. В финале некроза происходит лизис клеток и освобождение их содержимого в межклеточное пространство. В связи с этим, в зоне некроза развивается воспаление. Апоптоз же завершается фагоцитозом фрагментов разрушенной клетки и признаки воспаления, как правило, отсутствуют. Некроз — всегда результат действия патогенного фактора значительной силы. Апоптоз, в отличие от этого, наблюдается в ходе многих физиологических процессов, а также при адаптации клетки к факторам среды. Апоптоз — в отличие от некроза — энергозависим, требует синтеза РНК и белков. ПРОЯВЛЕНИЯ АПОПТОЗА При апоптозе цитоплазма клетки уплотняется, конденсируется хроматин, ядро подвергается пикнозу с последующим кариорексисом. Фрагментации ядра предшествует межнуклеосомная упорядоченная деградация ядерной ДНК с образованием последовательно уменьшающихся фрагментов длиной до 180 пар оснований. Распад ДНК на отдельные нуклеосомные фрагменты с разрывами нуклеотидной цепочки приводит к появлению фрагментов ДНК разной длины. В конечной стадии апоптоза фрагментации подвергаются сами клетки с формированием так называемых апоптозных телец — окружённых мембраной фрагментов клеток, включающих остатки органелл, цитолеммы, цитоплазмы, хроматина. Клетки, вошедшие в апоптоз, и апоптозные тельца фагоцитируются макрофагами и гранулоцитами; фагоцитоз при этом не сопровождается местным воспалением. ПРИМЕРЫ АПОПТОЗА Запрограммированная гибель клеток. Это естественный процесс массовой гибели клеток и элиминации целых клонов в ходе эмбрионального развития, гистогенеза и морфогенеза органов. В данном случае речь идёт о гибели клеток, не достигших состояния терминальной дифференцировки. Примером служит запрограммированная гибель нейробластов (от 25 до 75%) на определённых этапах развития мозга. Гибель клеток, выполнивших свою функцию. Наблюдается при удалении клонов иммунокомпетентных клеток при завершении иммунного ответа. Эозинофилы погибают после дегрануляции, например, в очаге воспаления. Клетки, выполнившие свою функцию, также гибнут путём апоптоза. Механизм гибели клеток, достигших состояния терминальной дифференцировки и выполнивших свою функцию, изучен еще недостаточно, однако ясно, что он генетически детерминирован. Так, экспрессия гена fos служит маркёром терминальной дифференцировки и одновременно предшествует гибели клеток. Дегенерация. При некоторых патологических состояниях наблюдается относительно избирательная гибель клеток, например, в нервной системе при боковом амиотрофическом склерозе (болезни Шарко) и болезни Альцхаймера. Врождённая форма бокового амиотрофического склероза обусловлена мутацией гена Cu/Zn–супероксиддисмутазы 1. Продукт дефектного гена не способен ингибировать ИЛ1 Ликвидации аутоагрессивных T-клеток. Имеет место на определенных этапах развития тимуса, после завершеия иммунного ответа или устранения клеток, подвергшихся воздействию цитотоксических T-лимфоцитов. Старение. Апоптоз наблюдается, например, при гормонозависимой инволюции клеток эндометрия и атрезии фолликулов яичников у женщин в менопаузе, а также — ткани простаты и яичек у пожилых мужчин). Трансфекция. Внедрение в клетку нуклеиновой кислоты вируса (например, при вирусном гепатите, миокардите, энцефалите, СПИДе) нередко сопрвождается ее апоптозом. Повреждение клетки. Воздействие на клетку агентов, повреждающих её, но не приводящих к некрозу (например, повышенной температуры, радиации, цитостатиков, гипоксии). Увеличение же интенсивности этих воздействий приводит к некрозу. Опухолевый рост. Апоптоз как правило выявляется и при формировании опухолевого узла и при его деструкции). МЕХАНИЗМ АПОПТОЗА В процессе реализации апоптоза условно выделяют четыре стадии (рис. 4–16). Рис. 4–16. Стадии апоптоза. Стадия инициации На этой стадии информационные сигналы рецептируются клеткой. Патогенный агент либо сам является сигналом, либо обусловливает генерацию сигнала в клетке и его проведение к внутриклеточным регуляторным структурам и молекулам (рис. 4–17). 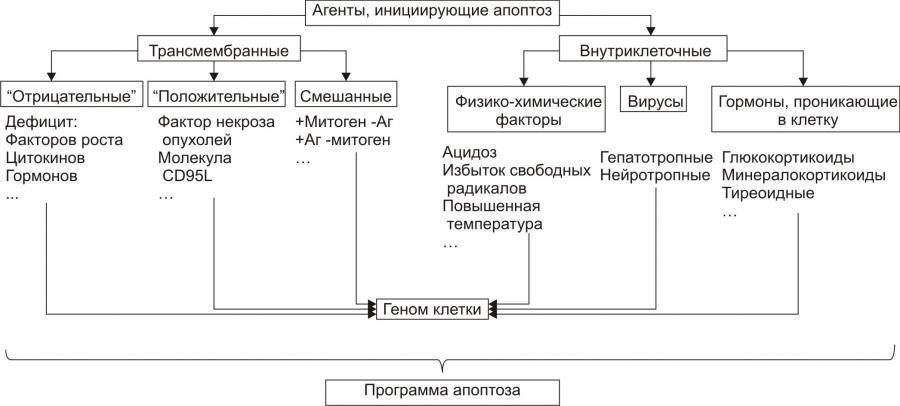 Рис. 4–17. Апоптоз: стадия инициации. Инициирующие апоптоз стимулы могут быть трансмембранными или внутриклеточными. • Трансмембранные сигналы подразделяют на отрицательные, положительные и смешанные. † Отрицательные сигналы: отсутствие или прекращение воздействия на клетку факторов роста, цитокинов, регулирующих деление и созревание клетки, а также гормонов, контролирующих развитие клеток. В норме действие названных выше групп БАВ на мембранные рецепторы обеспечивает подавление программы гибели клеток и нормальную их жизнедеятельность. Напротив, их отсутствие или снижение эффектов «освобождает» программу апоптоза. Так, для нормальной жизнедеятельности ряда нейронов необходимо постоянное наличие нейротрофических факторов. Их устранение или снижение эффектов на нервные клетки может привести к включению программы смерти нейрона. † Положительные сигналы в итоге генерируют запуск программы апоптоза. Так, связывание ФНО (FasL) с его мембранным рецептором CD95 (Fas) активирует программу смерти клетки. † Смешанные сигналы являются комбинацией воздействий сигналов первой и второй групп. Так, апоптозу подвергаются лимфоциты, простимулированные митогеном, но не проконтактировавшие с чужеродным Аг. Погибают и те лимфоциты, на которые воздействовал Аг, но не получившие других сигналов, например, митогенного или от HLA. • Среди внутриклеточных стимулов апоптоза наибольшее значение имеют избыток H+, свободные радикалы липидов и других веществ, повышенная температура, внутриклеточные вирусы и гормоны, реализующие свой эффект через ядерные рецепторы (например, глюкокортикоиды). Стадия программирования Стадия программирования (контроля и интеграции процессов апоптоза) представлена на рис. 4–18). 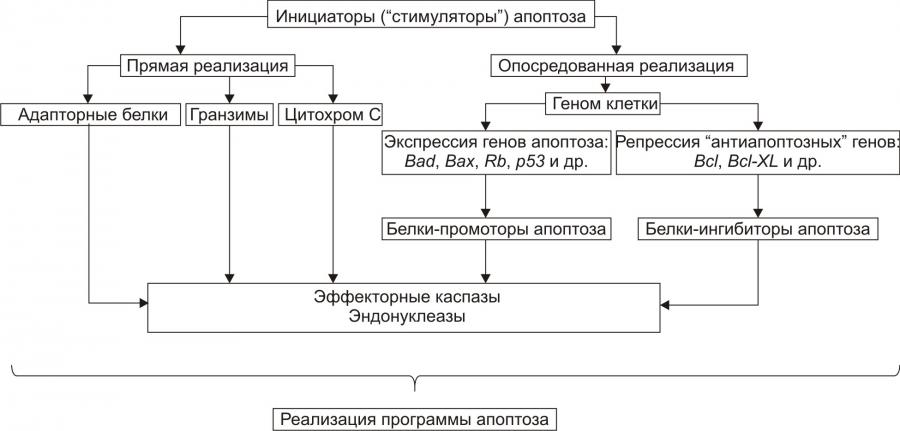 Рис. 4–18. Апоптоз: стадия программирования. На этой стадии специализированные белки либо реализуют сигнал к апоптозу путём активации исполнительной программы (её эффекторами являются цистеиновые протеазы — каспазы и эндонуклеазы), либо блокируют потенциально летальный сигнал. Выделяют два варианта реализации стадии программирования: 1. Прямая активация эффекторных каспаз и эндонуклеаз (минуя геном клетки) и 2. Опосредованная их активация через экспрессию определенных генов. Прямая передача сигнала осуществляется через адапторные белки, гранзимы и цитохром С • Адапторные белки. В качестве адапторного белка выступает, например, каспаза–8. Так реализуют своё действие цитокины T-лимфоцитов–киллеров в отношении чужеродных клеток, ФНО и другие лиганды CD95. • Цитохром C. Выделяясь из митохондрий, цитохром c вместе с белком Apaf–1 и каспазой–9 формирует комплекс активации (апоптосому) эффекторных каспаз. Каспаза–8 и каспаза–9 активируют эффекторные каспазы (например, каспазу–3), которые участвуют в протеолизе белков. • Гранзимы. Эти протеазы выделяют цитотоксические T-лимфоциты. Протеазы могут проникать в клеткимишени через цитоплазматические поры, предварительно сформированные перфоринами. Гранзимы активируют аспартатспецифические цистеиновые протеазы клеткимишени, подвергающейся апоптозу. Прямая передача сигнала наблюдается обычно в безъядерных клетках, например, эритроцитах. Опосредованная передача сигнала подразумевает репрессию генов, кодирующих ингибиторы апоптоза и экспрессию генов, кодирующих промоторы апоптоза. Белкиингибиторы апоптоза (например, продукты экспрессии антиапоптозных генов Bcl–2, BclXL) блокируют апоптоз (например, путём уменьшения проницаемости мембран митохондрий, тем самым уменьшая вероятность выхода в цитозоль одного из пусковых факторов апоптоза — цитохрома C). Белкипромоторы апоптоза (например, белки, синтез которых контролируется генами Bad, Bax, антионкогенами Rb или p53) активируют эффекторные каспазы и эндонуклеазы. Стадия реализации программы Стадия реализации программы апоптоза (исполнительная, эффекторная) состоит в собственно гибели клетки, осуществляемой посредством активации протеаз и эндонуклеаз (рис. 4–19). 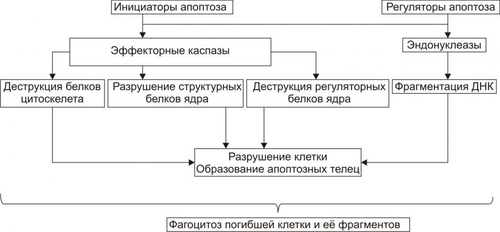 Рис. 4–19. Апоптоз: стадия реализации программы. Непосредственными исполнителями процесса «умертвления» клетки являются Ca2+,Mg2+зависимые эндонуклеазы (катализируют распад нуклеиновых кислот) и эффекторные каспазы (подвергают протеолитическому расщеплению различные белки, в том числе белки цитоскелета, ядра, регуляторные белки и ферменты). В результате разрушения белков и хроматина в процессе апоптоза клетка подвергается деструкции. В ней формируются и от неё отпочковываются фрагменты, содержащие остатки органелл, цитоплазмы, хроматина и цитолеммы — апоптозные тельца. Стадия удаления фрагментов погибших клеток На поверхности апоптозных телец экспрессируются лиганды, с которыми взаимодействуют рецепторы фагоцитирующих клеток. Фагоциты обнаруживают, поглощают и разрушают апоптозные тельца. Благодаря этому, содержимое разрушенной клетки не попадает в межклеточное пространство, а при апоптозе отсутствует воспалительная реакция. Этот признак отличает апоптоз от некроза, который сопровождается развитием перинекротического воспаления. ПРОЯВЛЕНИЯ ПОВРЕЖДЕНИЙ КЛЕТОК Любое повреждение клетки вызывает в не разной степени выраженности специфические и неспецифические изменения (рис. 4–20). 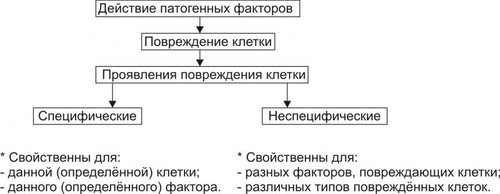 Рис. 4–20. Проявления повреждения клетки. СПЕЦИФИЧЕСКИЕ ИЗМЕНЕНИЯ КЛЕТОК ПРИ ПОВРЕЖДЕНИИ Специфические изменения клеток при повреждении характерны для данного патогенного фактора при действии его на различные клетки. • Осмотическое давление. Повышение осмотического давления в клетке сопровождается её гипергидратацией, растяжением мембран и нарушением их целостности. • Разобщители. Под влиянием разобщителей окисления и фосфорилирования (например, высших жирных кислот — ВЖК, Ca2+) снижается или блокируется сопряжение этих процессов и уменьшается эффективность биологического окисления. • Гиперальдостеронемия. Повышенное содержание в крови гормона коры надпочечников — альдостерона ведёт к накоплению в клетке Na+. Действие различных повреждающих агентов на определённые виды клеток вызывает специфические для этих клеток изменения. Например, влияние разнообразных (химических, физических, биологических) патогенных факторов значительной силы на мышечные элементы сопровождается развитием контрактуры, на эритроциты — их гемолизом и выходом Hb. НЕСПЕЦИФИЧЕСКИЕ ИЗМЕНЕНИЯ КЛЕТОК ПРИ ПОВРЕЖДЕНИИ Неспецифические (стереотипные, стандартные) изменения в клетках находят при альтерации различных видов клеток и действии на них широкого спектра патогенных агентов: • гипоксии; • ацидоза; • чрезмерной активации свободнорадикальных и перекисных реакций; • денатурации молекул белка; • повышения проницаемости клеточных мембран; • дисбаланса ионов и воды. Выявление конкретных специфических и неспецифических изменений в клетках дает возможность судить о специфике и силе действия патогенного фактора, о степени и масштабе повреждения, а также об эффективности (или неэффективности) лекарственных средств. Например, по изменению активности в плазме крови относительно специфического для клеток миокарда MBизофермента КФК,содержания тропомиозина и миоглобина в сопоставлении с динамикой таких неспецифических показателей как [K+] (калий выходит из повреждённых кардиомиоцитов) изменений на ЭКГ, показателей сократительной функции различных регионов сердца можно судить о степени и объёме его повреждения при его инфаркте. АДАПТАЦИЯ КЛЕТОК Действие на клетку патогенных факторов сопровождается активацией (или включением) различных реакций и процессов, направленных на устранение либо уменьшение степени повреждения и его последствий, а также обеспечивающих устойчивость клеток к повреждению. Совокупность этих реакций обеспечивает приспособление (адаптацию) клетки к изменившимся условиям её жизнедеятельности. МЕХАНИЗМЫ АДАПТАЦИИ КЛЕТОК К ПОВРЕЖДЕНИЮ Комплекс адаптивных реакций клеток условно подразделяют на внутриклеточные и межклеточные (рис. 4–21).  Рис. 4–21. Механизмы адаптации клетки при её повреждении. ВНУТРИКЛЕТОЧНЫЕ АДАПТИВНЫЕ МЕХАНИЗМЫ К внутриклеточным адаптивным механизмам относят следующие реакции и процессы.
КОМПЕНСАЦИЯ ЭНЕРГЕТИЧЕСКИХ НАРУШЕНИЙ Механизмы компенсации нарушений энергетического обеспечения клетки приведены на рис. 4–22. 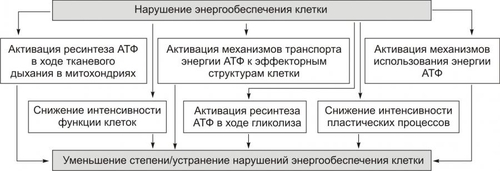 Рис. 4–22. Механизмы компенсации нарушений энергетического обеспечения клетки при её повреждении. При повреждении клетки, как правило, в большей или меньшей мере повреждаются митохондрии и снижается ресинтез АТФ в процессе тканевого дыхания. Эти изменения служат сигналом для включения компенсационных механизмов: • увеличения продукции АТФ в системе гликолиза; • повышения активности ферментов, принимающих участие в процессах окисления и фосфорилирования (при слабой или умеренной степени повреждения клеток); • активации ферментов транспорта энергии АТФ (адениннуклеотидтрансферазы, КФК); • повышения эффективности ферментов утилизации энергии АТФ (АТФаз); • ограничения функциональной активности клетки; • снижения интенсивности пластических процессов в клетке. ЗАЩИТА МЕМБРАН И ФЕРМЕНТОВ Защита мембран и ферментов клетки осуществляют указанные на рис. 4–23 механизмы. 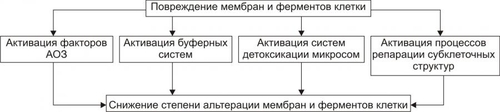 Рис. 4–23. Механизмы защиты мембран и ферментов клетки при её повреждении. АОЗ — факторы антиоксидантной защиты. Ферменты антиоксидантной защиты (СОД, инактивирующая радикалы O2–; каталаза и глутатионпероксидазы, расщепляющие соответственно Н2О2 и липиды) уменьшают патогенные эффекты свободнорадикальных и перекисных реакций. Активация буферных систем клетки ведёт к уменьшению внутриклеточного ацидоза (следствие ацидоза — избыточная гидролитическая активность лизосомальных ферментов). Повышение активности ферментов микросом (особенно ферментов эндоплазматической сети) усиливает физикохимическую трансформацию патогенных агентов путём их окисления, восстановления, деметилирования и т.д. Дерепрессия генов имеет следствием активацию синтеза компонентов мембран (белков, липидов, углеводов) взамен повреждённых или утраченных. ДИСБАЛАНС ИОНОВ И ВОДЫ Механизмы уменьшения выраженности или устранения дисбаланса ионов и воды в клетке приведены на рис. 4–24. 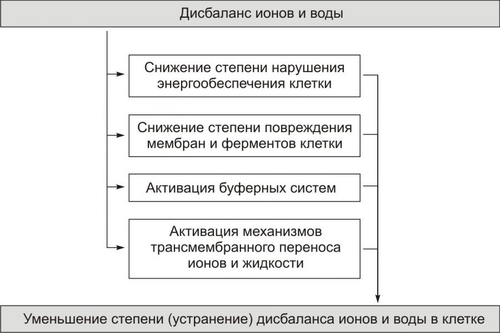 Рис. 4–24. Механизмы уменьшения степени (устранения) дисбаланса ионов и воды в клетке при её повреждении. При этом ближайшими задачами являются следующие: • активация процессов энергетического обеспечения ионных насосов; • повышение активности ферментов, принимающих участие в транспорте ионов; • изменение интенсивности и характера метаболизма (например, усиление гликолиза сопровождается высвобождением K+, содержание которого в повреждённых клетках уменьшено в связи с повышением проницаемости их мембран). • нормализация внутриклеточных буферных систем (например, активация карбонатного, фосфатного, белкового буферов способствует восстановлению оптимального соотношения в цитозоле и трансмембранного распределения ионов K+, Na+, Ca2+ и других, в частности, путём уменьшения в клетке [Н+]). • уменьшение дисбаланса ионов, в свою очередь, может сопровождаться нормализацией содержания и циркуляции внутриклеточной жидкости, объёма клеток и их органелл. ГЕНЕТИЧЕСКИЕ ДЕФЕКТЫ Механизмы устранения дефектов генетической программы клетки и экспрессии генов представлены на рис. 4–25. 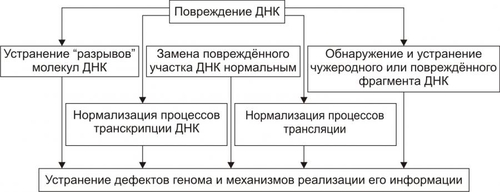 Рис. 4–25. Устранение дефектов генетической программы клетки и механизмы её реализации. Устранение мелкомасштабных изменений в геноме осуществляют деметилазы. Они удаляют метильные группы и лигазы, устраняют разрывы в цепях ДНК, возникающие под действием ионизирующего излучения, свободных радикалов и др. Особое значение имеет репарация ДНК, как эксцизионная, так и рекомбинационная. Устранение нарушений механизмов реализации генетической программы клетки может нормализовать нуклео и цитотомию, транскрипцию, трансляции и др. МЕХАНИЗМЫ РЕГУЛЯЦИИ ВНУТРИКЛЕТОЧНЫХ ПРОЦЕССОВ Реакции, компенсирующие нарушения механизмов восприятия клеткой регулирующих влияний, указаны на рис. 4–26. 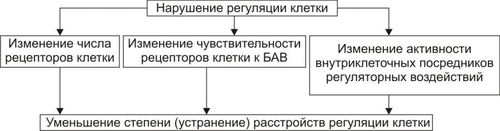 Рис. 4–26. Механизмы компенсации расстройств регуляции клетки при её повреждении. Кроме того, в повреждённой клетке наблюдается коррекция контуров обратной связи в метаболических цепочках (например, концентрация конечных продуктов по принципу положительной или отрицательной обратной связи изменяет активность ферментов в начале цепочки. СНИЖЕНИЕ ФУНКЦИОНАЛЬНОЙ АКТИВНОСТИ КЛЕТОК Важным механизмом защиты клетки является снижение выраженности или полное прекращение выполнения клеткой её специфических функций. Это позволяет перераспределить ресурсы и тем самым увеличить возможности адаптации клетки для компенсации изменений, вызванных повреждающим фактором. При этом энергия, уходившая на выполнение специфической клеточной функции, позволяет клетке компенсировать изменения метаболизма, вызванные повреждающим фактором. В результате степень и масштаб повреждения клеток при действии патогенного фактора существенно снижаются, а после прекращения его действия отмечается более интенсивное и полное восстановление клеточных структур и их функции. К главным механизмам, обеспечивающим временное понижение функции клеток, отнесят: • уменьшение эффекторной импульсации от нервных центров; • снижение числа или чувствительности рецепторов на поверхности клетки; • внутриклеточное регуляторное подавление метаболических реакций; • репрессию активности отдельных генов. СТЕРЕОТИПНЫЕ (ТИПОВЫЕ) ПРИСПОСОБИТЕЛЬНЫЕ ИЗМЕНЕНИЯ Адаптация клеток в условиях повреждения происходит не только на метаболическом и функциональном уровнях. Длительное, повторное или значительное повреждение ведёт к существенным структурным перестройкам в клетке, имеющим адаптивное значение. Такая адаптация к действию повреждающих факторов происходит путём стереотипных (типовых) приспособительных изменений клетки или клеточной системы (атрофия, гипертрофия, гиперплазия, метаплазия, дисплазия). Например, в условиях хронического венозного застоя в печени кислородное голодание гепатоцитов сопровождается их атрофией. Процессы атрофии, гипертрофии, гиперплазии, а также регенерации рассмотрены в «Приложения» (см. «Справочник терминов» на компакт-дтске). Белки теплового шока При воздействии на клетку повреждающих факторов (изменения температуры, гипоксия, химические факторы, инфицирование вирусом и др.) происходит интенсификация синтеза белков теплового шока (HSP, от Heat Shock Proteins; их называют также белками стресса). Эти белки способны защитить клетку от повреждений и предотвратить её гибель. Наиболее распространены HSP с Mr 70 000 (hsp70) и 90 000 (hsp90). Механизм действия этих белков многообразен и состоит в регуляции сборки и конформации других белков. Примером повышенной резистентности, обусловленной белками теплового шока, могут служить опухолевые клетки, которые экспрессируют повышенный уровень HSP70, что защищает их от повреждения и гибели. МЕЖКЛЕТОЧНЫЕ АДАПТИВНЫЕ МЕХАНИЗМЫ Для межклеточных (системных) механизмов адаптации к повреждению характерно взаимодействие клеток друг с другом. Такое взаимодействие осуществляется несколькими путями. ПУТИ ВЗАИМОДЕЙСТВИЯ • Обмен метаболитами, местными БАВ — цитокинами, ионами. • Реализация реакций системы ИБН. • Изменения лимфо и кровообращения. • Эндокринные влияния. • Нервные воздействия. ПРИМЕРЫ • Гипоксия. Уменьшение содержания кислорода в крови (что приводит или может привести к повреждению клеток, прежде всего мозга) рефлекторно (через раздражение хеморецепторов) стимулирует активность дыхательного центра. В результате увеличивается объём альвеолярной вентиляции, что ликвидирует или уменьшает недостаток кислорода в крови и тканях. • Гипогликемия. Повреждение клеток в условиях гипогликемии может быть уменьшено в результате увеличения выработки гормонов, способствующих повышению в плазме крови глюкозы (ГПК) и транспорта её в клетки: глюкагона, адреналина, глюкокортикоидов, соматотропного гормона (СТГ) и др. • Ишемия. Снижение кровоснабжения какоголибо участка ткани, как правило, сопровождается увеличением притока крови к тканям по коллатеральным (обходным) сосудам. • Патогенные факторы антигенный природы. Чужеродные антигены активируют иммунные механизмы защиты. Система иммунобиологического надзора с помощью фагоцитов, АТ и/или T-лимфоцитов инактивирует эндо и экзогенные Аг, способные повредить клетки организма. В норме указанные выше и другие системы обеспечивают адекватное реагирование организма в целом на различные воздействия эндо и экзогенного происхождения. В патологии они участвуют в реализации механизмов защиты, компенсации и восстановлении повреждённых структур и нарушенных функций клеток, органов и тканей. ПОВЫШЕНИЕ УСТОЙЧИВОСТИ КЛЕТОК К ПОВРЕЖДЕНИЮ Мероприятия и средства активного повышения устойчивости интактных клеток к действию патогенных факторов и стимуляции адаптивных механизмов при повреждении клеток приведены на рис. 4–27. 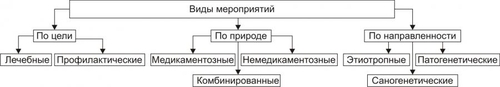 Рис. 4–27. Мероприятия по снижению степени (устранению) повреждения клеток. ПРОФИЛАКТИЧЕСКИЕ И ЛЕЧЕБНЫЕ МЕРОПРИЯТИЯ Агенты, имеющие целью защиту интактных клеток от повреждения (профилактические) или стимуляцию адаптивных механизмов при их альтерации (лечебные), подразделяют на немедикаментозные, медикаментозные и комбинированные. НЕМЕДИКАМЕНТОЗНЫЕ АГЕНТЫ Немедикаментозные средства применяют главным образом с целью профилактики повреждения клетки. Немедикаментозные средства повышают устойчивость клеток органов и тканей, а также организма в целом к ряду патогенных агентов. Пример Тренировка организма (по определённой схеме) умеренной гипоксией, стрессорными факторами, физическими нагрузками и охлаждением увеличивает резистентность к значительной гипоксии, ишемии, холоду, инфекционным агентам, ионизирующей радиации и другим агентам. В связи с этим тренировку указанными и иными воздействиями применяют для профилактики повреждений клеток при различных болезнях, а также — как один из методов стимуляции репаративных процессов. В основе увеличения резистентности клеток при тренировке лежит повышение надёжности и мощности регулирующих систем, механизмов энергетического и пластического обеспечения клеток, их компенсаторных, восстановительных и защитных реакций, репарации ДНК, механизмов синтеза белков, процессов формирования субклеточных структур и других изменений, обеспечивающих повышение резистентности клеток к повреждающим агентам. МЕДИКАМЕНТОЗНЫЕ СРЕДСТВА Лекарственные средства (ЛС) применяют в основном для активации адаптивных механизмов после воздействия патогенного агента. Большинство ЛС применяется с целью этиотропной или патогенетической терапии. К числу основных воздействий, имеющих целью уменьшить силу патогенного действия на клетки и/или блокировать механизм развития патологического процесса, относят: • снижение степени или устранение нарушений процессов энергетического обеспечения клеток; • защиту их мембранного аппарата и ферментов; • коррекцию и защиту механизмов трансмембранного переноса, внутриклеточного распределения ионов и контроля объёма клеток; • предотвращение повреждения генетического аппарата клетки; • коррекцию механизмов регуляции и интеграции внутриклеточных процессов. КОМБИНИРОВАННЫЕ ВОЗДЕЙСТВИЯ Комбинированные воздействия дают наибольший эффект: как лечебный, так и профилактический. ЭТИОТРОПНЫЕ, САНОГЕНЕТИЧЕСКИЕ И ПАТОГЕНЕТИЧЕСКИЕ ВОЗДЕЙСТВИЯ Этиотропные воздействия направлены на устранение, прекращение, уменьшение силы и/или длительности действия патогенных факторов на клетки, а также устранение условий, способствующих реализации этого действия. Саногенетические мероприятия имеют целью активацию адаптивных механизмов (компенсации, защиты, восстановления и приспособления клеток) к изменившимся условиям. Патогенетические воздействия направлены на разрыв звеньев механизма развития (патогенеза) патологического процесса. ПРИНЦИПЫ ПАТОГЕНЕТИЧЕСКОЙ ТЕРАПИИ Принципы патогенетической терапии направлены на коррекцию и защиту механизмов энергоснабжения клеток, защиту их мембран и ферментов, коррекцию и защиту механизмов трансмембранного переноса, внутриклеточного распределения ионов и контроля объёма клеток, а также на предотвращение действия факторов, вызывающих изменения в генетическом аппарате клеток и коррекцию регуляторных влияний на клетки. КОРРЕКЦИЯ И ЗАЩИТА МЕХАНИЗМОВ ЭНЕРГОСНАБЖЕНИЯ КЛЕТОК Принципы, цели и примеры мероприятий по коррекции и защите механизмов энергоснабжения клеток при их альтерации приведены в табл. 4–4. • увеличение транспорта в клетки и усвоения ими кислорода и субстратов биологического окисления (например, вещества, вызывающие расширение артериол, антигипоксанты, препараты, облегчающие трансмембранный перенос субстратов). • защиту и активацию механизмов ресинтеза, внутриклеточного транспорта и усвоения энергии АТФ (например, антиоксиданты, мембраностабилизаторы, средства, стимулирующие метаболические процессы). • снижение расхода энергии в клетках (например, средства, понижающие функциональную активность клеток или нагрузку на них, нейромедиаторы или блокаторы их действия, пептиды, ингибиторы активности кальциевых каналов). Таблица 4–4. Принципы коррекции и защиты механизмов энергетического обеспечения клеток при их повреждении
ЗАЩИТА МЕМБРАН И ФЕРМЕНТОВ КЛЕТОК Цели воздействий и примеры лекарственных средств для защиты мембран и ферментов клеток даны в табл. 4–5. • снижение интенсивности свободнорадикальных и перекисных реакций (антиоксиданты); • стабилизацию мембран лизосом и предотвращение выхода из них гидролитических ферментов и активацию их (мембраностабилизирующие препараты); • торможение активности гидролаз, разрушающих фосфолипиды и белки мембран (например, антиадренергические средства, ингибиторы кальциевых каналов и другие ЛС, прямо или опосредованно препятствующие активации гидролаз). Таблица 4–5. Защита мембран и ферментов клеток при повреждении
КОРРЕКЦИЯ И ЗАЩИТА МЕХАНИЗМОВ ТРАНСМЕМБРАННОГО ПЕРЕНОСА, ВНУТРИКЛЕТОЧНОГО РАСПРЕДЕЛЕНИЯ ИОНОВ И КОНТРОЛЯ ОБЪЁМА КЛЕТОК Цели, примеры мероприятий и групп лекарственных средств, применяемых для коррекции и защиты механизмов обмена ионов и жидкости приведены в табл. 4-6. Для достижения этой цели применяют: • ЛС, регулирующие транспорт ионов через клеточные мембраны (например, ингибиторы кальциевых каналов, регуляторы транспорта Na+, K+ и др.); • ЛС, влияющие на активность Na+,K+АТФазы (например, синтетические аналоги альдостерона, препараты строфантина); • мембраностабилизаторы (например, хинидина сульфат, новокаинамид, глюкокортикоиды, производные фенотиазина, лидокаин); • буферные растворы (например, бикарбонатный). • осмотически активные растворы (например, маннитол, глюкоза, хлориды натрия или калия). Устранение дисбаланса ионов в клетке, как правило, сопровождается нормализацией содержания в ней воды и не требует специального лечения. Однако, при ряде заболеваний необходимы ЛС, уменьшающие общее содержание жидкости в организме, и в том числе внутриклеточной, например мочегонные средства (табл. 4–6). Таблица 4–6. Принципы коррекции и защиты механизмов транспорта ионов и контроля объёма клеток
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
