Патфиз ч.1. Патфиз ч. Гл. 1 Введение в предмет Гл. 2 Общая нозология
 Скачать 9.21 Mb. Скачать 9.21 Mb.
|
|
Ядерные рецепторы — белки-рецепторы стероидных гормонов (минерало- и глюкокортикоиды, эстрогены, прогестерон, тестостерон), ретиноидов, тиреоидных гормонов, жёлчных кислот, витамина D3. Каждый рецептор имеет область связывания лиганда и участок, взаимодействующий со специфическими последовательностями ДНК. Другими словами, ядерные рецепторы — активируемые лигандом факторы транскрипции. Сиротские рецепторы. В геноме человека имеется более 30 ядерных рецепторов, лиганды которых находятся на стадии идентификации. Вторые посредники Внутриклеточные сигнальные молекулы (вторые посредники) передают информацию с мембранных рецепторов на эффекторы (исполнительные молекулы), опосредующие ответ клетки на сигнал. Стимулы, такие как свет, молекулы различных веществ, гормоны и другие химические сигналы (лиганды) инициируют ответ клетки–мишени, изменяя в ней уровень внутриклеточных (вторых) посредников. Вторые посредники представлены многочисленным классом соединений. К ним относятся циклические нуклеотиды (цАМФ и цГМФ), инозитолтрифосфат, диацилглицерол, Ca2+. Ответы клеток–мишеней Функции клеток являются следствием реализации генетической информации (например, транскрипция, посттрансляционная модификация) и крайне разнообразны (например, изменения характера функционирования, стимуляция или подавление активности, перепрограммирование синтезов и т.д.). РАССТРОЙСТВА ВЗАИМОДЕЙСТВИЯ БАВ С РЕЦЕПТОРАМИ Межклеточные сигналы в виде БАВ информационного характера (гормоны, нейромедиаторы, цитокины, хемокины и др.) реализуют регуляторные эффекты после взаимодействия БАВ с клеточными рецепторами. Причины искажения регуляторного сигнала многообразны. Наибольшее значение имеют: • изменение чувствительности рецепторов; • отклонения количества рецепторов; • нарушения конформации рецепторных макромолекул; • изменения липидного окружения мембранных рецепторов. Указанные отклонения могут существенно модифицировать характер клеточного ответа на регулирующий стимул. Так, накопление токсичных продуктов СПОЛ при ишемии миокарда изменяет физикохимические свойства мембран. Это сопровождается нарушением реакций сердца на норадреналин и ацетилхолин, воспринимающихся соответствующими рецепторами плазматической мембраны кардиомиоцитов. РАССТРОЙСТВА НА УРОВНЕ ВТОРЫХ ПОСРЕДНИКОВ На уровне внутриклеточных вторых посредников (мессенджеров) — циклических нуклеотидов: аденозинмонофосфата (цАМФ) и гуанозинмонофосфата (цГМФ) и других, образующихся в ответ на действие первых посредников — гормонов и нейромедиаторов, возможны многочисленные расстройства. Примером может служить нарушение формирования МП в кардиомиоцитах при накоплении в них избытка цАМФ. Это является одной из возможных причин развития сердечных аритмий. РАССТРОЙСТВА НА УРОВНЕ ОТВЕТА НА СИГНАЛ На уровне метаболических процессов, регулируемых вторыми посредниками или другими внутриклеточными факторами, также возможны многочисленные расстройства. Так, нарушение активации клеточных ферментов, например в связи с дефицитом цАМФ или цГМФ, может существенно изменить интенсивность метаболических реакций и как следствие — привести к расстройству жизнедеятельности клетки. ТИПОВЫЕ ФОРМЫ ПАТОЛОГИИ Повреждение клеток характеризуется развитием разнообразных изменений не только в поражённых клетках, но и в других гистологических элементах, составляющих ткани, органы и их системы. К типовым формам патологии клеток относят дистрофии, дисплазии, некроз, патологические формы апоптоза, нарушения отдельных субклеточных структур и компонентов. ДИСТРОФИИ Клеточные дистрофии — нарушения обмена веществ, сопровождающиеся расстройством функций клеток, пластических процессов в них, а также структурными изменениями, ведущими к нарушению жизнедеятельности клеток. Механизмы дистрофий разнообразны. К числу ведущих относятся следующие: • синтез аномальных, в норме не встречающихся в клетке, веществ (например, белковополисахаридного комплекса — амилоида); • избыточное превращение одних соединений в другие (например, жиров и углеводов в белки, углеводов в жиры); • декомпозиция (фанероз): распад субклеточных структур и/или веществ (например, белковолипидных комплексов мембран); • инфильтрация клеток и межклеточного вещества органическими и неорганическими соединениями (например, ЛПНП и Ca2+ клеток интимы артерий при атеросклерозе). ВИДЫ КЛЕТОЧНЫХ ДИСТРОФИЙ Виды клеточных дистрофий приведены на рис. 4–13. 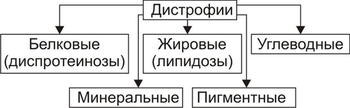 Рис. 4–13. Виды дистрофий в зависимости от преимущественно нарушенного типа обмена веществ. Основным критерием классификации клеточных дистрофий является преимущественное нарушение метаболизма отдельных классов веществ. Согласно этому, различают диспротеинозы (белковые дистрофии), липидозы (жировые дистрофии), диспигментозы (пигментные дистрофии), углеводные и минеральные дистрофии. Отдельную группу составляют тезаурисмозы (болезни накопления). ДИСПРОТЕИНОЗЫ Для белковых дистрофий характерно изменение физикохимических свойств клеточных белков и как следствие — нарушение их ферментативной и структурной функций. Выделяют зернистую, гиалиновокапельную и гидропическую дистрофии. Эти разновидности диспротеинозов — последовательные этапы нарушений обмена белков, нередко приводящие к некрозу клеток. Чаще диспротеинозы являются приобретёнными (вторичными). Реже встречаются первичные (наследуемые и врождённые) их варианты. Обычно эти последние — результат ферментопатий и обусловлены нарушениями обмена аминокислот, например цистеина (цистиноз), фенилпировиноградной кислоты (фенилкетонурия), тирозина (тирозиноз) и некоторых других. ЗЕРНИСТАЯ ДИСТРОФИЯ При зернистой дистрофии в цитоплазме появляются гранулы (зёрна) белка вследствие его инфильтрации (проникновения) из межклеточной жидкости, превращения углеводов и жиров в белки, распада ЛП цитоплазмы и мембран и нарушений энергообеспечения клеток. ГИАЛИНОВАЯ ДИСТРОФИЯ Гиалиновая дистрофия характеризуется накоплением в цитозоле белковых гиалиноподобных ацидофильных включений — «капель» (отсюда другое название этой разновидности дистрофии — «гиалиновокапельная»). Одновременно с этим появляются признаки деструкции клеточных органелл. Причина гиалиновой дистрофии — значительное повышение проницаемости клеточных мембран. ГИДРОПИЧЕСКАЯ ДИСТРОФИЯ Гидропическая (водяночная, вакуольная) дистрофия в виде наполненных жидкостью вакуолей, набухания органелл и других признаков внутриклеточного отёка развивается при повышении онкотического давления в клетке и избыточной гидратации белковых мицелл. Наиболее часто гидропическая дистрофия наблюдается при воздействии гипоксии, ионизирующей радиации, микробных и паразитарных токсинов. ЛИПИДОЗЫ К липидам относят различные по химическому составу гидрофобные вещества (рис. 4–14). 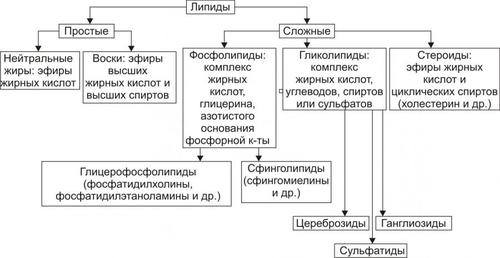 Рис. 4–14. Виды липидов. Для липидозов (жировых дистрофий) характерно увеличение содержания внутриклеточных липидов, появление липидов в клетках, где они в норме отсутствуют, а также образование липидов аномального химического состава. Различают липидозы первичные (наблюдаются, как правило, при ферментопатиях: ганглиозидлипидоз, цереброзидлипидоз, сфингомиелинлипидоз и др.) и вторичные (вызванные различными патогенными факторами: этанолом, соединениями фосфора, четырёххлористым углеродом, некоторыми ЛС — цитостатиками, антибиотиками, барбитуратами и др.). Вторичные липидозы, подобно диспротеинозам, наиболее часто выявляются в клетках миокарда, печени, почек, мозга и носят соответствующие названия (жировая дистрофия сердца, печени, почек, мозга). УГЛЕВОДНЫЕ ДИСТРОФИИ Углеводные дистрофии характеризуются нарушениями обмена полисахаридов (гликогена, мукополисахаридов) и гликопротеинов (муцина, мукоидов). ПОЛИСАХАРИДЫ При нарушениях метаболизма полисахаридов в клетках можно наблюдать уменьшение содержания углеводов (например, гликогена при СД), отсутствие углеводов (агликогенозы) и накопление избытка углеводов (например, гликогенная инфильтрация клеток, гликогенозы). Причины этих дистрофий: эндокринопатии (например, инсулиновая недостаточность) и ферментопатии (отсутствие или низкая активность ферментов, принимающих участие в синтезе и распаде углеводов). ГЛИКОПРОТЕИНЫ Углеводные дистрофии, связанные с нарушением метаболизма гликопротеинов, характеризуются, как правило, накоплением муцинов и мукоидов, имеющих слизистую консистенцию (в связи с этим их называют также слизистыми дистрофиями). Причины: эндокринные расстройства (например, недостаточная продукция или низкая активность гормонов щитовидной железы) и прямое повреждение клеток различными патогенными факторами. ДИСПИГМЕНТОЗЫ Клеточные пигменты — хромопротеиды — соединения, состоящие из белка и хромофора. ВИДЫ ПИГМЕНТОВ • гемоглобиногенные, или железозависимые (ферритин, гемосидерин, билирубин, гематоидин, гематин, порфирин); • протеиногенные, или тирозиногенные (меланин, адренохром, пигменты охроноза и энтерохромаффинных клеток); • липидогенные, или липопротеиногенные (липофусцин, гемофусцин, цероид, липохромы). ВИДЫ ДИСПИГМЕНТОЗОВ Пигментные дистрофии (диспигментозы) классифицируют в зависимости от их происхождения, механизма развития, структуры пигмента, проявлений и распространённости (табл. 4–3). Таблица 4–3. Виды пигментных дистрофий
ГРУППЫ ДИСПИГМЕНТОЗОВ • Гемоглобиногенные (железозависимые) диспигментозы: гемосидероз. гемохроматоз, гемомеланоз, порфирии, а также накопление избытка прямого билирубина в гепатоцитах. † Большинство гемоглобиногенных пигментов относятся к продуктам катаболизма Hb. Некоторые из них (ферритин, гемосидерин) образуются с участием железа, всасывающегося в кишечнике. † Наиболее частыми из гемоглобиногенных диспигментозов являются: гемохроматоз и порфирия. • Протеиногенные (тирозиногенные) диспигментозы проявляются усилением или ослаблением пигментации тканей локального или общего характера продуктами метаболизма тирозина. † Усиление пигментации: меланоз и охроноз. † Ослабление пигментации тканей или отсутствие пигмента в их клетках: альбинизм. • Липидогенные диспигментозы характеризуются увеличением количества в клетках пигментов липидного и липопротеидного характера: липофусцинозы. МИНЕРАЛЬНЫЕ ДИСТРОФИИ Из минеральных дистрофий наибольшее значение имеют нарушения обмена кальция, калия, железа, цинка, меди в виде отложения солей этих химических элементов (например, кальцинозы, сидерозы, отложение меди при гепатоцеребральной дистрофии). ТЕЗАУРИСМОЗЫ Тезаурисмозы (болезни накопления) — накопление избытка различных веществ в клетках, что сопровождается нарушением их структуры и функции, а также — интенсивности и характера метаболических и пластических клеточных процессов. Практически все тезаурисмозы — результат наследственных ферментопатий, передающихся, как правило, по аутосомнорецессивному типу. В отдельные группы принято выделять болезни накопления лизосомные и пероксисомные. В зависимости от типа накапливающихся веществ тезаурисмозы подразделяют на липидные (липидозы), гликогеновые (гликогенозы), аминокислотные, нуклеопротеиновые, мукополисахаридные (мукополисахаридозы), муколипидные (муколипидозы). Наиболее распространёнными разновидностями тезаурисмозов являются липидные и гликогеновые. ДИСПЛАЗИИ
Дифференцировка клеток определяется генетической программой, но реализация этой программы в существенней мере зависит от сложных взаимодействий ядра и цитоплазмы, микроокружения клетки, влияния на клетку БАВ и многих других факторов. Именно поэтому, даже при одном и том же отклонении в геноме различных клеток, проявления дисплазий могут носить «разноликий» характер. Среди дисплазий выделяют метаплазии, характеризующиеся замещением в конкретном органе характерных для него клеток клетками другого типа. Существенно, что клеточные дисплазии лежат в основе опухолевого роста и в клинической практике рассматриваются как предраковые состояния Как правило, при дисплазиях клетки увеличены в размерах, имеют неправильную, причудливую форму ("клеткимонстры"), соотношение различных органелл в них диспропорционально. Нередко в таких клетках обнаруживаются различные включения и признаки дистрофических процессов. ПРИМЕРЫ ДИСПЛАЗИЙ • Образование мегалобластов в костном мозге при витамин B12дефицитной анемии. • Появление серповидных эритроцитов при патологии Hb. • Наличие крупных «нейронов–монстров» при поражении коры головного мозга (туберозный склероз). • Образование многоядерных гигантских клеток со своеобразным расположением хроматина при болезни Реклингхаузена. ПРИМЕРЫ МЕТАПЛАЗИИ • Хронические воспалительные заболевания лёгких, а также дефицит витамина А, курение приводят к появлению в однослойном мерцательном эпителии бронхов островков многослойного плоского эпителия. • Фиброзно-кистозная болезнь молочной железы. В грудной железе возможно появление клеток, характерных для апокриновых потовых желёз. • Хронический цервицит. Возможно замещение цилиндрического эпителия многослойным плоским. • Берретта пищевод. В результате рефлюкса кислого содержимого желудка многослойный плоский эпителий слизистой оболочки пищевода замещается однослойным эпителием, характерным для тонкой кишки. • Оссифицирующий миозит. Скелетные мышечные волокна замещаются фиброзной тканью, содержащей очаги костной ткани. • Гетеротопная оссификация возможна в рубцовой ткани (например, в лёгком). ГИБЕЛЬ КЛЕТКИ Развитие многоклеточного организма, формирование тканей и их функционирование предполагают наличие баланса между пролиферацией, дифференцировкой и гибелью клеток. Клетки погибают как в физиологических так и патологических условиях. Клетки, выполнившие свои функции, погибают в течение всей жизни организма. Они гибнут при повреждении и некрозе ткани, а также при различных заболеваниях, поражающих отдельные типы клеток (дегенерация). Известно два качественно различных варианта смерти клеток: некроз и апоптоз (рис. 4–15). 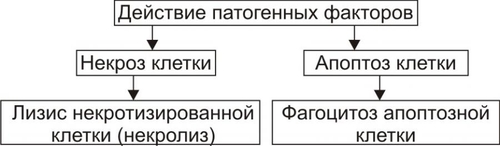 Рис. 4–15. Виды гибели клеток и механизмы их разрушения. НЕКРОЗ Некроз — смерть повреждённой клетки, сопровождающаяся необратимым прекращением её жизнедеятельности. Некроз является завершающим этапом клеточных дистрофий или следствием прямого действия на клетку повреждающих факторов значительной (разрушающей) силы. Некроз, как правило, сопровождается воспалительной реакцией. ПАРАНЕКРОЗ И НЕКРОБИОЗ Некрозу предшествуют паранекроз (метаболические и структурные изменения ещё обратимы) и некробиоз. На этапе некробиоза патогенные изменения приобретают необратимый характер и приводят к некрозу. Основные звенья патогенеза некроза те же, что и при повреждении клеток, но при развитии некроза они максимально интенсифицированы и развиваются на фоне недостаточности адаптивных механизмов (защиты и регенерации повреждённых структур, компенсации нарушенных процессов в клетке). ЛИЗИС И АУТОЛИЗ Некротизированные клетки подвергаются деструкции (лизису) при помощи лизосомных ферментов и свободных радикалов. • Гидролиз внутриклеточных компонентов и межклеточного вещества происходит под влиянием ферментов лизосом альтерированных клеток. Высвобождению лизосомных ферментов способствует развитие внутриклеточного ацидоза. • Деструкция повреждённых компонентов клеток осуществляется при участии активных форм кислорода и свободных радикалов. Факты интенсификации свободнорадикальных и липопероксидных реакций описаны при остром воспалении, механическом повреждении, на определённых этапах развития инфаркта (частной формы некроза, развивающегося вследствие нарушения кровоснабжения ткани), опухолевого роста (сопровождается гибелью большого числа как злокачественных, так и окружающих нормальных клеток) и других патологических процессах. Эти два механизма обеспечивают саморазрушение структур клетки (аутолиз). Разрушение повреждённых и некротизированных клеток происходит и при участии других клеток — фагоцитов, а также микроорганизмов. В отличие от аутолитического распада, последний механизм обозначают как гетеролитический. |
