Патфиз ч.1. Патфиз ч. Гл. 1 Введение в предмет Гл. 2 Общая нозология
 Скачать 9.21 Mb. Скачать 9.21 Mb.
|
|
Время начала формирования. Как следует из характеристики механизмов развития изменений в зоне вторичной альтерации, её формирование несколько сдвинуто во времени (секунды–минуты) по сравнению со сроками формирования зоны первичной альтерации. Интенсивность формирования различных зон альтерации, выраженность изменений в них и соотношение их размеров существенно различны и в каждом конкретном случае зависят от причины воспаления, структурных и функциональных особенностей ткани или органа, в котором развивается воспаление, реактивности организма и других условий. Далее анализируются изменения в очаге воспаления. Механизмы, проявления и последствия этих изменений рассмотрены в основном для зоны вторичной альтерации. Это объясняется тем, что при большинстве форм воспаления именно эта зона доминирует как по занимаемой ею площади, так и по своему значению. Именно в этой зоне формируются и реализуются процессы, обеспечивающие локализацию, нейтрализацию, уничтожение и элиминацию флогогенного агента, а также — ликвидацию последствий его патогенного воздействия. СТРУКТУРНЫЕ ИЗМЕНЕНИЯ Причины изменения структуры клеток и других гистологических элементов: • в течение первых минут — прямое действие флогогенного фактора; • на более поздних этапах и дополнительно к прямому эффекту флогогенного фактора — влияние вторичных причин: метаболических, физикохимических, микроциркуляторных и регуляторных расстройств. Основные механизмы морфологических изменений: • нарушения процессов энергетического обеспечения клеток; • повреждение мембранного аппарата и ферментных систем; • дисбаланс ионов и воды; • нарушения местных (клеточных и органнотканевых) механизмов регуляции. Проявления • Развивающиеся в тканях изменения весьма разнообразны: от минимальных структурных отклонений до деструкции и некроза. • Структурные изменения наблюдаются как в паренхиматозных клетках, так и в строме тканей и органов. • Существенную роль в потенцировании повреждения клеточных и неклеточных структур играют высвобождающиеся из лизосом и активирующиеся в очаге воспаления гидролазы: протеазы, липазы, фосфолипазы, эластазы, коллагеназы и другие ферменты. Источником их являются как клетки самой повреждённой ткани, так и находящиеся в ней лейкоциты, а при септическом воспалении — и микроорганизмы. • Для клеток при воспалительной альтерации характерны изменения в цитозоле, а также повреждение плазмолеммы и мембран органелл — митохондрий, лизосом, эндоплазматической сети, комплекса Гольджи и других. В связи с этим меняется их форма, размеры, число, а также функции органелл и клетки в целом. ИЗМЕНЕНИЯ ОБМЕНА ВЕЩЕСТВ В очаге воспаления наблюдаются закономерные фазные изменения метаболизма. Их причины: действие флогогенного фактора и вторичные расстройства в ткани, выражающиеся в перестройке местных механизмов нервной и гуморальной регуляции, микроциркуляции, в формировании физикохимических сдвигов. На начальном этапе воспаления в ткани (не только зоны первичной, но и вторичной альтерации) преобладают реакции катаболизма, затем — при развитии артериальной гиперемии и активации процессов пролиферации, — как правило, начинают доминировать анаболические реакции. Биологический «смысл» изменений метаболизма заключается в энергетическом и пластическом обеспечении местных адаптивных реакций в очаге воспаления, направленных на локализацию, уничтожение и элиминацию флогогенного агента, а также на ликвидацию патогенных последствий его воздействия. УГЛЕВОДЫ В очаге воспаления метаболизм углеводов претерпевает характерные изменения, выражающиеся в преобладании гликолиза и развитии ацидоза. Причины • Повреждения мембранного аппарата и митохондриальных ферментов, возникающие под действием как флогогенного агента, так и других факторов, активирующихся или образующихся в ходе воспалительной реакции вторично. К этим последним относятся свободные радикалы и перекисные соединения, вещества с детергентным действием (ВЖК, гидроперекиси липидов), гидролазы лизосом, избыток Н+ и других агентов. • Избыток Ca2+, оказывающий (наряду с жирными кислотами) существенное разобщающее действие на окислительное фосфорилирование. • Увеличение в клетках уровня АДФ, АМФ и неорганического фосфата. Это активирует ключевые (лимитирующие) ферменты гликогенолиза и гликолиза. В связи с этим в очаге воспаления начинает возрастать удельный вес гликолитического ресинтеза АТФ. Проявления • увеличение поглощения тканью кислорода при одновременном снижении эффективности окисления глюкозы в процессе тканевого дыхания; • активация гликогенолиза и гликолиза; • уменьшение уровня АТФ в ткани; • накопление избытка лактата и пирувата. Последствия • Образующаяся при гликолизе АТФ, хотя и в недостаточной мере, но тем не менее может обеспечить поддержание энергозависимых процессов в клетках, особенно транспорта ионов и сокращения мышц, сохранение жизнеспособности и жизнедеятельности гистологических элементов в очаге воспаления. • Активация гликолиза сопровождается накоплением в клетках и во внеклеточной жидкости избытка промежуточных продуктов этого процесса, в том числе — пировиноградной, молочной и других кислот, что ведёт к формированию метаболического ацидоза. • На начальном этапе воспаления (когда многие митохондрии сохраняют свою структуру, а их ферменты — кинетическую активность) возобновление нормальной или близкой к ней оксигенации тканей сопровождается быстрым восстановлением эффективности тканевого дыхания, снижением интенсивности гликолиза и нормализацией энергетического обеспечения клеточных процессов. ЛИПИДЫ Обмен липидов в очаге воспаления характеризуется доминированием липолиза над реакциями их синтеза. Причины • Прямое повреждающее влияние флогогенного агента может привести к ферментативной и неферментативной деструкции мембранных фосфолипидов, ЛП, гликолипидов и других липидсодержащих соединений с высвобождением из них ВЖК, свободных липидов и образованием кетокислот. • Основной механизм липолиза в очаге воспаления — интенсификация гидролиза липидов и их комплексов с другими веществами в результате повышенного высвобождения липаз и фосфолипаз из повреждённых клеток, а также из лейкоцитов, в большом количестве накапливающихся в очаге воспаления. Помимо увеличения содержания липаз и фосфолипаз, в очаге воспаления отмечается значительное повышение их активности. Последнее связано с тем, что оптимум каталитической активности большинства липаз и фосфолипаз наблюдается в кислой среде. А в очаге воспаления, как известно, быстро развивается метаболический ацидоз. • Активация деструкции липидов за счёт интенсификации реакций свободнорадикального перекисного окисления липидов. В очаге воспаления усиление липопероксидных процессов связано со снижением активности антиоксидантных ферментов, увеличением содержания прооксидантных агентов (катехоламинов, гистамина, серотонина; ионов железа, высвобождающихся при разрушении миоглобина, Hb, кининов и других), а также повышением уровня субстратов перекисного окисления липидов, главным образом полиненасыщенных ВЖК: арахидоновой, линоленовой и других. Активация липопероксидации сопровождается образованием и накоплением избытка неметаболизируемых соединений (в частности гидроперекисей липидов), обладающих выраженным разрушающим эффектом в отношении органических соединений. Проявления • Активация процессов липолиза и накопление продуктов липолиза • Торможение реакций синтеза липидов • Активация перекисного окисления липидов и накопление перекисей и гидроперекисей липидов Последствия Последствия изменённого метаболизма липидов в очаге воспаления перечислены на рис. 5–4) и подробнее рассмотрены ниже. 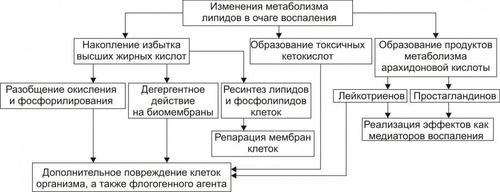 Рис. 5–4. Изменения метаболизма липидов в очаге воспаления. • Активация лизосомальных, а также мембраносвязанных липаз и фосфолипаз приводит к отщеплению от липидов ВЖК и их накоплению. Последние оказывают в очаге воспаления существенный разобщающий эффект и снижают эффективность тканевого дыхания в митохондриях. • Детергентное (разрушающее) действие ВЖК на клеточные мембраны сопровождается образованием сквозных каналов в мембранах и нерегулируемым транспортом по ним ионов, молекул органических и неорганических соединений, как в клетку, так и из неё, что завершается, как правило, гибелью клетки. • Накопление избытка токсичных кетокислот (ацетоуксусной, • Повреждение вышеуказанными факторами не только клеток организма, но и самого флогогенного агента, если в его состав входят липиды. • Использование ВЖК для синтеза фосфолипидов мембран и ресинтеза цитоплазматических липидов. ВЖК при этом остаётся одним из основных энергоёмких субстратов биологического окисления. • В ходе метаболизма арахидоновой кислоты образуются Пг и лейкотриены, обладающие многими регуляторными эффектами. БЕЛКИ Обмен белков характеризуется преобладанием протеолиза над процессами протеосинтеза. Главные причины • Прямое патогенное действие флогогенного агента, в том числе ферментативный протеолиз. • Массированное выделение из повреждённых паренхиматозных и стромальных клеток, а также из лейкоцитов протеолитических ферментов. Их активность значительна, так как каталитический оптимум большинства протеаз находится в кислом диапазоне рН (в очаге воспаления — метаболический ацидоз). • Активация свободнорадикальных и перекисных реакций, сопровождающихся деструкцией ЛП и высвобождением из них белковых соединений, которые разрушаются и/или денатурируются. Проявления • Активация процессов протеолиза и накопление продуктов протеолиза. • Торможение реакций протеосинтеза. • Денатурация молекул белка (образование аутоантигенов). Последствия В очаге воспаления вследствие интенсификации реакций протеолиза и денатурации белков развиваются следующие процессы (рис. 5–5). 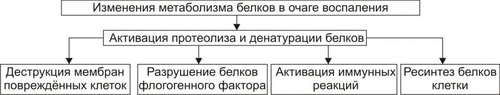 Рис. 5–5. Изменения метаболизма белков в очаге воспаления. • Деструкция мембран клеток, повреждённых флогогенным фактором. • Разрушение белковых структур и клеток флогогенного агента, когда им являются микроорганизмы, одно и многоклеточные паразиты, а также — белоксодержащие факторы (вирусы, АТ, комплексы АгАТ, токсины и другие соединения). • Активация иммунных (в том числе — иммунопатологических) реакций в связи с денатурацией белков как собственных погибших клеток, так и флогогенного агента. Включение клеточных и гуморальных механизмов иммунитета обеспечивает обнаружение, деструкцию и элиминацию антигенно чужеродных структур. • Продукты протеолиза служат субстратом синтеза новых клеточных компонентов взамен повреждённых. ИОНЫ И ВОДА Для ионов и воды характерен трансмембранный дисбаланс ионов, увеличение внутриклеточного содержания Na+ и Ca2+ и внеклеточного содержания K+ и Mg2+, гипергидратация клеток и отёк ткани в очаге воспаления. Главные причины • Прямое повреждающее действие флогогенного агента на мембраны клеток. • Нарушения энергетического обеспечения селективного переноса катионов. • Расстройства работы ионообменных механизмов (Н+Ca2+, Na+Ca2+, H+K+). • Снижение кинетической активности катионзависимых мембранных АТФаз (Na+,K+АТФазы, Ca2+,Mg2+АТФазы). • Нарушения физикохимического состояния и микроструктуры клеточных мембран. Последнее проявляется: † фазным увеличением или снижением степени «жёсткости», а следовательно, и проницаемости мембран для ионов; † дефектами цитоскелета (микрофиламенты, микротрубочки, промежуточные нити, связанные со структурными элементами клеточных мембран). † Образованием микроразрывов (микробрешей, простейших транспортных каналов) в плазмолемме и мембранах клеточных органелл. В совокупности эти изменения сопровождаются потерей клеткой K+, Mg2+, ряда микроэлементов и увеличением их концентрации на внешней поверхности клеточной мембраны. Одновременно с этим повышается внутриклеточное содержание Na+ и Ca2+, а также воды. Проявления • Нарушения распределения ионов по обе стороны плазмолеммы. При этом происходит потеря клеткой K+, Mg2+, микроэлементов и накопление их в межклеточной жидкости. В клетку же поступают Na+, Ca2+ и некоторые другие ионы. • Нарушения соотношения между отдельными ионами как в клетке, так и вне клетки в результате расстройства механизмов трансмембранного переноса ионов. • Гипергидратация ткани в очаге воспаления в связи с высокой гидрофильностью накапливающихся в нём Na+ и Ca2+, а также продуктов гидролиза органических соединений. • Высвобождение дополнительного количества катионов (K+, Na+, Ca2+, железа, цинка) при гидролизе солей, распаде гликогена, белков и других органических соединений, а также — клеточных мембран. • Выход большого количества Ca2+ из повреждённых внутриклеточных депо (например, митохондрий и цистерн эндоплазматической сети и митохондрий). Последствия • Значительное увеличение осмотического давления внутри клеток, набухание клеток и их органелл, перерастяжение и разрыв мембран и в конце концов — гибель клеток. • Расстройства формирования МП и ПД, стойкая деполяризация мембран возбудимых клеток (в особенности кардиомиоцитов), сочетающаяся со снижением их функций и болевой чувствительности в центре очага воспаления (в зоне первичной альтерации). По периферии воспалённой ткани (в зоне вторичной альтерации), как правило, регистрируются более или менее сниженный уровень деполяризации мембран, повышенная возбудимость клеток и высокая болевая чувствительность. Названные выше механизмы дисбаланса ионов и воды действуют не только на клетки организма, но и на флогогенный фактор, что может привести к его повреждению. Расстройства обмена веществ сопровождаются существенными и закономерными физикохимическими сдвигами в очаге воспаления. ФИЗИКОХИМИЧЕСКИЕ ИЗМЕНЕНИЯ Основные физикохимические изменения в очаге воспаления приведены на рис. 5–6. 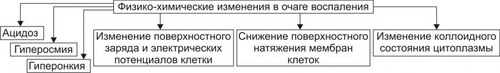 Рис. 5–6. Физикохимические изменения в очаге воспаления. АЦИДОЗ Воспалительная реакция характеризуется увеличением [Н+] и, соответственно, снижением рН в клетках и межклеточной жидкости — развитием ацидоза. Причина Причина метаболического ацидоза — накопление в очаге воспаления избытка недоокисленных соединений. Механизмы развития метаболического ацидоза • Образование большого количества «кислых» продуктов изменённого метаболизма вследствие: † активации гликолиза, что сопровождается накоплением избытка молочной и пировиноградной кислот † усиления протеолиза и липолиза с накоплением аминокислот, ВЖК и КТ. • Нарушение оттока из очага воспаления продуктов как нормального, так и нарушенного обмена веществ. Последнее особенно выражено в связи с замедлением оттока венозной крови и развитием стаза в очаге воспаления. • «Истощение» щелочных буферных систем (бикарбонатной, фосфатной, белковой и других) клеток и межклеточной жидкости, которые на начальном этапе воспаления нейтрализуют избыток кислых соединений. Особенности изменения [Н+] в очаге воспаления • Чем острее протекает воспаление, тем более выражен ацидоз: из компенсированного он быстро трансформируется в некомпенсированный. • Как правило, [Н+] наибольшая в зоне первичной альтерации, она меньше в прилегающей к ней зоне вторичной альтерации и постепенно снижается по направлению к неповреждённой ткани. • В отдельных участках интенсивной деструкции и аутолиза тканей, где накапливаются восстановленные органические и неорганические соединения, продукты промежуточного белкового распада (аммиак и его производные), может развиваться более или менее выраженный преходящий алкалоз. Однако, в целом для очага воспаления характерен ацидоз. Последствия ацидоза Последствия метаболического ацидоза в очаге воспаления приведены на рис. 5–7. 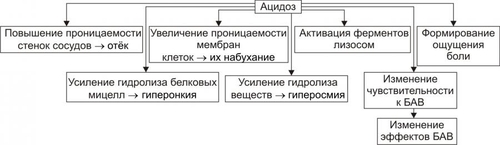 Рис. 5–7. Эффекты ацидоза в очаге воспаления. • Повышение проницаемости клеточных мембран, в том числе плазмолеммы и лизосом приводит к выходу гидролаз в цитозоль и межклеточное вещество. • Активация лизосомальных ферментов сопровождается усилением деструкции клеточных и неклеточных структур в очаге воспаления. • Повышение проницаемости стенок сосудов за счёт усиления неферментного и ферментного гидролиза компонентов межклеточного матрикса, включая базальные мембраны. • Формирование ощущения боли в очаге воспаления в связи с раздражением и повреждением чувствительных нервных окончаний в условиях избытка Н+. • Усиление гидролиза солей и органических соединений ведёт к повышению осмотического и онкотического давления, изменяет коллоидное состояние цитозоля. • Изменения чувствительности рецепторных структур клеток (в том числе — стенок микрососудов) к регуляторным факторам (гормонам, нейромедиаторам, другим БАВ) сопровождаются нарушениями регуляции тонуса сосудистой стенки. Так, на стадии альтерации в очаге воспаления, как правило, снижается чувствительность рецепторов к адреномиметикам (в частности, к норадреналину) и повышается к холиномиметическим агентам. |
