Патфиз ч.1. Патфиз ч. Гл. 1 Введение в предмет Гл. 2 Общая нозология
 Скачать 9.21 Mb. Скачать 9.21 Mb.
|
|
СТАЗ Стаз характеризуется дискоординированным изменением тонуса стенок микрососудов и, как следствие — прекращением тока крови и лимфы в очаге воспаления. Длительный стаз ведёт к развитию дистрофических изменений в ткани и гибели отдельных её участков. Стаз подробно рассмотрен в разделе «Нарушения регионарного кровотока» главы 22 «Патофизиология сердечнососудистой системы», в том числе на рисунках 22–52, 22–53 и в сопровождающем эти рисунки тексте. ЗНАЧЕНИЕ И ПОСЛЕДСТВИЯ ВЕНОЗНОЙ ГИПЕРЕМИИ И СТАЗА Значение венозной гиперемии и стаза в очаге воспаления состоит в изоляции очага повреждения (благодаря препятствию оттоку крови и лимфы из него и, тем самым, содержащихся в них микробов, токсинов, продуктов метаболизма, ионов, БАВ и других агентов, способных повредить другие ткани и органы организма). При венозной гиперемии и стазе происходят дальнейшие расстройства специфической и неспецифической функций тканей, дистрофические и структурные изменения в них вплоть до некроза. Повышение проницаемости стенок микрососудов способствует образованию экссудата. ЭКССУДАЦИЯ ПЛАЗМЫ И ВЫХОД ФОРМЕННЫХ ЭЛЕМЕНТОВ КРОВИ Артериальная и венозная гиперемия, стаз и повышение проницаемости стенок микрососудов в очаге воспаления сопровождаются выходом плазмы, а также форменных элементов крови из микрососудов в ткани и/или полости тела с образованием экссудата (рис. 5–15). 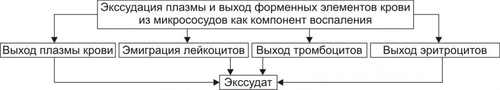 Рис. 5–15. Формирование экссудата в очаге воспаления. ЭКССУДАЦИЯ Процесс экссудации начинается вскоре после действия повреждающего фактора на ткань и продолжается до начала репаративных реакций в очаге воспаления.
Причины экссудации Основная причина экссудации — увеличение проницаемости стенок микрососудов вследствие множества процессов, повреждающих их стенку и перечисленных на рис. 5–16 (см. также рис. 22–54 и сопровождающий рисунок текст). 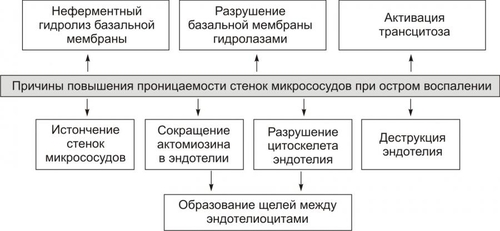 Рис. 5–16. Причины повышения проницаемости стенок микрососудов при остром воспалении. Среди процессов, повреждающих стенку сосуда в очаге воспаления, доминируют нижеперечисленные. • Усиление неферментного гидролиза компонентов базальной мембраны микрососудов в условиях ацидоза; • Повреждение клеток эндотелия и базальной мембраны стенок микрососудов: † факторами лейкоцитов (гидролитические ферменты лизосом, активные формы кислорода, пероксинитрит). † внеклеточными агентами очага воспаления (гидроперекиси липидов, токсины микробов, токсичные метаболиты повреждённых и/или погибших клеток, мембраноатакующий комплекс системы комплемента). • Перерастяжение и — в связи с этим — истончение стенки сосудов (особенно — венул) вследствие их полнокровия. • Сокращение актиновых нитей и их разрушение, а также разрушение других элементов цитоскелета эндотелиоцитов с их округлением и появлением между ними промежутков, в норме отсутствующих. • Активация механизма трансэндотелиального переноса жидкости («трансцитоза») из просвета микрососуда в интерстиций, что осуществляется путём пиноцитоза с последующим экзоцитозом пиноцитозных пузырьков. Факторы потенциации Существует группа факторов, потенцирующих образование экссудата • Увеличение перфузионного давления (усиливает фильтрацию жидкости через сосудистую стенку). • Возрастание площади экссудации (в результате растяжения стенок микрососудов). • Повышение проницаемости базальной мембраны сосудов (под влиянием медиаторов воспаления). • Увеличение осмотического и онкотического давления в очаге воспаления. • Усиление трансцитоза • Снижение эффективности резорбции жидкости в посткапиллярном отделе сосудов микроциркуляторного русла. Виды экссудата Выделяют три основных типа экссудата: серозный, фибринозный и гнойный. В зависимости от наличия клеток, их типа, химического состава в экссудате различают также геморрагический и гнилостный его разновидности. Серозный экссудат состоит из полупрозрачной жидкости, богатой белком (до 2–3%), и немногочисленных клеток, в том числе форменных элементов крови. Фибринозный экссудат содержит большое количество фибриногена и фибрина. Гнойный экссудат — мутная густая жидкость, содержащая до 6–8% белка и большое количество различных форм лейкоцитов, микроорганизмов, погибших клеток повреждённой ткани. Геморрагический экссудат содержит большое количество белка и эритроцитов, а также другие форменные элементы крови. Гнилостный экссудат. Любой вид экссудата может приобрести гнилостный (ихорозный) характер при внедрении в очаг воспаления гнилостной микрофлоры (анаэробы). Смешанные формы экссудата могут быть самыми разнообразными (например, серознофибринозный, гнойнофибринозный, гнойногеморрагический и др.). Состав и диагностическое значение экссудата Клеточный и химический состав экссудата имеет определённое диагностическое значение и зависит от причины воспаления, ткани, в котором развивается воспаление, реактивности организма и ряда других факторов. Примеры: • при воспалении инфекционноаллергической природы в экссудате обнаруживается большое количество лимфо и моноцитов, а также высокий уровень глобулинов; • при воспалении, вызванном паразитами, в экссудате доминируют эозинофилы и содержится много глобулинов; • при остром воспалении, причиной которого являются микробы, в экссудате обнаруживается большое число нейтрофилов и альбуминов. Значение экссудации В очаге воспаления значение процесса экссудации имеют двоякое биологическое значение: адаптивное и патогенное (рис. 5–17). 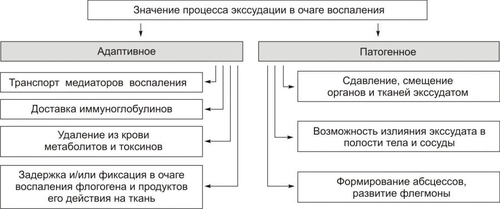 Рис. 5–17. Значение процесса экссудации в очаге воспаления. • Адаптивное значение экссудации и экссудата заключается в: † Транспорте с жидкой частью крови в ткань плазменных медиаторов воспаления: кининов, факторов комплемента и факторов системы гемостаза. † Доставке в очаг воспаления Ig, а также других агентов, способствующих альтерации или уничтожению микроорганизмов, повреждённых клеток и неклеточных структур тканей. † Удалении из крови в ткань продуктов нарушенного метаболизма и токсинов. Благодаря экссудации, в очаг воспаления из циркулирующей крови выводятся токсические вещества. В этом заключается своеобразная «дренажная» роль экссудации. † Задержке и/или «фиксации» в очаге воспаления флогогенного фактора и вторичных патогенных продуктов его воздействия на ткань. В данном случае экссудат является своего рода «могильником» для причинного фактора воспаления. • Патогенное значение экссудации и экссудата † Сдавление органов и тканей, а также смещение их от физиологического положения. † Излияние экссудата (в том числе гнойного и/или содержащего патогенные микробы, в полости тела или в сосуды при «расплавлении» их стенок). † Формирование абсцесса или развитие флегмоны. Изменения, характерные для альтерации, а также развитие сосудистых реакций приводит к эмиграции лейкоцитов и других форменных элементов крови за пределы микрососудов в интерстициальное пространство. При этом особое значение в развитии воспалительной реакции имеет эмиграция лейкоцитов. ЭМИГРАЦИЯ ЛЕЙКОЦИТОВ Спустя 1–2 часа после воздействия на ткань флогогенного фактора в очаге острого воспаления обнаруживается большое число вышедших (эмигрировавших) из просвета микрососудов нейтрофилов и других гранулоцитов, а позднее — через 15–20 и более часов — моноцитов, а затем и лимфоцитов. Эмиграция лейкоцитов — активный процесс их выхода из просвета микрососудов в межклеточное пространство. Хронологическая упорядоченность эмиграции разных видов лейкоцитов в очаг острого воспаления обусловлена стадийностью образования и экспрессии на их поверхности молекул адгезии, а также стадийностью появления факторов хемотаксиса. К этим последним относят факторы комплемента C5а, фактор 4 тромбоцитов, метаболиты арахидоновой кислоты, лимфокины и другие (подробнее см. в «Справочник терминов» в статье «Нейтрофил»). Процесс эмиграции последовательно проходит стадии краевого стояния лейкоцитов, их адгезии к эндотелию и проникновения через сосудистую стенку, а также направленного движения лейкоцитов в очаге воспаления (в том числе хемокинез). 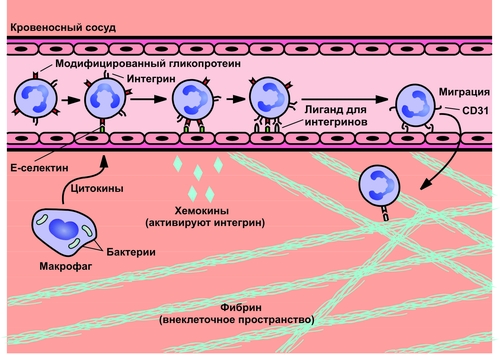 Этапы миграции лейкоцитов через сосудистую стенку (на примере нейтрофилов). [по 4]. КРАЕВОЕ СТОЯНИЕ На стадии краевого стояния (маргинации) условно выделено четыре последовательных этапа (рис. 5–18). 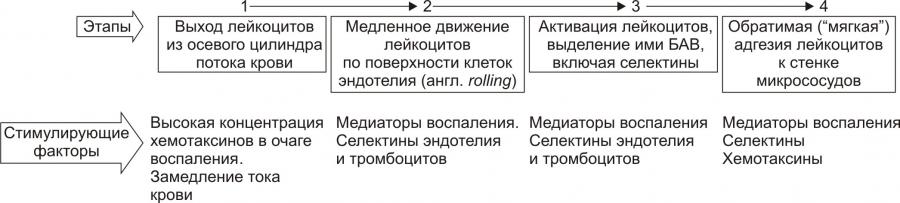 Рис. 5–18. Этапы стадии краевого стояния лейкоцитов и факторы, стимулирующие краевое стояние. АДГЕЗИЯ И ВЫХОД ЛЕЙКОЦИТОВ Этапы устойчивой («плотной») адгезии (1) и прохождения лейкоцитов через стенку микрососуда (2) представлены на рис. 5–19.  Рис. 5–19. Этапы стадии устойчивой адгезии и прохождения лейкоцитов через стенку микрососуда; факторы, стимулирующие адгезию. Плотная адгезия лейкоцитов Причина плотной адгезии лейкоцитов к эндотелию: экспрессия на поверхности лейкоцитов молекул LFA1, MAC1, VLA4, других интегринов и их взаимодействие с компонентами межклеточного матрикса, комплемента и разными молекулами адгезии (например, комплекс LFA1/ICAM1 обеспечивает плотную адгезию лейкоцита к эндотелию и создаёт условия для его последующей миграции через стенку микрососуда). Прохождение лейкоцитов через стенку микрососуда • Существенные препятствия на пути лейкоцитов: пласт клеток эндотелия, межклеточный матрикс стенки сосудов и в особенности базальная мембрана эндотелия. † При прохождении лейкоцитов между клетками эндотелия происходит взаимодействие молекул LFA1, MAC1, VLA4 и других интегринов с молекулами адгезии ICAM, VCAM, CD31. † Прохождение лейкоцитов через базальную мембрану микрососудов существенно облегчается в результате высвобождения лейкоцитами гидролитических ферментов (например, коллагеназ и эластаз). Это обеспечивает гидролиз волокон и основного вещества базальной мембраны. • Различные типы лейкоцитов (нейтрофилы, моноциты, эозинофилы, лимфоциты) используют в ходе экстравазации разный спектр молекул адгезии. • Время прохождения лейкоцитов через стенки микрососудов в очаге воспаления с момента «мягкой» адгезии лейкоцита и клетки эндотелия составляет около 3–6 мин. • При значительном повышении проницаемости стенок сосудов в ткань очага воспаления пассивно выходят эритроциты и тромбоциты, что часто наблюдается при развитии инфБ со значительной интоксикацией организма (при сибирской язве, чуме), при поражении тканей проникающими лучами. НАПРАВЛЕННАЯ МИГРАЦИИ ЛЕЙКОЦИТОВ За пределами стенки микрососуда начинается направленное движение лейкоцитов к зоне поражения — таксис. Ведущие факторы, определяющие хемо- и электротаксис лейкоцитов, перечислены на рис. 5–20. 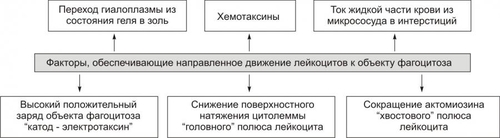 Рис. 5–20. Факторы, обеспечивающие направленное движение лейкоцитов к объекту фагоцитоза. Факторы хемотаксиса подразделяют на экзогенные и эндогенные. • Экзогенные факторы хемотаксиса: эндо и экзотоксины микроорганизмов и другие продукты их жизнедеятельности (например, бактериальные пептиды, имеющие Nформил—метиониловые фрагменты). • Эндогенные факторы хемотаксиса перечислены в статье «Нейтрофил» (см. приложение «Справочник терминов» на компакт-диске) Электротаксиc Электротаксиc — движение лейкоцитов (несущих на своей поверхности отрицательный заряд) по направлению к эпицентру очага воспаления (где накапливаются положительно заряженные частицы — так называемые электротаксины): H+, Na+, Ca2+, K+, Mg2+, мицеллы белка и другие органические соединения, повреждённые и погибшие клетки, формирующие положительный заряд.. Механизмы таксиса • Скопление хеморецепторов (кэппинг) на стороне лейкоцита, обращённой к региону наибольшей концентрации хемотаксинов (хемоаттрактантов). Этот полюс («голова») лейкоцита становится ведущим, а хвостовой — ведомым. • Изменение коллоидного состояния цитозоля лейкоцита: переход из состояния геля в состояние золя. • Снижение поверхностного натяжения на обращённой в сторону очага воспаления области мигрирующего лейкоцита («головной» полюс), что стимулирует перемещение цитозоля лейкоцита именно в головной конец. Это происходит под действие ряда агентов, накапливающихся при воспалении. Поверхностное натяжение снижается под влиянием ВЖК, катионных белков и внеклеточных катионов. • Сокращение актиновых микрофиламентов хвостового полюса и перестройка других структур цитоскелета лейкоцитов. • Выталкивание цитозоля к головному концу и движение лейкоцита в очаг воспаления. • Движению лейкоцита в очаг воспаления способствует ток жидкой части крови из просвета микрососудов через их стенки в интерстиций (по градиенту фильтрационного, осмотического и онкотического давления). ЗНАЧЕНИЕ ЭМИГРАЦИИ ЛЕЙКОЦИТОВ Значение эмиграции лейкоцитов в очаг воспаления отражено на рис. 5–21. 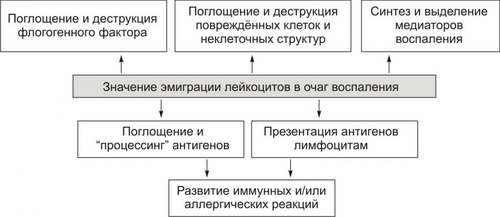 Рис. 5–21. Значение эмиграции лейкоцитов в очаг воспаления. Позднее значительная часть лейкоцитов, мигрировавших в очаг воспаления, подвергается дистрофическим изменениям и превращается в «гнойные тельца» или подвергается апоптозу. Часть лейкоцитов, выполнив свои функции, возвращается в сосудистое русло и циркулирует в крови. ФАГОЦИТОЗ Согласно представлениям И.И. Мечникова (1882), ключевым звеном механизма воспаления является именно фагоцитоз.
|
