Патфиз ч.1. Патфиз ч. Гл. 1 Введение в предмет Гл. 2 Общая нозология
 Скачать 9.21 Mb. Скачать 9.21 Mb.
|
|
Основные источники Пг в очаге воспаления: тромбоциты, активированные лейкоциты, клетки эндотелия, тучные клетки. Эффекты. Пг участвуют в формировании всех компонентов и многих проявлений воспаления. Наиболее выражено их влияние на: • тонус стенок микрососудов (артериол, прекапилляров, капилляров, венул); • адгезивноагрегационные свойства тромбоцитов, лейкоцитов и эритроцитов (поэтому важна роль Пг в регуляции кровоснабжения тканей при воспалении, эмиграции в очаг воспаления лейкоцитов и фагоцитоза); • образование других медиаторов воспаления; • состояние системы гемостаза; • проницаемость стенок микроциркуляторного русла; • развитие лихорадки. Пг весьма мобильны: они синтезируются в течение короткого промежутка времени, разные Пг оказывают различные эффекты и быстро инактивируются. Именно поэтому Пг способны как потенцировать, так и подавлять воспалительную реакцию. • Такой различный эффект разных Пг позволил выделить Пг группы циклопентенонов (ПгF2g, ПгA1, ПгD2), образующихся только под влиянием циклооксигеназы 2; циклопентеноновые Пг подавляют воспалительную реакцию и способствуют заживлению ран. • В то же время ПгE2, ПгI2 и другие Пг, образующихся под влиянием и циклооксигеназы 1, и циклооксигеназы 2, оказывают выраженный эффект на развитие воспалительной реакции. Лейкотриены Лейкотриены — продукты липооксигеназного превращения арахидоновой кислоты в лейкоцитах, тучных клетках и в меньшей мере — в других клетках. Эффекты лейкотриенов • Спазмогенное действие (на ГМК стенок сосудов, а также бронхиол и кишечника) не вызывает тахифилаксии, в связи с чем длительность эффекта лейкотриенов весьма велика. Спазм микрососудов, особенно артериол, в очаге воспаления приводит к развитию ишемии. • Положительный хемотаксический эффект по отношению к фагоцитам. • Повышение проницаемости стенок микрососудов. Продукты свободнорадикального перекисного окисления липидов Альтерация тканей флогогенным агентом и факторами последующих изменений в очаге воспаления приводит к своеобразной цепной реакции: интенсификации свободнорадикальных и липопероксидных процессов. Продукты этих реакций — липидные радикалы, перекиси и гидроперекиси липидов, альдегиды, шиффовы основания и другие — обладают выраженными патогенными свойствами. Эффекты. Продукты свободнорадикального перекисного окисления липидов (СПОЛ) имеют следующие эффекты: • повреждают непосредственно, а также участвуют в реакциях деструкции флогогенного агента; • изменяют физикохимическое состояние мембран клеток тканей и лейкоцитов, находящихся в очаге воспаления; • модифицируют активность клеточных и внеклеточных ферментов. Умеренное усиление СПОЛ вызывает: • обратимое повышение проницаемости мембран клеток и стенок микрососудов; • увеличение каталитической активности ферментов, что способствует интенсификации метаболизма в клетках, эмиграции лейкоцитов в очаг воспаления, повышению эффективности фагоцитоза, пролиферации и созреванию клеток. Чрезмерная интенсификация СПОЛ и липопероксидных процессов обусловливает: • образование в клеточных мембранах сквозных каналов проницаемости и микроразрывов; • повреждение мембранных рецепторных структур; • подавление ферментативных реакций. В совокупности эти изменения сопровождаются существенной альтерацией и гибелью клеток, а также разрушением неклеточных структур в очаге воспаления. НУКЛЕОТИДЫ И НУКЛЕОЗИДЫ Нуклеотиды и нуклеозиды обладают высокой биологической активностью, некоторые их них принимают непосредственное участие в развитии воспалительной реакции. К числу наиболее значимых для развития воспаления относятся АТФ, АДФ и аденозин. АТФ обеспечивает энергетическую «поддержку» и тем самым функции клеток и пластических процессов в них, регуляцию тонуса сосудов, изменения агрегатного состояния крови, регуляцию местного кровотока. АДФ стимулирует адгезию, агрегацию и агглютинацию форменных элементов крови. Это вызывает тромбообразование, формирование сладжа, нарушение крово и лимфотока в сосудах микроциркуляторного русла. • Если указанные процессы протекают преимущественно в артериолах, то развивается ишемия, если в венулах — венозная гиперемия. • Оба эти состояния чреваты развитием стаза (ишемического, венознозастойного, истинного). Аденозин, высвобождающийся из клеток, оказывает существенный сосудорасширяющий эффект, сопровождающийся развитием артериальной гиперемии. ПЛАЗМЕННЫЕ МЕДИАТОРЫ ВОСПАЛЕНИЯ К плазменным медиаторам воспаления относятся кинины, факторы системы комплемента и факторы гемостаза (рис. 5–11). 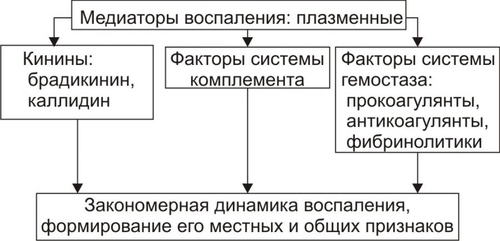 Рис. 5–11. Основные классы плазменных медиаторов воспаления. КИНИНЫ Кинины обнаруживаются во всех тканях и жидкостях организма. Им свойственен широкий спектр биологических эффектов. Эти вещества образуют кининовую систему. Компоненты кининовой системы (рис. 5–12) 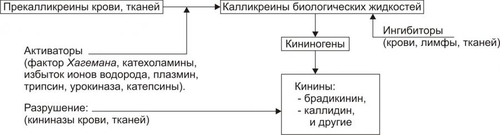 Рис. 5–12. Компоненты кининовой системы. Кининогены — cубстраты, из которых образуются кинины — синтезируются в основном в печени. В небольших количествах они образуются также в тканях лёгких, почек, сердца, кожи и некоторых других органов. Кининогеназы (калликреины) — протеолитические ферменты, при участии которых образуются кинины. Калликреиногены (прекалликреины) — предшественники калликреинов. Кинины (к ним относятся многие вещества; при развитии воспаления наибольшее значение имеют брадикинин и каллидин). Каллидин — декапептид, образуется главным образом под влиянием тканевых калликреинов. Под действием тканевых и плазменных аминопептидаз каллидин превращается в брадикинин. Брадикинин — нонапептид, образуется преимущественно под влиянием плазменных калликреинов. Кининазы — ферменты, специфически разрушающие кинины (карбоксипептидазы). В норме в плазме крови и тканях определяется небольшое количество кининов, но при действии флогогенного фактора и развитии последующих вторичных изменений в очаге воспаления появляется большое количество агентов, активирующих образование кининов: избыток Н+, катехоламины, катепсины, фактор Хагемана и многие другие. Эффекты кининов • Повышение проницаемости стенок микрососудов (в этом отношении брадикинин в 10–15 раз активнее гистамина). • Потенцирование развития отёка и микрогеморрагий. • Расширение просвета артериол за счёт непосредственного воздействия на ГМК. Этот эффект, в свою очередь, способствует развитию артериальной гиперемии, • Стимуляция миграции фагоцитов в очаг воспаления. Факторы системы комплемента При воспалении факторы системы комплемента играют существенную роль в неспецифической инактивации и деструкции флогогенного агента, повреждённых и погибших клеток тканей. Происхождение в очаге воспаления • Факторы системы комплемента синтезируются преимущественно клетками печени, а также костного мозга и селезёнки и поступают в очаг воспаления с кровью. • Другая часть факторов комплемента продуцируется и выделяется местно — мононуклеарными фагоцитами, находящимися в воспалённой ткани. • Лейкоциты продуцируют компоненты комплемента C1C9, а также инактиватор C3b. Эффекты • Активация хемотаксиса. • Потенцирование опсонизации объекта фагоцитоза. • Цитолитические эффекты. • Бактерицидные эффекты. • Регуляция образования кининов, факторов системы гемостаза, а также активности T- и B-лимфоцитов. Факторы гемостаза Факторы системы гемостаза можно подразделить на три группы: прокоагулянтные, антикоагулянтные и фибринолитические. Причины активации прокоагулянтных факторов в очаге воспаления: • Повреждение флогогенным агентом и вторичными факторами альтерации тканевых клеток. • Повреждение эндотелия Одновременно с этим активируются антикоагулянтные и фибринолитические факторы. Последствия активации • Образование тромбов. • Нарушения кровообращения в очаге воспаления — ишемия, венозная гиперемия и стаз. Медиаторы воспаления обусловливают развитие и/или регуляцию как процессов альтерации (включая изменение обмена веществ, физикохимических параметров, структуры и функции), так и сосудистых реакций, экссудации жидкости и эмиграции клеток крови, фагоцитоза, пролиферации и репаративных процессов в очаге воспаления. ИЗМЕНЕНИЯ ФУНКЦИЙ ТКАНЕЙ И ОРГАНОВ Воздействие на ткань флогогенного агента и следующие за этим изменения крово и лимфообращения, метаболизма, физикохимических параметров и структуры вызывают существенные функциональные нарушения. Этот признак воспаления впервые выделил Клавдий Гален, обозначивший его как functio laesa — потеря, нарушение функции. Проявления functio laesa представлены на рис. 5–13). 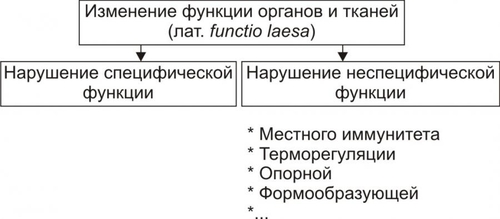 Рис. 5–13. Изменения функций органов и тканей при воспалении. Расстройства как специфических, так и неспецифических функций клеток, органов и тканей нередко приводит к расстройствам жизнедеятельности организма в целом. Таким образом, альтерация, как инициальный этап и компонент воспалительного процесса, характеризуется развитием закономерных изменений метаболизма, физикохимических свойств, образованием и реализацией эффектов БАВ, отклонением от нормы структуры и функции тканей в очаге воспаления. Указанные изменения, • с одной стороны, обеспечивают экстренную активацию процессов, направленных на локализацию, инактивацию и деструкцию патогенного агента, • с другой стороны, являются базой развития других компонентов воспаления — сосудистых реакций, экссудации жидкости, эмиграции лейкоцитов, фагоцитоза, пролиферации клеток и репарации повреждённой ткани. СОСУДИСТЫЕ РЕАКЦИИ Компонент воспаления «сосудистые реакции и изменения крово и лимфообращения» является результатом альтерации ткани. Понятие «сосудистые реакции» подразумевает изменения тонуса стенок сосудов, их просвета, крово и лимфообращения в них, проницаемости сосудистых стенок для клеток и жидкой части крови (рис. 5–14, см. также рис. 22–45 и рис. 22–54).  Рис. 5–14. Сосудистые реакции, изменение крово и лимфообращения как компонент воспаления. При воспалении на разных стадиях сосудистых реакций происходят следующие важные и последовательные процессы. • Повышение тонуса стенок артериол и прекапилляров, сопровождающееся уменьшением их просвета и развитием ишемии. • Снижение тонуса стенок артериол, сочетающееся с увеличением их просвета, развитием артериальной гиперемии, усилением лимфообразования и лимфооттока. • Уменьшение просвета венул и лимфатических сосудов, нарушение оттока крови и лимфы по ним с развитием венозной гиперемии и застоя лимфы. • Дискоординированное изменение тонуса стенок артериол, венул, пре и посткапилляров, лимфатических сосудов, сочетающееся с увеличением адгезии, агрегации и агглютинации форменных элементов крови, её сгущением и развитием стаза. Закономерный характер течения воспаления в значительной мере определяется именно стереотипной сменой тонуса стенок и просвета микрососудов, а также крово и лимфотока в них. Сосудистые реакции подразделяют на последовательно развивающиеся в данном участке воспаления стадии ишемии, венозной гиперемии, артериальной гиперемии и стаза. Эти стадии, наблюдающиеся при них изменения и их последствия рассмотрены в разделе «Нарушения регионарного кровотока» главы 22 «Патофизиология сердечнососудистой системы». ИШЕМИЯ При воздействии на ткань флогогенного агента, как правило, развивается кратковременное (на несколько секунд) повышение тонуса ГМК стенок артериол и прекапилляров, т.е. локальная вазоконстрикция. Эта первая стадия сосудистых реакций в виде местной вазоконстрикции приводит к нарушению кровотока — ишемии. ПРИЧИНЫ Причина вазоконстрикции — высвобождение под влиянием альтерирующего фактора БАВ с сосудосуживающим эффектом: катехоламинов, тромбоксана А2, Пг. Преходящий характер вазоконстрикции и ишемии объясняется быстрой инактивацией катехоламинов ферментами (главным образом, моноаминоксидазой), разрушением Пг в реакциях окисления. ЗНАЧЕНИЕ Значение ишемии состоит в локализации повреждающего влияния флогогенного агента и в препятствии его распространению за пределы очага непосредственного контакта с тканью. Проницаемость стенок микрососудов на этом этапе сосудистых реакций ещё не увеличена. Ишемия рассмотрена в разделе «Нарушения регионарного кровотока» главы 22 «Патофизиология сердечнососудистой системы», в том числе на рисунках 22–49, 22–50 и 22–51 и в сопровождающем их тексте. АРТЕРИАЛЬНАЯ ГИПЕРЕМИЯ Вторая стадия сосудистых реакций в виде расширения просвета артериол и прекапилляров приводит к артериальной гиперемии — увеличению притока артериальной крови и кровенаполнения ткани. МЕХАНИЗМЫ Из механизмов, приводящих к развитию артериальной гиперемии, ведущее значение имеют нейрогенный, гуморальный и миопаралитический. Нейрогенный механизм Нейрогенный (холинергический по своему существу) развития артериальной гиперемии характеризуется: • увеличением высвобождения парасимпатическими нервными окончаниями ацетилхолина. • Повышением чувствительности холинорецепторов к ацетилхолину, что, как правило, наблюдается в условиях избытка внеклеточного содержания K+ и H+ (характерно для очага воспаления). Гуморальный механизм Гуморальный компонент механизма развития артериальной гиперемии заключается в местном увеличении образования медиаторов с сосудорасширяющим действием: кининов, ПгЕ, ПгI, аденозина, оксида азота, гистамина. Миопаралитический механизм заключается в уменьшении базального тонуса артериол. Пролонгированный характер артериальной гиперемии, нередко наблюдающийся при воспалении, обусловлен избыточным синтезом указанных веществ, повышением чувствительности тканей в очаге воспаления к ним, замедленной инактивацией БАВ при воспалении, снижением базального тонуса артериол (так называемый миопаралитический эффект). ЗНАЧЕНИЕ И ПОСЛЕДСТВИЯ При артериальной гиперемии к тканям увеличивается приток кислорода, субстратов метаболизма и — в связи с этим — возрастает фильтрационное давление. Последнее в регионе артериальной гиперемии ведёт к некоторому повышению объёма межклеточной жидкости с низким содержанием белка (транссудата). Одновременно происходят активация обмена веществ и синтеза новых клеточных и неклеточных структур взамен повреждённых или погибших. В то же время чрезмерная и/или затянувшаяся артериальная гиперемия может создать условия для оттока из очага воспаления токсичных соединений, микроорганизмов, БАВ и попаданию их в общий кровоток. Длительное расширение артериол и прекапилляров может сочетаться также с постепенно нарастающим повышением проницаемости стенок микрососудов под влиянием медиаторов воспаления, образующихся в очаге воспаления. Жидкость и содержащиеся в ней белки из просвета микрососудов выходят во внесосудистое пространство — начинает образовываться экссудат. Последствия артериальной гиперемии приведены также на рис. 22–47 и в сопровождающем его тексте. Сам процесс артериальной гиперемии рассмотрен в разделе «Нарушения регионарного кровотока» главы 22 «Патофизиология сердечнососудистой системы», в том числе на рис. 22–46. ВЕНОЗНАЯ ГИПЕРЕМИЯ Параллельно с вышеуказанными изменениями, как правило, появляются признаки венозной гиперемии в виде увеличения просвета посткапилляров и венул и замедления в них тока крови. ПРЕДСТАЗ Через некоторое время появляются периодические маятникообразные движения крови «вперёд ПРИЧИНЫ ВЕНОЗНОЙ ГИПЕРЕМИИ И ПРЕДСТАЗА • Сдавление венул экссудатом. • Сужение просвета венул микротромбами, агрегатами форменных элементов крови, набухшими клетками эндотелия. • Снижение тонуса стенок венул в результате уменьшения возбудимости их нервномышечных элементов, а также — повреждения их волокнистых структур и межклеточного вещества под действием флогогенного фактора, избытка медиаторов воспаления, в том числе ферментов (эластаз, коллагеназ, других гидролаз). • Сгущение крови, повышение её вязкости и понижение, в связи с этим, текучести, что определяется повышенным выходом плазмы крови в ткань при экссудации. • Скопление большого количества лейкоцитов у стенок посткапилляров и венул (феномен краевого стояния лейкоцитов). Венозная гиперемия рассмотрена в разделе «Нарушения регионарного кровотока» главы 22 «Патофизиология сердечнососудистой системы», в том числе на рис. 22–48. |
